Актуальність теми
Ожиріння – складне нейроендокринне та метаболічне захворювання, яке спричиняє значну кількість розладів у репродуктивній системі. Здобутки фундаментальних наук останнього десятиліття дозволили інакше оцінити жирову тканину, яка відіграє важливу комплексну роль в організмі. Велике значення мали відкриття, присвячені вивченню функції адипоцитів і фібробластів жирової тканини, в яких синтезуються гормони, пептиди й інші біологічно активні речовини, що чинять ауто-, пара- та ендокринні дії [1, 2, 3, 4, 8, 9]. Встановлено, що у пацієнтів з абдомінальним ожирінням жирова тканина сальника є основним джерелом підвищеного рівня в плазмі крові інгібітора активатора плазміногену-1 (PAI-1). При нормальній масі тіла синтез PAI-1 відбувається в основному в гепатоцитах і ендотеліальних клітинах, меншою мірою – у клітинах гладкої мускулатури і тромбоцитах [8, 9].
Дослідження, присвячені ролі тромбофілії, які проводилися від початку 90-х р. ХХ ст., засвідчили вкрай високу частоту їх не лише у пацієнток із різними тромбоемболічними ускладненнями, але й типово акушерськими ускладненнями, такими як звичні викидні, важкі гестози, передчасне відшарування нормально розташованої плаценти, синдром затримки внутрішньоутробного розвитку, антенатальна загибель плода [1, 3, 4, 8, 9].
Незважаючи на доведену роль ожиріння у патогенезі акушерських ускладнень, жінок із надмірною масою тіла не відокремлюють із когорти вагітних, а також не також не індивідуалізують підхід до їх ведення під час вагітності [8, 9]. Саме тому не викликає сумнівів робота, метою якої було визначення ролі генних поліморфізмів у перебігу гестаційного процесу та їх вплив на систему гемостазу вагітних жінок з ожирінням, а також оцінка впливу міжгенної взаємодії генів-кандидатів тромбофілії та порушення обміну фолатів на виникнення акушерських ускладнень та перинатальних втрат у вагітних жінок залежно від їх фенотипу.
Матеріали та методи дослідження
Для досягнення поставленої мети на базі відділення медицини плода та патології ранніх термінів вагітності комунального закладу «Дніпропетровський обласний перинатальний центр зі стаціонаром «ДОР« (КЗ «ДОПЦС «ДОР») м. Дніпро проводили відбір жінок із загрозою невиношування вагітності та різною масою тіла, гестаційний термін яких не перевищував 12 тижнів. Для досягнення поставленої мети було відібрано 175 жінок із загрозою невиношування вагітності віком від 20 до 41 років, які були залучені та надалі розподілені по групах дослідження: І клінічна група – 120 (68,6%) жінок із загрозою невиношування вагітності на фоні надлишкової ваги, ІІ клінічна група – 55 (31,4%) вагітних жінок із нормальної вагою (ІМТ 20–24,9 кг/м2) та із загрозливими для виношування вагітності симптомами, у яких було проведено поглиблене вивчення стану здоров’я.
Окрім загальноклінічних методів дослідження, які рекомендовані Наказами МОЗ №417 та №624, у розширеному обсязі, за індивідуальною згодою жінки, було проведено дослідження 8 генетичних варіантів поліморфізму генів тромбофілії та поліморфізму 4 генів, що відповідають за обмін фолатів методом ПЛР у режимі реального часу на базі мережі лабораторій «Synevo» (сертифікована згідно з вимогами ISO 9001:2001 та 9001:2000; ліцензія МОЗ України АГ №599651 від 26.12.2011; свідоцтво про атестацію №ПТ-021/12 від 06.04.2012 р.).
Статистичну обробку матеріалів дослідження проводили з використанням методів біостатистики [11], реалізованих у пакетах програм STATISTICA v.6.1 (Statsoft Inc., США) (ліцензійний № AJAR909E415822FA) та MedCalс (MedCalc Software, Belgium) v.9.6.4.0.
Надмірну масу тіла мали 50 (41,6%) жінок І клінічної групи, ожиріння І ступеня – 59 (49,2%), ІІ–ІІІ ступеня – 11 (9,2%) вагітних, середній ІМТ – 30,6±0,3 (95% ДІ: 30,1–31,2) кг/м2. У жінок ІІ клінічної групи ІМТ у середньому складав 21,3±0,2 (95% ДІ: 20,8–21,8) кг/м2 (р<0,001 між групами за t-критерієм).
Середній вік вагітних у І групі склав 30,9±0,4 (95% ДІ: 30,0–31,8) років, у ІІ групі – 30,3±0,6 (95% ДІ: 29,1–31,5) років (р=0,460 між групами по t-критерію). Середній гестаційний вік на момент узяття на облік дорівнював 9,39±0,59 (95% ДІ: 8,22–10,56) тижнів і 8,42±0,69 (95% ДІ: 7,03–9,81) тижнів, відповідно до груп (р=0,327 за t-критерієм). Таким чином, за цими показниками виділені клінічні групи були статистично порівнянними (p>0,05).
Результати та їхнє обговорення
Нами не було виявлено достовірних відмінностей між групами як за паритетом вагітності: 2,5 [1,0; 4,0] вагітностей в основній групі проти 2,0 [1,0; 3,0] вагітностей у групі порівняння (р=0,232 за U-критерієм), так і за паритетом майбутніх пологів – 1,0 [1,0; 2,0] проти 1,0 [1,0; 1,0] відповідно (р=0,086 за U). Водночас у жінок із надмірною вагою ці показники мали значніші коливання: коефіцієнти варіації (С) дорівнювали 72,5 і 46,8% відповідно, а при нормальному ІМТ варіація складала 55,9 % і 40,6% (р<0,001 і р=0,037 за критерієм F).
Вагітні обох тематичних груп під час госпіталізації до стаціонару скаржилися на ниючі болі внизу живота – 108 (90,0%) жінок основної групи та 53 (96,4%) групи порівняння (р=0,462 за критерієм c2); кров’янисті виділення зі статевих шляхів у 39 (32,5%) та 24 (43,6%) жінок відповідно (р=0,154 за c2); сполучення обох клінічних симпт омів спостерігалося у 27 (22,5%) та 22 (40,0%) пацієнток обох клінічних груп (р=0,017 за c2).
Вагітність настала самостійно у термін у середньому від 1 до 4 самостійних фертильних циклів без контрацепції у 97 (80,8%) жінок І групи та 48 (87,3%) – ІІ групи (р = 0,294 за c2). У 23 (19,2%) жінок основної і в 7 (12,7%) пацієнток групи порівняння вагітність настала за допомогою допоміжних репродуктивних технологій (ДРТ). Проте лише в одному випадку в першій клінічній групі і у двох – у другій групі використання ДРТ, пояснювалося відсутністю прохідності маткових труб. Невдачі екстракорпорального запліднення (ЕКЗ) в анамнезі (напередодні вагітності, яку ми спостерігали) мали місце у 7 (5,8 %) та 3 (5,5%) жінок обох клінічних груп, відповідно (р=0,920 за c2) [10,11].
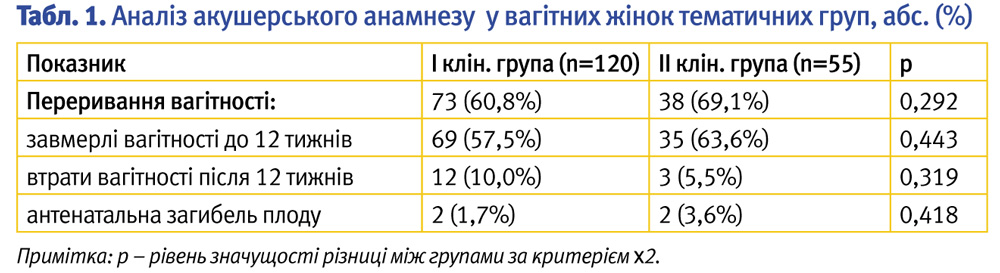
Привертав увагу той факт, що у 111 (63,4%) жінок в анамнезі відзначалися випадки переривання вагітності (табл. 1).
В однієї жінки ІІ клінічної групи констатовано в анамнезі народження дитини із недіагностованим напередодні пологів синдромом Дауна.
Результати дослідження поліморфізму генів тромбофілії виявили поліморфізм генів у різній комбінації в 100% випадків, однак було виявлено ряд особливостей для кожної групи жінок.
У жінок ІІ клінічної групи не виявлено жодного випадку поліморфізму гена F2: 20210 G>A, в той час як у жінок І клінічної групи було виявлено 6 (5,0%) гетерозиготних поліморфізмів (r=0,128, р=0,092). Крім того, з мутацією в гені F2-протромбін асоціювались невдачі ЕКЗ (r=0,296, р=0,010), випадки втрати вагітності після 12 тижнів в анамнезі (r=0,234, р=0,038), підвищення рівня ГЦ в ІІ триместрі вагітності (r=0,178, р=0,023).
При аналізі частот поліморфізму F5-Лейден: 1691 G>A в І групі виявлено 7 (5,8 %) випадків гомозиготного поліморфізму за патологічним алелем, що робить цих жінок групою вкрай високого ризику щодо виникнення в них тромбогеморагічних ускладнень, в той час як в ІІ клінічній групі таких випадків не відзначено [1,2,3,9]. Виявлений статистично значущий взаємозв’язок між наявністю надмірної ваги у жінок і мутацією чинника згортання крові F5-Лейден (r= 0,260, р=0,001). З мутацією в гені F5-Лейден асоціювалися невдачі ЕКЗ (r=0,287, р=0,013) – 4 з 10 випадків (40,0%) проти 7 з 64 (10,9%) випадків у жінок, серед яких не було імплантаційних втрат вагітності, а також порушення рівня плацентації (r=0,157, р=0,038).
Зміни в гені F7 мають протективний ефект відносно ризику розвитку тромбоемболії. Заміна гуаніну (G) на аденін (А) у позиції 10976 (генетичний маркер G10976A) призводить до зниження активності F7 та сприяє зменшенню тромбоутворення. Для клінічної практики важливим було виявлення сполучення патологічних та гетерозиготних форм F5 і F7 у цих жінок, що пояснювало факт виживання в позаутробному житті патологічних гомозигот гена F5-Лейден. У 10 випадках спостерігалося сполучення мутацій F5-Лейден: 1691 G→А та F7: 10976 G→A, а в 7 випадках сполучення F5-Лейден: 1691 G→G та F7: 10976 G→A. Тобто усі випадки патологічної гомозиготи за алелем F5-Лейден сполучались із гетерозиготним поліморфізмом гена F7. Був виявлений статистично значущий взаємозв’язок між наявністю надмірної ваги в жінок і мутацією чинника згортання крові F7 (r=0,155, р=0,040).
Частота виявлення різних поліморфізмів гена Серпін-1 (PAI-1) відрізнялася у вагітних обох клінічних груп (r=0,18, р=0,017). Патологічна гомозигота гена Серпін-1 у жінок із надмірною вагою відзначалася частіше в 1,7 разу (40,8 % проти 23,6%, р=0,027 за c2), а гетерозиготний поліморфізм виявлений у 53 (44,2%) та 27 (49,1 %) пацієнток І та ІІ клінічної групи, що було статистично незначущим (р=0,544 за c2). Виявлена вірогідна асоціація носійства поліморфізму цього гена з підвищенням рівня фібриногену (r=0,158, р=0,037), який є додатковим маркером метаболічних порушень при ожирінні.
Аналіз поліморфізму гена F13A1: 9 G>T у жінок по групах не виявив статистично значущої кореляції з ІМТ (r=0,134, р=0,077). Водночас, встановлена вірогідна кореляція носійства поліморфізму цього гена зі зниженням агрегації тромбоцитів r=-0,194 (р=0,010) і ступеня ретракції r=-0,162 (р=0,032), з результатами патогістологічного дослідження плаценти (ПГД) r=0,214 (р=0,005), які свідчили про хронічну недостатність фето-плацентарного комплексу в стадії компенсації. Цей поліморфізм зумовлював підвищену кровоточивість у цих жінок. Їм були притаманні носові та ясневі кровотечі, а також при виникненні відшарування оболонок утворювалась більш об’ємна гематома, ніж за відсутності поліморфізму в цьому гені.
Наявність поліморфізму гена ITGA2-a2 інтегрин: 807 C>T , який був виявлений, в жінок обох тематичних груп не була статистично достовірною, однак патологічна гомозигота спостерігалася вдвічі частіше у жінок із нормальною вагою: 11 (20,0 %) випадків проти 13 (10,8 %) у жінок з надмірною вагою (р=0,102 за c2). Виявлені поліморфізми корелювали із підвищенням активованого часткового тромбопластинового часу (АЧТЧ) (r=0,158, р=0,037), тромбінового часу (r=0,156, р=0,039) й агрегації тромбоцитів (r=0,166, р=0,028), що пояснювалося присутністю на поверхні тромбоцитів рецепторів, що є комплексом білків інтегринів. Зміни властивостей рецепторів призводять до збільшення швидкості адгезії тромбоцитів. Саме тому при визначенні подібного поліморфізму у жінок спостерігалося зниження кількості тромбоцитів у венозній крові, що свідчило про активацію судинно-тромбоцитарної ланки згортальної системи.
Результати дослідження поліморфізму генів, що кодують фолатний цикл, виявили високий відсоток спостережень з боку поліморфізму МТНFR: 677 С>Т – 77 (64,2%) та 34 (61,8%) випадки в обох клінічних групах відповідно (р=0,765 за c2), з яких: у І групі 68 (56,7%) випадків гетерозиготних поліморфізмів та 9 (7,5%) – гомозиготних за алелем 2, а в ІІ клінічній групі – 26 (47,3%) та 8 (14,5%) випадків відповідно.
Водночас частота виявлення поліморфізму з боку МТНFR:1298 А>С була нижчою та складала 65 (54,2%) випадків проти 22 (40,0%) у жінок І та ІІ клінічної групи (r=0,127, р=0,093), із яких: у І групі 53 (44,2%) випадків гетерозиготних поліморфізмів та 12 (10,0%) – гомозиготних за алелем 2, а в ІІ клінічній групі – 18 (32,7%) та 4 (7,3%) випадків відповідно.
У 89 (74,2%) та 46 (83,6%) жінок виявлено генетичну схильність з боку МТRR:66 А>G: 54 (45,0%) – гетерозиготних мутацій та 35 (29,2%) гомозигот за алелем 2 в І клінічній групі, а в ІІ – 30 (54,5%) та 16 (29,1%) відповідно, що не відрізняло групи між собою (r=-0,058, р=0,446).
За результатами кореляційного аналізу встановлені статистично значущі взаємозв’язки мутації генів, що кодують обмін фолатів, із такими факторами: поліморфізм гена МТR: 2756-В12-залежної метіонін-синтази асоціювався зі спадковою схильністю до надмірної ваги тіла (r=0,188, р=0,013); мутації гена МТНFR: 677 прямо корелювали зі збільшенням ступеня агрегації (r=0,150, р=0,048) і ретракції тромбоцитів (r=0,163, р=0,030); генетичні мутації з боку МТRR:66 асоціювались із загрозою переривання вагітності до 12 тижнів (r=0,154, р=0,042), аномальним передлежанням плаценти (r=0,148, р=0,050), підвищенням рівня фібриногену (r=0,151, р=0,046).
Гіпергомоцистеїнемія (ГГЦ) у списку тромбофілій стоїть дещо окремо [2, 3, 5, 6, 7, 10]. На відміну від інших форм генетичної тромбофілії при гіпергомоцистеїнемії немає початкових порушень у системі гемостазу, вони розвиваються опосередковано, при порушенні в роботі ферментних систем. накопиченні гомоцистеїну в плазмі крові, розвитку оксидантного стресу. Вищезазначений напрямок дослідження, рівень гомоцистеїну та характеристика показників тромбінемії будуть представлені в другій частині статті.
Таким чином:
- Значущість діагностики спадкової схильності до обтяженого акушерсько-гінекологічного анамнезу зростає при оцінці взаємодії генотип-фенотип. Більшість асоціативних генетичних досліджень не враховують таких феноменів генетичної архітектури, як локусна гетерогенність, фенокопії, ген-середовищні й міжгенні взаємодії.
- Дослідження на материнську тромбофілію повинно проводитися на прегравідарному етапі з метою проведення своєчасного патогенетично обгрунтованного лікування з акцентом на лікуванні у фертильному циклі, що дасть змогу покращити перинатальні наслідки у цих жінок.
Перелік літератури знаходиться у редакції.

коментарів