Вступ
Рак шийки матки (РШМ) є третім найбільш розповсюдженим онкологічним захворюванням серед жінок у світі та сьомим у загальній популяції. Щороку реєструється біля 530 000 нових випадків та біля 270 000 смертей від цього захворювання (Arbyn M. et al. 2011: 2675-2686; Ferlay J. et al. 2010: 2893-2917). Практично всі випадки РШМ виникають у результаті персистенції ВПЛ ВКР (Walboomers J.M. et al. 1999: 12-19). Однак, РШМ є рідкісним ускладненням широко розповсюдженої інфекції. Так, ризик інфікування ВПЛ ВКР протягом життя складає біля 80%, але у більшості випадків вірус нейтралізується імунною системою людини і не призводить до пошкоджень епітелію. У свою чергу, більша частина ВПЛ-інфекції, що не була знищена, викликає ураження, які є «продуктивними», тобто призводять до збільшення копій вірусу. Незважаючи на те, що подібні інфекції не демонструють жодних ознак клітинної трансформації, з морфологічної точки зору у них часто спостерігаються такі ж ознаки дисплазії, які характерні для передракових станів. Невелика частина ВПЛ-інфекції може перейти у «трансформуючу», яка характеризується зміненою експресією вірусних генів Е6 та Е7. Такий стан може призвести до раку, але на цей перехід у більшості випадків потрібно багато років. Таким чином, актуальним є впровадження у клінічну практику нових маркерів, що допоможуть визначити короткостроковий ризик малігнізації дисплазії, асоційованої з трансформуючою фазою ВПЛ-інфекції.
У даній статті ми оглянемо останні досягнення, що дозволяють глибше зрозуміти розвиток та прогресування трансформуючих ВПЛ-інфекцій. У центрі уваги залишаються генетичні та епігенетичні зміни клітин, що лежать в основі злоякісної трансформації, а також їх вплив на розвиток нових молекулярних інструментів для скринінгу раку шейки матки.
Розвиток паліломовірусної інфекції
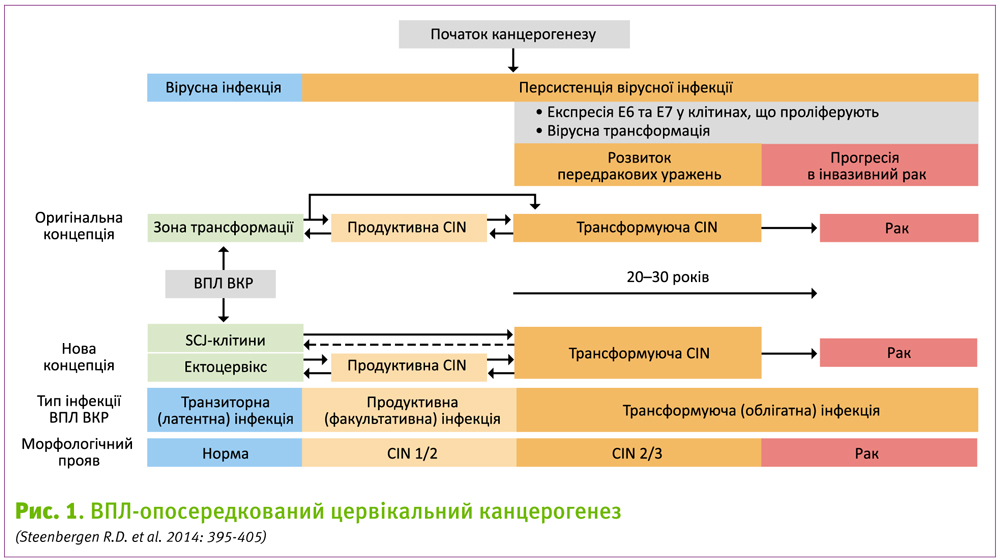
Після інфікування ВПЛ рак шийки матки розвивається у декілька етапів: персистенція ВПЛ, ВПЛ-опосередкована трансформація епітеліальних клітин, розвиток передракових уражень (CIN1-3) і прогресія до інвазивної карциноми. Передракові стани можуть розвитись впродовж 3–5 років після первинного інфікування (Snijders P.J. et al. 2006: 152-164), але подальша прогресія у інвазивний рак може зайняти до 20–30 років (McCredie M.R. et al. 2008: 425-434; Vink M.A. et al. 2013: 1161-1169). Таким чином, є достатньо часу для виявлення передракового стану, що сприяло успіху цитологічного скринінгу для зниження захворюваності і смертності від раку шийки матки у країнах західного світу (Peto J. Et al. 2004: 249-256).
Розглянемо особливості розвитку продуктивних та трансформуючих інфекцій. Продуктивні інфекції розвиваються при потраплянні вірусу до базальної мембрани, після чого він проникає до базальних епітеліальних клітин. У інфікованих базальних клітинах вірусний геном реплікується разом з клітинною ДНК та існує у вигляді епісом. У цих клітинах експресія вірусних білків підтримується на низькому рівні, що дозволяє уникнути імунної відповіді. Після поділу одна з клітин підлягає диференціації та виходить з клітинного циклу. Процес диференціації призводить до активації експресії вірусних генів, у тому числі E6 та E7, які повертають клітину у S-фазу клітинного циклу і таким чином підтримують розмноження вірусного геному. у верхньому шарі епітелію проходить останній етап життєвого циклу вірусу, який полягає у зборці вірусних частинок, які виходять з диференційованих клітин, що злущуються (Chow L.T. et al. 2010: 422-449). Продуктивні інфекційні ураження шийки матки можуть призвести до клітинних змін низького та помірного ступеня і гістологічно проявляються у вигляді CIN1-2. Зміни, викликані продуктивною інфекцією, зазвичай спонтанно регресують протягом 1–2 років у результаті елімінації вірусу шляхом формування клітинної імунної відповіді на продукти генів Е2, Е6 та Е7. Існують різні механізми виходу вірусу з-під контролю імунної системи, такі як вірус-опосередковане пригнічення вродженого імунітету, пригнічення функції ефекторних Т-лімфоцитів, збільшення кількості регуляторних Т-клітин у мікрооточенні пухлини, та інші (Stern P.L. et al. 2012: F71-F82). Втрата імунного контролю має вирішальне значення для ВПЛ-опосередкованого канцерогенезу, однак ВПЛ є необхідним фактором не тільки для ініціації, але і для подальшої трансформації клітини (Hausen H. 2000: 690-698).
Морфологічно CIN3 та частина CIN2 є наслідком трансформуючої ВПЛ-інфекції, при якій відбувається рання гіперекспресія вірусних генів Е6 та Е7 у проліферуючих клітинах. Тим не менше, CIN2, пов’язані з продуктивною інфекцією, морфологічно не відрізняються від CIN2, що виникла у результаті трансформуючої інфекції. У контексті клітинного циклу Е6 та Е7 є вірусними онкогенами, безпосереднім результатом дерегуляції експресії яких при трансформуючій інфекції є порушення регуляції клітинного циклу та системи репарації ДНК. Клітинами, які є найбільш чутливими до трансформації ВПЛ, є клітини перехідної зони від плаского до циліндричного епітелію (SJC-перехід). Припускається, що саме ця популяція клітин є клітинним попередником більшості випадків раку шийки матки (Herfs M. et al. 2012: 10516-10521), у той час, як продуктивні інфекції розвиваються виключно з інфікованих базальних клітин плоского епітелію, що вистилає ектоцервікс або суміжну зону трансформації (Mcnairn A.J., Guasch G. 2011: 21-28).
Клітини SJC-переходу мають унікальний профіль експресії деяких генів, таких як Цитокератин 7, матриксна протеїназа 9, гуанін деаміназа та ген переднього градієнту 2, а білки, що ними кодуються, є маркерними для цих клітин (Herfs M. et al. 2012: 10516-10521). Експресія цих білків не індукується генами Е6 та Е7 у клітинах плаского епітелію у умовах in vitro та зменшується після видалення клітин SJC-переходу при конізації шийки матки.
Таким чином, SJC-специфічний профіль експресії у дисплазіях і раках шийки матки не є набутим у процесі трансформації, а відображає ембріональне походження клітин. Цікаво, що всі досліджені випадки раку шийки матки, більшість станів CIN2-3 та третина CIN1 мали профіль експресії SJC (Herfs M. et al. 2012: 10516-10521; Herfs M. et al. 2013: 1311-1318). Висока трансформаційна чутливість SJC-клітин у порівнянні з клітинами плаского епітелію ектоцервіксу та зони трансформації підтверджується також тим фактом, що ВПЛ-асоційовані передракові стани високого ступеню злоякісності зустрічаються у 20 раз частіше у шийці матки (що містить клітини SJC-переходу), ніж у інших ділянках статевої системи, де SJC-клітини відсутні, таких як піхва та вульва (Martel C. et al. 2012: 607-615).
Кінцевим результатом дерегуляції експресії Е6 та Е7 є хромосомна нестабільність (Korzeniewski N. et al. 2011: 113-122), яка, ймовірно, забезпечує потенційну можливість для накопичення змін у онкогенах і прогресію у злоякісне захворювання.
Первинні ефекти дерегуляції Е6 та Е7
До недавнього часу вважалось, що вплив онкогенів Е6 та Е7 на функцію відповідно р53 та RB1, є основними подіями, що призводять до злоякісної трансформації. Так, супресія RB1 продуктом гену Е7 призводить до підвищеної проліферації клітин, а Е6 активує убіквітин-опосередковану деградацію р53, що перешкоджає нормальному р53-залежному апоптозу, індукованому генотоксичним стресом (Moody C.A., Laimins L.A. 2010: 550-560; Klingelhutz A.J., Roman A. 2012: 77-98).
Сьогодні стало очевидним, що р53 і RB1 є не єдиними посередниками трансформаційної дії Е6 та Е7. Деякі з цих шляхів призводять до ремоделювання хроматину (McLaughlin-Drubin M.E., Munger K. 2013: 1231-1249). Е6 та Е7 можуть також модулювати метилювання ДНК, що впливає на експресію різних генів. Так, Е6 може підвищувати активність ДНК метилтрансферази DNMT1 шляхом супресії р53 (Au Yeung C.L. et al. 2010: 1599-1604), а Е7 здатен безпосередньо зв’язуватись та активувати DNMT1 (Burgers W.A. et al. 2007: 1650-1655).
У підтримку цих даних, отриманих у експериментах in vitro, було показано, що DNMT1 та DNMT3b активуються у ураженнях CIN3 та РШМ (Wilting S.M. et al. 2006: 220-230; Sawada M. et al. 2007: 211-217; Leonard S.M. et al. 2012: 1286-1293). Подальша модулююча дія Е7 на епігенетичне перепрограмування реалізується через індукцію лізин-деметилаз гістонів KDM6A та/або KDM6B. У результаті деметилювання гістонів активується експресія ряду генів, одним з яких є Р16 (або INK4a) (Laughlin-Drubin M.E. et al. 2011: 2130-2135). Гіперекспресія р16 є однією з основних ознак активності ВПЛ у клітині (Wentzensen N., Knebel D.M. 2007: 315-330) (Мал. 2).
Крім того, відомо, що Е6 та Е7 гени ВПЛ 16 типу прямо та опосередковано впливають на експресію різних типів мікроРНК. Так, Е6 пригнічує експресію miR-218, miR-23b, miR—34а (Martinez I. et al. 2008: 2575-2582; Wang X. et al. 2009: 637-647; Au Yeung C.L. et al. 2011: 2401-2410), а Е7 опосередковано стимулює експресію кластера miR-15а/16-1 та знижує експресію miR-203 (Melar-New M., Laimins L.A. 2010: 5212-5221).
Вторинні ефекти дерегуляції Е6 та Е7
Тривалий період часу, який потрібен для переходу з передракового стану у інвазивний рак, означає, що у реалізації трансформуючої дії Е6 та Е7 є додаткові генетичні події, що необхідні для злоякісної прогресії. Відомо, що одним з наслідків дерегуляції Е6 і Е7 є геномна нестабільність клітини (Moody C.A., Laimins L.A. 2010: 550-560; Korzeniewski N. et al. 2011: 113-122), яка сприяє подальшому накопиченню аберацій у генах клітини-хозяїна. Ці аберації можуть бути як генетичні, так і епігенетичні, деякі з яких призводять до інактивації генів онкосупресорів або активації онкогенів.
Аберації клітини-хозяїна при розвитку РШМ включають делеції, зміну числа копій, мутації ДНК, а також зміну рівня метилювання генів, що кодують білки та мікроРНК (Agarwal S.M. et al. 2011: D975-D979). Найбільш розповсюдженими хромосомними абераціями при РШМ є збільшення генетичного матеріалу у довгому (частота 0,55) та зменшення – у короткому плечі 3-ї хромосоми (частота 0,36), а також втрата генетичного матеріалу у області довгого плеча 11-ї хромосоми (частота 0,33) (Thomas L.K. et al. 2014: 85-98). Мутації як при плоскоклітинному раку, так і при аденокарциномі шийки матки найбільш часто зустрічаються у гені PIK3CA (Wright A.A. et al. 2013: 3776-3783; Ojesina A.I. et al. 2013: 371-375). Але хромосомні та генні аберації вивчені лише для раку шийки матки і невідома їх частота при передракових станах.
Найбільш важливим з клінічної точки зору при ураженнях шийки матки є зміна рівня метилювання ДНК. Аберантні моделі метилювання були описані для різного числа генів-супресорів при CIN та РШМ (Wentzensen N. et al. 2009: 293-299).
Найчастіше, як при плоскоклітинному раку, так і при аденокарциномах, гіперметилюються гени молекул клітинної адгезії (CADM1), кадгерина 1 (CDH1), апоптоз-асоційованої протеїнкінази 1 (DAPK1), EBP41L3, FAM19A4, мієліну і лімфоцитів (MAL), парного домену 1 (Рах1), домену, що містить PR-14 (PRDM14) і теломерази зворотньої транскриптази (TERT). Експресія частини з цих генів пов’язана з інгібуванням канцерогенезу епітелію шийки матки, а отже їх гіперметилювання призводить до втрати їх функції, у той час, як біологічна значимість більшості подій метилювання при ураженнях шийки матки поки залишається нез’ясованою.
Окрім зміни профілю експресії кодуючих генів, при трансформації поступово змінеюється і профіль експресії мікроРНК. Так, було продемонстровано зниження активності miR-126, miR-143 та miR-145, а також активацію miR-15b, miR-16, miR-146а і miR-155 (Zheng Z.M., Wang X. 2011: 668-677; Kaczkowski B. et al. 2012: 216-231; Saavedra K.P. et al. 2012: 13). У декількох дослідженнях було продемонстровано, що зміна експресії деяких мікроРНК є доволі ранньою подією при ВПЛ-асоційованому канцерогенезі (Wilting S.M. et al. 2013: 106-116; Li Y. et al. 2011: 484-495; Cheung T.H. 2012: 2876-2884; Pereira P.M. et al. 2010: e11780). Водночас, для більшості мікроРНК підвищення їх експресії є вторинною подією (Wilting S.M. et al. 2013: 106-116), яка частково є наслідком збільшення копій генетичного матеріалу на хромосомі 5р, що кодує ендонуклеазу Drosha, яка є відповідальною за формування мікроРНК. Пригнічення мікроРНК часто відбувається шляхом метилювання їх регуляторних ділянок. Так, інгібування mir-124-1, mir-124-2, mir-124-3, mir-149, mir-203, mir-375, mir-641 і mir-128 у клітинах раку шийки матки було пов’язано саме з гіперметилюванням відповідних генів (Wilting S.M. et al. 2010: 167; Wilting S.M. et al. 2013: 220-228; Yao T. et al. 2013: 175; Botezatu A. et al. 2011: 121-128).
Кореляція молекулярного профілю з тривалістю існування CIN
За сучасними уявленнями, CIN3 та частина CIN2 є трансформуючими ураженнями шийки матки. Морфологічно, CIN3 є найбільш важким передраковим станом, однак насправді це гетерогенне захворювання (Yang H.P. et al. 2012: e29051; Wentzensen N. et al. 2013: 148-154; Castle P.E. et al. 2012: 241-246). Ця гетерогенність пов’язана з різною тривалістю захворювання, оскільки у більшості пацієнтів дана неоплазія може існувати протягом 20–30 років, що є необхідним для її прогресії у інвазивний рак (Vink M.A. et al. 2013: 1161-1169).
Крім того, за даними багатьох досліджень, при відсутності лікування, тільки частина CIN3 буде прогресувати у інвазивний рак (McCredie M.R. et al. 2008: 425-434; Ostor A.G. 1993: 186-192). Таким чином, короткостроковий ризик прогресії трансформуючої CIN у інвазивну карциному сильно варіює.
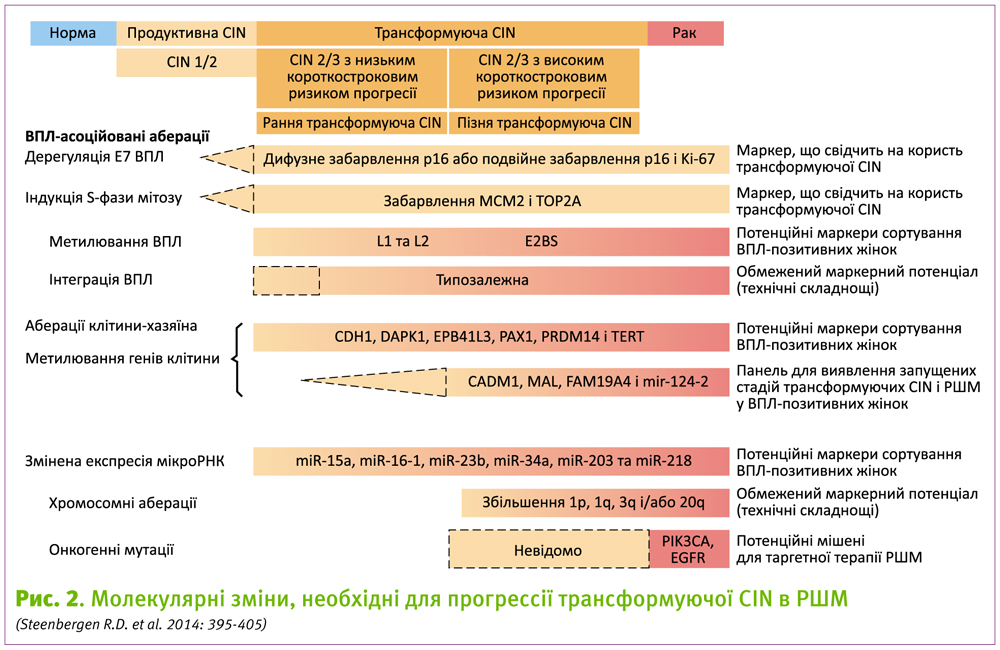
Рядом досліджень було виявлено різні генетичні та епігенетичні порушення, що зустрічалися при CIN3 з різною частотою (Thomas L.K. et al. 2014: 85-98; Wentzensen N. et al. 2009: 293-299; Szalmas A., Konya J. 2009: 144-152). Оскільки деякі з даних аберацій практично завжди присутні у інвазивних карциномах шийки матки, то очевидним є те, що дані молекулярні зміни характеризують найбільш важкі випадки трансформуюцих CIN, які існують протягом довгого періоду. Це підтверджується нещодавніми результатами, які демонструють, що більша тривалість ВПЛ-інфекції асоціюється з більшою кількістю хромосомних аберацій (Bierkens M. et al. 2011: E579-E585). У трансформуючих CIN з тривалим періодом попередньої ВПЛ-інфекції (>5 років) спостерігалась значно вища частота хромосомних аберацій (біля 16,5% ДНК-зондів на мікрочіпах CGH мали відхилення від норми), у порівнянні з жінками, у яких ВПЛ-інфекція була <5 років (частота відхилення 2,8%). Частота хромосомних аберацій при ураженнях CIN3 складає 28,8%, а при наявності довгострокової ВПЛ-інфекції у анамнезі, їх геномний профіль є дуже подібним на профіль інвазивних карцином. Також, було встановлено, що у ураженнях CIN3 з тривалою ВПЛ-інфекцією рівень метилювання генів CADM1, MAL і FAM19A4 був значно підвищений і досягав значень, які спостерігали при інвазивній карциномі (Bierkens M. et al. 2013: 1293-1299; De Strooper L.M. et al. 2014: 1251-1257). Ці дані підтверджують, що збільшення генетичних та епігенетичних змін відображає більшу тривалість захворювання.
Маркери для сортування ВПЛ-позитивних жінок
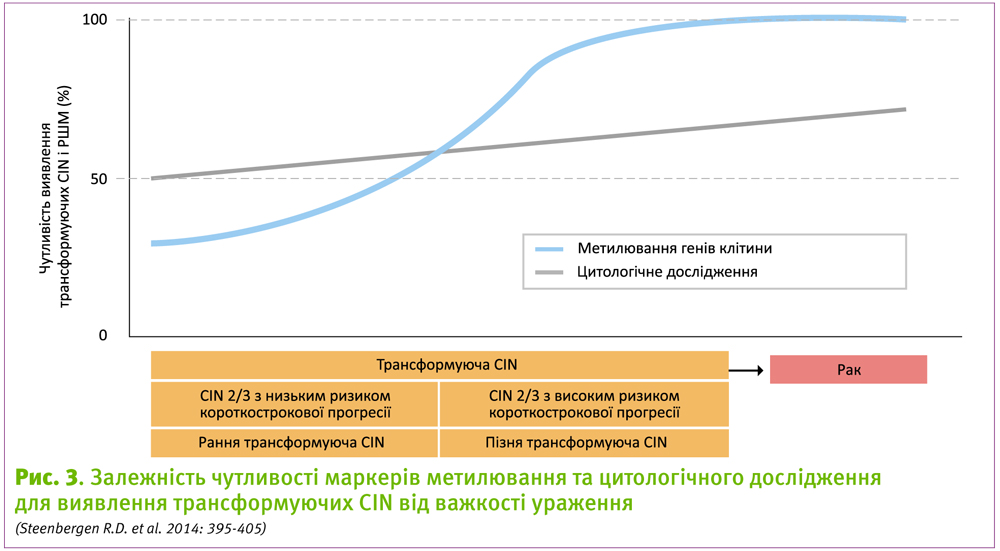
Завдяки високій чутливості виявлення CIN2, CIN3 і раку шийки матки (CIN2+), ВПЛ-тестування сьогодні стає основним методом цервікального скринінгу (Arbyn M. et al. 2012: F88-F99; Ronco G. et al. 2014: 524-532). Основним його недоліком є знижена на 2–4% у порівнянні з цитологічним методом чутливість у виявленні CIN2+ уражень, та виявлення транзиторних інфекцій, що призводить до гіпердіагностики та надмірного об’єму терапії.
Для компенсації цього недоліку були запропоновані різні алгоритми сортування пацієнтів, що дозволять обмежити терапевтичні заходи і пов’язані з ними фінансові витрати. Цитологічне дослідження з та без генотипування 16 та 18 типів ВПЛ на сьогодняшній день є загальноприйнятим інструментом сортування ВПЛ-позитивних жінок (Katki H.A. et al. 2013: S28-S35; Dijkstra M.G. et al. 2013: 55-63; Rijkaart D.C. et al. 2012: 975-981). Альтернативні алгоритми відбору ВПЛ-позитивних жінок для проведення кольпоскопії засновані на аналізі морфологічних та молекулярних маркерів.
Низкою досліджень було продемонстровано, що імуногістохімічне дослідженні р16 та Кі-67 на цитологічних зразках є непоганою стратегією сортування ВПЛ-позитивних пацієнток (Carozzi F. et al. 2013: 168-176; Petry K.U. et al. 2011: 505-509). До інших імуногістохімічних маркерів-кандидатів відносяться топоізомераза 2А та МСМ2, експресія яких корелює з важкістю заховорювання (Conesa-Zamora P. 2013: 1412-1424; Reuschenbach M., Knebel D.M. 2013: 1358-1370). Обмеженням даної стратегії є суб’єктивна оцінка результатів, яка як і при цитологічному дослідженні, залежить від якості зразка та кваліфікації цитолога. Тому на сьогодні переспективними є епігенетичні молекулярні маркери, оскільки метод виявлення порушення метилювання при РШМ є високочутливим, об’єктивним і може бути застосований як на гістологічних, так і на цитологічних зразках. Генетичні зміни, такі як мутації та зміна числа копій ДНК, є менш привабливими маркерами сортування. Мутації у протоонкогенах та генах-супресорах, зустрічаються лише у частині пухлин шийки матки (Wright A.A. et al. 2013: 3776-3783; Ojesina A.I. et al. 2013: 371-375), а зміна числа копій генетичного матеріалу хоча і виявляється частіше, але має обмежену чутливість через низький вміст клітин з абераціями у клінічних зразках.
На даний момент лише невелика кількість маркерів метилювання була протестована на предмет їх можливого застосування у якості сортування ВПЛ-позитивних жінок. Першою панеллю маркерів, що повністю пройшли клінічну валідацію, стала панель з трьох маркерів CADM1, MAL і mir124-2.
Валідація проводилась на зразках, отриманих самостійно у рамках проспективного рандомізованого клінічного дослідження з проведенням аналізу у жінок, що не були учасниками програми регулярного цервікального скринінгу (Verhoef V.M. et al. 2014: 315-322). У даному дослідженні порівнювали чутливість виявлення уражень CIN2+ за допомогою аналізу метилювання у ВПЛ-позитивних жінок на матеріалі, забраному самостійно (експериментальна група), та цитологічного дослідження додаткового матеріалу, отриманого лікарем.
За результатами дослідження, аналіз метилювання ДНК мав щонайменше таку ж чутливість, як і цитологічне дослідження.
Було продемонстровано, що підвищення рівня метилювання корелювало з важкістю та тривалістю CIN. Високі рівні метилювання були виявлені у всіх зразках з довготривалими важкими ураженнями, у той час як у зразках жінок з РШМ показники були найвищими (Bierkens M. et al. 2013: 1293-1299).
Продемонстровано, що 100% зразків з супутнім РШМ мали позитивний результат тримаркерної панелі CADM1-MAL-mir124-2 (Widschwendter A. et al. 2004: 3396-3400).
Такі результати призвели до появи першого комерційного тесту на основі визначення рівня метилювання для сортування ВПЛ-позитивних жінок – Precursor M test (PentaGen).
Іншою панеллю, яка продемонструвала аналогічні результати у виявленні РШМ та запущених трансформуючих інфекцій, став маркер FAM19A4 в поєднанні з тією ж мікроРНК miR124-2. Результати клінічного випробування даної панелі продемонстрували її 100% чутливість у виявлені плоскоклітинної та аденокарциноми шийки матки, 88,9% у виявленні CIN2 та 52.4 – CIN2 (De Strooper L.M. et al. 2016: 341-347). Результатом клінічної валідації цієї панелі став тест Qiasure від компанії Qiagen.
Таким чином, сьогодні у клінічній практиці доступні тести, які здатні виявляти всі інвазивні карциноми і довготривалі, важкі трансформуючі CIN з високим короткостроковим ризиком розвитку раку, відсіюючи ураження, що мають низький ризик прогресії (мал. 3).
Дана концепція передбачає, що ВПЛ-позитивні пацієнтки з позитивним тестом на метилювання повинні бути спрямовані на кольпоскопію через наявність раку, або пізніх стадій трансформуючого ураження з високим ризиком прогресії. Тоді як жінки з негативним результатом метилювання не потребують негайного виконання кольпоскопії через дуже низький ризик виникнення раку найближчим часом. Замість цього, жінкам даної групи може бути запропоновано повторне дослідження через 12–18 місяців. Особливо важливим такий підхід може бути для вагітних жінок, оскільки лікування уражень шийки матки буде показано тільки при позитивному результаті метилювання, тим самим знижуючи ризик дострокових пологів, що могли виникнути у результаті лікування (Bruinsma F.J. 2011: 1031-1041; Arbyn M. et al. 2008: 1284; Kyrgiou M. et al. 2006: 489-498). Таку тактику сортування ВПЛ-позитивних жінок пропонує виробник Precursor M Test.
Не так радикально програму скринінгу пропонує змінювати компанія Qiagen. Так, при первинному ВПЛ-скринінгу жінкам з позитивним ВПЛ-тестом пропонується подвійне тестування – цитологічне дослідження + метилювання, а при позитивному результаті первинного цитологічного скринінгу – ВПЛ-тест + метилювання. У обох випадках ми маємо 4 різні групи і 3 подальші тактики.
При позитивному результаті метилювання незалежно від результату іншого тесту рекомендується кольпоскопія. Така рекомендація базується на більшій чутливості маркерів метилювання до важких предракових станів та РШМ у порівнянні з ВПЛ- та ПАП-тестом. При негативному результаті обох тестів рекомендується спостереження, з повторним візитом через 12 місяців.
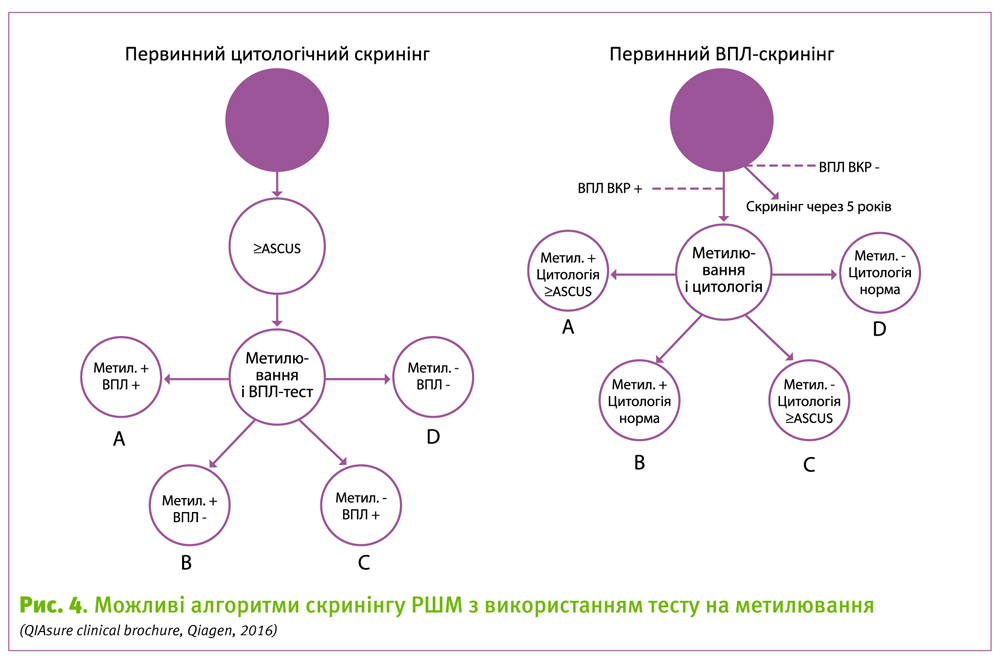
Окрему, доволі велику групу при сортуванні жінок з позитивним результатом першого скринінгового тесту, будуть становити жінки з негативним результатом метилювання при позитивному результаті ПАП-, або ВПЛ-тесту. Згідно діючих рекомендацій, такі жінки мають бути направленні на кольпоскопію з можливим виконанням біопсії.
Виробник тесту Qiasure не заперечує, але наголошує на низькому короткостроковому ризику розвитку раку і пропонує бути більш консервативними при прийнятті рішення: лікування vs спостереження (Мал. 4) (QIAsure clinical brochure, Qiagen, 2016).
Висновки
Різниця між продуктивними (СIN1-2) і трансформуючими (CIN2-3) ураженнями має важливі наслідки для клінічного спостереження жінок з цими змінами. Продуктивні та трансформуючі CIN2 не можуть бути розрізненні з морфологічної точки зору, що призводить до надмірного лікування вказаних патологій.
Визначення молекулярних маркерів, пов’язаних з переходом від вірусної інфекції до РШМ, може бути використано для молекулярної класифікації патології шийки матки у доповнення до існуючої морфологічної класифікації (CIN1-3). За допомогою молекулярних методів діагностики гістологічні зміни CIN1-2, які асоційовані з продукцією вірусу (продуктивні CIN) та мають низький ризик прогресії, можливо відрізнити від CIN2-3, що являють собою вірусну трансформацію (трансформуюча CIN). У свою чергу, трансформуючу CIN можливо розділити за епігенетичними змінами на ранню та пізню. Жінки з ранніми трансформуючими CIN, які характеризуються нормальним профілем метилювання маркерних генів, мають низький короткостроковий ризик розвитку раку і за ними слід встановити більш ретельне спостереження. Жінки з пізніми стадіями трансформуючих CIN, які проявляються гіперметилюванням маркерних генів, мають високий ризик короткострокової прогресії у рак і потребують негайного лікування. Відповідно, виявлення гіперметилювання ДНК може стати показом для лікування CIN2/CIN3 уражень і у перспективі замінити існуючі алгоритми сортування, засновані на цитологічному дослідженні і генотипуванні 16/18 типів ВПЛ, а сумісність дослідження метилювання з ВПЛ-тестуванням може дозволити виконувати повний молекулярно-генетичний скринінг цервікальних пошкоджень.
Перелік літератури знаходиться у редакції.


коментарів