Huyen A Tran, Harry Gibbs, Eileen Merriman, Jennifer L Curnow, Laura Young, Ashwini Bennett, Tan Chee Wee, Sanjeev D Chunilal, Chris M Ward, Ross Baker, Harshal Nandurkar
doi: 10.5694/mja2.50004
Опубліковано в мережі інтернет 11.02.2019
Вступ
Венозна тромбоемболія (ВТЕ), включаючи тромбоз глибоких вен (ТГВ) та легеневу емболію (ЛЕ), є третім найпоширенішим серцево-судинним захворюванням, на яке в глобальному масштабі хворіють більше 10 мільйонів людей щорічно. Це захворювання є хронічним і рецидивуючим. Симптоми ВТЕ неспецифічні, при виникненні підозри на це захворювання слід активно шукати підтвердження діагнозу. Основою лікування ВТЕ є терапія антикоагулянтами, додаткових втручань потребує невелике число пацієнтів.
Нещодавно робоча група експертів у цій галузі видала засновану на доказових даних настанову з діагностики та лікування ТГВ та ЛЕ від імені Товариства з вивчення тромбозу та гемостазу Австралії та Нової Зеландії (www.thanz.org.au/resources/thanz-guidelines).
Основні рекомендації
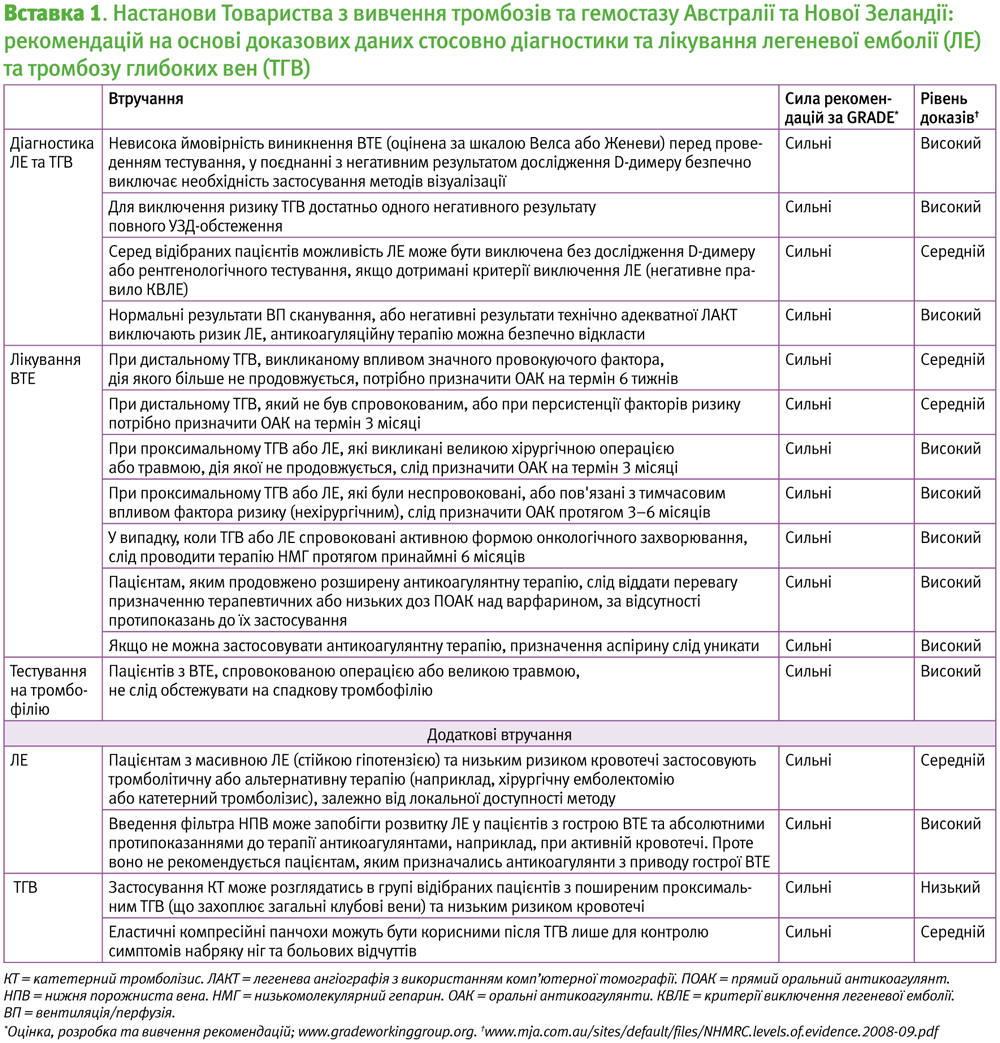
- Діагноз ВТЕ слід встановлювати з використанням методів медичної візуалізації; він може бути виключений з використанням правил клінічного прогнозування у поєднанні з тестуванням на рівень D-димеру.
- Проксимальний ТГВ або ЛЕ, викликані великою хірургічною операцією або травмою, дія якої не продовжується, слід лікувати із застосуванням антикоагулянтної терапії протягом 3 місяців.
- Проксимальний ТГВ або ЛЕ, які були неспровоковані, або пов’язані з тимчасовим впливом фактора ризику (нехірургічним), слід лікувати із застосуванням антикоагулянтної терапії протягом 3–6 місяців.
- Для лікування проксимального ТГВ або ЛЕ, що рецидивує (два або більше разів) і провокується наявністю активної форми онкологічного захворювання або антифосфоліпідного синдрому, потрібно застосовувати розширену антикоагулянтну терапію.
- Дистальний ТГВ, викликаний значним провокуючим фактором, дія якого більше не продовжується, слід лікувати із застосуванням антикоагулянтної терапії протягом 6 тижнів.
- Пацієнтам, яким продовжують застосування розширеної антикоагулянтної терапії, можуть бути призначені терапевтичні або низькі дози прямих пероральних антикоагулянтів, за відсутності протипоказань їм слід віддати перевагу над варфарином.
- Рутинне тестування на тромбофілію не показане.
- У випадку масивної (гемодинамічно нестабільної) ЛЕ показані тромболіз або відповідна альтернативна терапія.
Зміни принципів ведення в результаті застосування настанови
Більшість пацієнтів з гострою ВТЕ повинні лікуватись із застосуванням інгібітора фактора Xa та оцінюватись для можливості застосування розширеної терапії антикоагулянтами.
Венозна тромбоемболія (ВТЕ), включаючи тромбоз глибоких вен (ТГВ) та легеневу емболію (ЛЕ), є третім найпоширенішим захворюванням серцево-судинної системи. Щорічна захворюваність становить понад 10 мільйонів людей у всьому світі [1]. У Австралії ВТЕ протягом року розвивається щонайменше в 17000 осіб (рівень щорічної захворюваності — 0,83 на 1000 населення) [2]. Ризик розвитку ВТЕ протягом життя становить 8%, причому 1% людей переживають свій перший епізод ВТЕ у віці старше 80 років. Це захворювання є одною з основних причин економічних втрат для пацієнта та громади, пов’язаних з охороною здоров’я (в Австралії за 2008 р. оцінюється у 1,7 мільярда доларів) [3]. ВТЕ є хронічним захворюванням і часто рецидивує.
За відсутності лікування ВТЕ може призвести до смерті; тривала захворюваність включає посттромботичний синдром (ПТС) та легеневу гіпертензію. Симптоми ВТЕ неспецифічні, при виникненні підозри слід активно шукати підтвердження діагнозу. Діагноз ВТЕ впливає на наступні вагітності, призначення естрогенів, хірургічні втручання, страхування життя та, іноді, довготривалі подорожі.
Ця скорочена настанова окреслює рекомендації щодо діагностики та лікування ВТЕ від імені Товариства з вивчення тромбозу та гемостазу Австралії та Нової Зеландії (THANZ) (Вставка 1).
Методи
Група з написання Настанови щодо ВТЕ була створена у рамках THANZ, до неї увійшли експерти у галузі лікування тромбоемболічних розладів з Австралії та Нової Зеландії. Всі члени групи взяли участь у написанні детального огляду літератури та критично оцінили наявні докази стосовно діагностики та лікування ВТЕ. Були розроблені проекти рекомендацій на основі доказових даних, вирішені практичні питання та створено попередній рукопис настанови. Потім, з метою розробки проекту настанови, ми провели дводенну зустріч віч-на-віч 25–26 лютого 2018 року. Подальші зміни вносились за допомогою електронного листування або особистих зустрічей.
Узагальнені рекомендації відповідають рівню доказів Національної ради охорони здоров’я та медичних досліджень (mja.com.au/sites/default/files/NHMRC.levels.of.evidence.2008-09.pdf) та Системи оцінки, розробки та вивчення рекомендацій (GRADE) (gradeworkinggroup.org) для визначення сили рекомендацій.
Фактори ризику виникнення венозної тромбоемболії
Існують успадковані та набуті фактори ризику виникнення ВТЕ. У індивіда часто співіснують декілька факторів ризику, кожен з яких вносить свою частку до загального показника ризику ВТЕ.
Хоча спадкова тромбофілія пов’язана з підвищеним ризиком ВТЕ, клінічна ефективність тестування на наявність цього стану є малою, оскільки при прийнятті рішень щодо терапії антикоагулянтами його значення є низьким [4].
Важливо визначити, спровоковано чи не спровоковано подію ВТЕ. Провокуючі фактори можуть бути класифіковані як хірургічні (недавнє велике хірургічне втручання) або нехірургічні, та як транзиторні чи персистуючі (Вставка 2). Така клінічна категоризація є важливою, оскільки визначення провокуючих факторів впливає на оцінку ризику рецидиву ВТЕ та тривалість лікування антикоагулянтами [5] (Вставка 3).
Ризик для події ВТЕ, що виникала протягом 2 місяців після впливу транзиторного провокуючого фактора, становить половину ризику рецидиву ВТЕ після припинення антикоагулянтної терапії, порівняно з пацієнтами без впливу транзиторних факторів ризику [6].
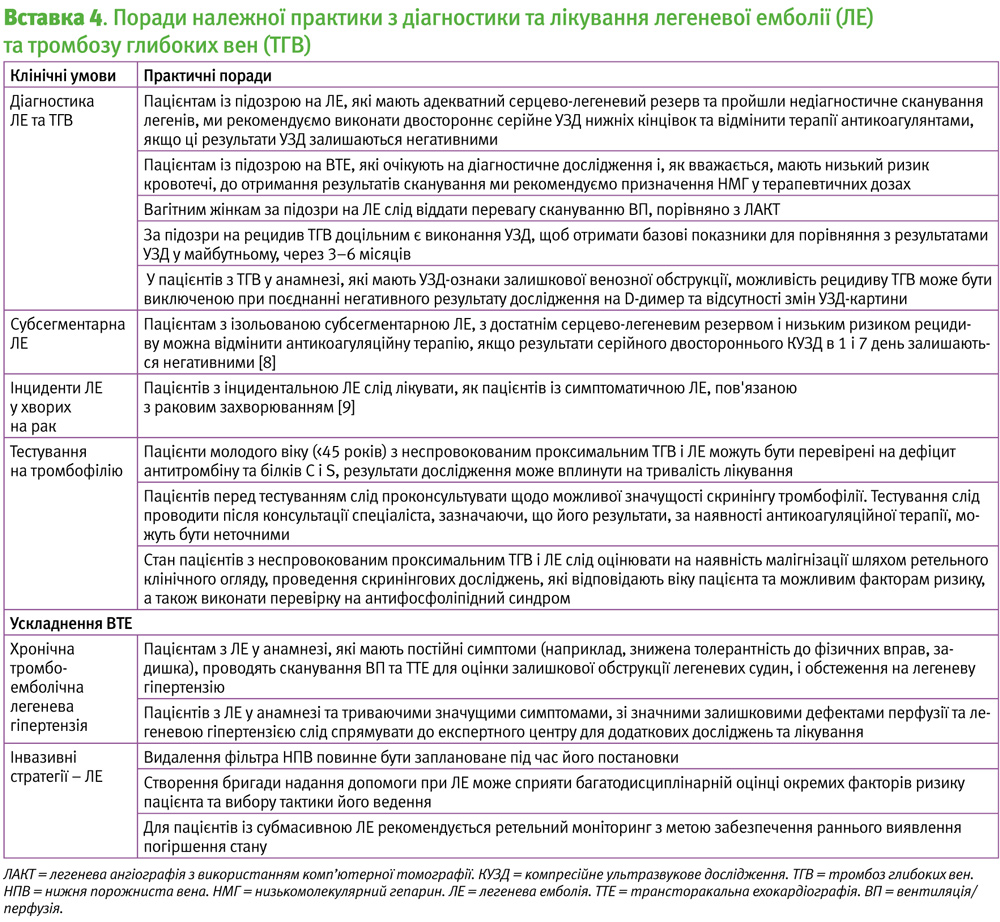
У випадках неспровокованих епізодів ВТЕ важливо враховувати приховану можливість малігнізації, оскільки у 10% таких пацієнтів через рік після діагнозу ВТЕ діагностують рак [7]. Клінічна оцінка стану повинна включати ретельний клінічний огляд та обстеження на наявність злоякісних новоутворень, відповідно до віку пацієнта (Вставка 4). Слід пам’ятати, що комп’ютерна томографія органів черевної порожнини і малого тазу не виявляє більшість ракових захворювань на ранній стадії, та не покращує результат [7].


Діагностика та лікування легеневої емболії і тромбозу глибоких вен
Клінічні прояви ВТЕ неспецифічні, і лише приблизно у 20% пацієнтів з клінічно підозрюваним ВТЕ діагноз підтверджується об’єктивними даними [10]. Неправильна діагностика ВТЕ має значні наслідки, у тому числі невиправдане припинення ефективної гормональної контрацепції у жінок і непотрібні ін’єкції низькомолекулярного гепарину у антенатальному та післяпологовому періодах. У пацієнтів літнього віку прийом антикоагулянтів асоціюється з підвищеними показниками масивних і фатальних кровотеч [11].
І навпаки, невстановлення діагнозу ВТЕ може призвести до летальної ЛЕ. Тому для встановлення діагнозу ВТЕ необхідне виконувати об’єктивне тестування.
Необхідність застосування методів візуалізації можна визначити за допомогою правил клінічного прогнозування у поєднанні з визначенням рівня D-димеру, уникаючи зайвих рентгенологічних досліджень, які піддають пацієнтів впливу радіації та потенційно нефротоксичних контрастних барвників, є дорогими і незручними у проведенні.
Правила клінічного прогнозування
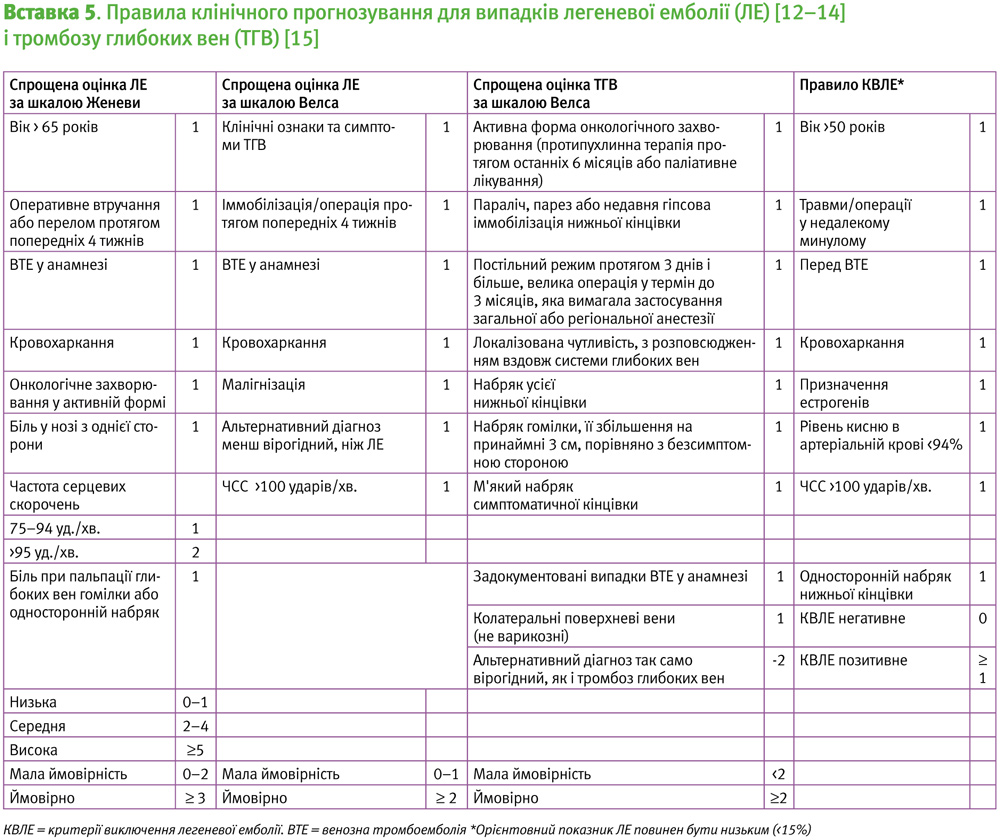
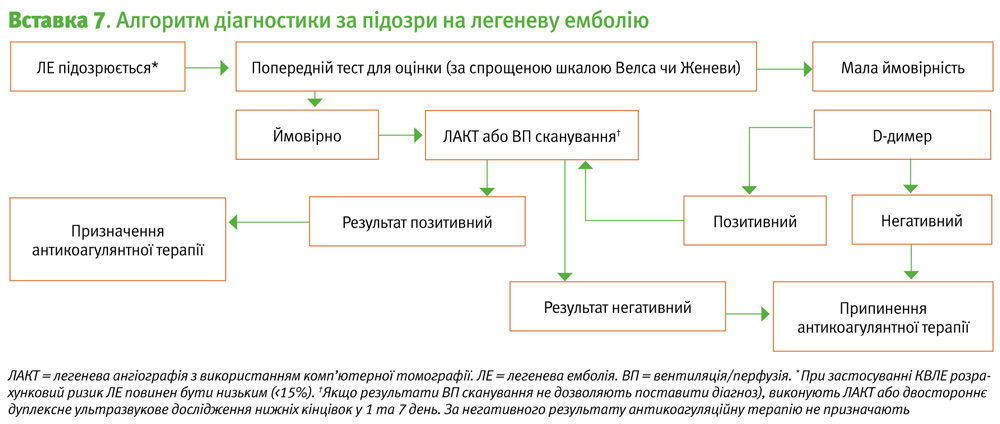
Найбільш валідованими правилами прогнозування ВТЕ є шкали Велса та Женеви [12] (Вставка 5). Однак саме по собі їхнє застосування не може безпечно виключити ВТЕ, вони повинні використовуватись у поєднанні з тестуванням на D-димер [13, 15]. Сила рекомендацій за GRADE: Сильні; Рівень доказів: високий. Ці алгоритми розроблені для використання в амбулаторних умовах або у відділенні невідкладної допомоги, і не застосовуються для госпіталізованих пацієнтів.
Критерії виключення легеневої емболії (КВЛЕ) — система оцінки для виключення ЛE [14]. Вони застосовується лише для пацієнтів молодше 50 років і у випадку низьких значень оцінюваного показника ЛЕ (<15%) [16]. Цей показник визначається у більшості австралійських та новозеландських відділень невідкладної допомоги, а отже, може застосовуватись для визначення КВЛЕ. При застосуванні цієї системи деякі пацієнти можуть уникнути додаткових досліджень. Пацієнтів з позитивним значенням КВЛЕ слід додатково оцінювати на ризик виникнення ЛЕ.
Визначення D-димеру
Рівень D-димеру підвищується під час ВТЕ, але також і при багатьох інших станах, включаючи злоякісні новоутворення, запалення, інфекцію, травми та вагітність [17].
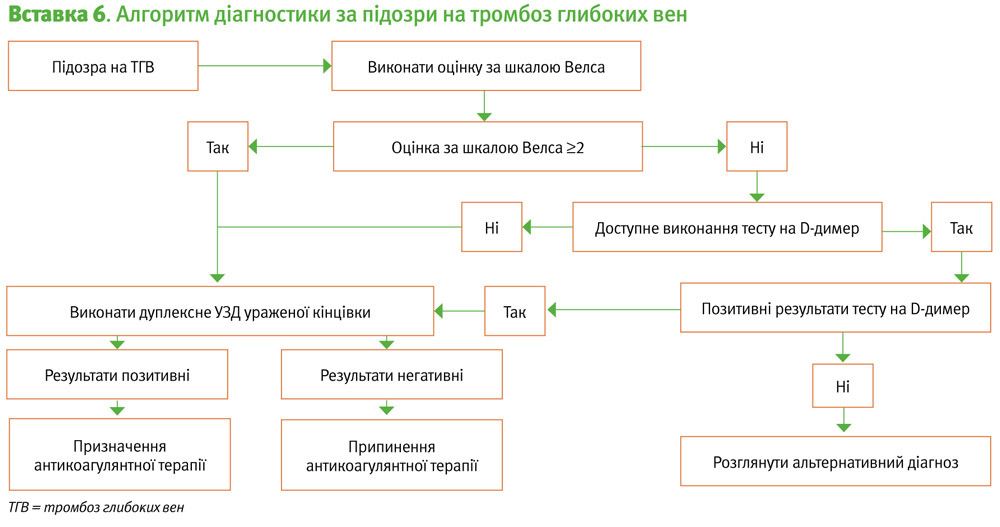
Негативний результат дослідження D-димеру є ефективним аргументом для виключення ризику ВТЕ, коли він поєднується з її малоймовірністю (невисокою клінічною ймовірністю), що дозволяє уникнути застосування методів візуалізації в багатьох випадках (Вставка 6 та 7) [12]. Позитивний результат дослідження D-димеру сам по собі не є діагнозом ВТЕ, і вимагає подальшого рентгенологічного дослідження.
Методи візуалізації
Дуплексне УЗД нижніх кінцівок
Дуплексне УЗД є точним методом для встановлення та виключення діагнозу ТГВ. В Австралії та Новій Зеландії всю систему глибоких вен, від щиколотки до пахової області оцінюють з використанням дуплексного УЗД. Загалом, негативні результати УЗД однієї кінцівки повністю виключають можливість ТГВ, і терапію антикоагулянтами можна припинити (Вставка 6) [18].
Діагностика рецидивуючого іпсилатерального ТГВ є складним завданням, оскільки у 30–50% пацієнтів після ТГВ спостерігається неповне руйнування тромба [19]. З цієї причини, якщо антикоагулянтна терапія повинна бути припинена, багато лікарів пропонують виконати повторне дуплексне УЗД через 3–6 місяців (Вставка 4). Сила рекомендацій за GRADE: cильні; Рівень доказів: низький. Ці зображення можуть порівнюватись із майбутніми результатами досліджень у разі появи нових симптомів, що викликають підозру на ТГВ. Багаторазові повторні сканування за відсутності симптомів не є ефективними, і не чинять впливу на тактику ведення. Сила рекомендацій за GRADE: cильні; Рівень доказів: низький.
Легенева ангіографія з використанням комп’ютерної томографії
Легенева ангіографія з використанням комп’ютерної томографії (ЛАКТ) внаслідок точності методу є кращим засобом отримання зображень за підозри на ЛЕ [8]. Сила рекомендацій за GRADE: Сильні; Рівень доказів: високий. Однак, використання ЛАКТ передбачає значний вплив іонізуючого випромінювання (3–5 мЗв) і вимагає застосування йодованого контрасту, який може викликати нефротоксичність (до 14%) та алергічні реакції (<1%) [9].
Вентиляційно-перфузійне сканування
Вентиляційно-перфузійне сканування (ВП) не потребує радіоконтрасту, і тому підходить пацієнтам з порушенням функції нирок. Нормальні результати ВП сканування ефективно виключають наявність ЛЕ, з високою ймовірністю підтверджуючи діагноз [20]. Однак у 27–55% пацієнтів результати сканування легенів є недіагностичними; ці пацієнти для виключення ЛЕ потребують тестування за допомогою серійного УЗД нижніх кінцівок або ЛАКТ (Вставка 7) [21]. У вагітних жінок, враховуючи неможливість застосування контрасту в поєднанні з результатами досліджень, які показують високу пропорцію діагностичних ВП сканувань, саме цей метод є діагностики є кращим [22]. Сила рекомендацій за GRADE: cильні; Рівень доказів: низький.
Лікування венозної тромбоемболії
Спектр ВТЕ варіюється від дистального ТГВ, при якому може бути непотрібним призначення терапії антикоагулянтами, через проксимальний ТГВ, і до потенційно небезпечної для життя ЛЕ, яка вимагає застосування додаткових інвазивних стратегій. Лікування ТГВ залежить від його анатомічного поширення: при проксимальному ТГВ тромб присутній у підколінній вені (та її трифуркації), або у більш проксимальній вені; при дистальному ТГВ тромб виникає лише у велико- та малогомілковій, литковій венах та вені камбалоподібного м’яза [23].
Антикоагуляційна терапія показана в більшості випадків ВТЕ, оскільки вона є високоефективною для запобігання розповсюдженню або рецидиву тромба щонайменше у 80% [5].
Антикоагулянтна терапія при тромбозі глибоких вен та легеневій емболії
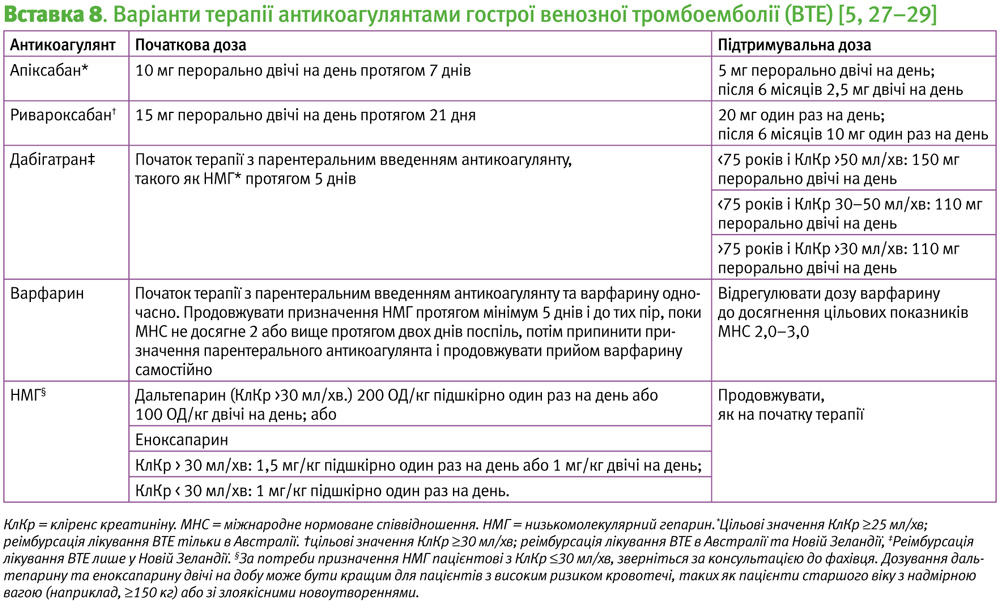
Прямі оральні антикоагулянти (ПОАК) та варфарин є однаково ефективними і можуть бути призначені більшості пацієнтів. Сила рекомендацій за GRADE: сильні; рівень доказів: високий [5, 24]. Застосування ПОАК не потребує рутинного моніторингу, у них відсутні відомі харчові взаємодії та відмічені незначні взаємодії з лікарськими засобами, тому їх застосуванню віддають перевагу в більшості випадків. Однак, ПОАК не слід застосовувати під час вагітності або грудного вигодовування, в цьому випадку показаний низькомолекулярний гепарин [5]. Едоксабан та ривароксабан виявилися настільки ж ефективними, як і дальтепарин при тромбозі, спричиненому онкологічними захворюваннями, але їх застосування пов’язане з підвищеним ризиком масивних кровотеч або клінічно важливих немасивних кровотеч (КВНМК), тому може бути розглянутим за потреби [25, 26]. При лікуванні проксимальних ТГВ та ЛЕ віддають перевагу застосуванню пероральних інгібіторів фактора Xa (наприклад, апіксабану, ривароксабану) над дабігатраном або варфарином, оскільки вони не потребують парентерального введення антикоагулянтів для ініціації терапії (Вставка 8). Сила рекомендацій за GRADE: cильні; рівень доказів: високий.
Тривалість антикоагулянтної терапії
Проксимальний тромбоз глибоких вен та легенева емболія
Усі пацієнти з проксимальним ТГВ та ЛЕ повинні отримувати антикоагулянтну терапію протягом не менше 3 місяців. Сила рекомендацій за GRADE: cильні; рівень доказів: високий. Пацієнти, у яких проксимальний ТГВ або ЛЕ були спровоковані великою хірургічною операцією або травмою, після цього часу можуть припинити лікування антикоагулянтами [5].
Дистальний тромбоз глибоких вен
Існує невизначеність у клінічному значенні антикоагуляційної терапії при дистальному ТГВ. Як правило, таке лікування застосовується для проксимальних ТГВ та ЛЕ, проте раціональним є виконання серійного дуплексного ультразвукового дослідження (два дуплексні ультразвукові дослідження протягом 2 тижнів) (Сила рекомендацій за GRADE: cильні; Рівень доказів: середній), особливо при підвищеному ризику кровотечі. Більшість випадків дистального ТГВ можливо лікувати протягом 6–12 тижнів. Сила рекомендацій за GRADE: cильні; Рівень доказів: середній [30].
Розширена антикоагуляційна терапія при тромбозі глибоких вен та легеневій емболії (понад 3–6 міс.)
Для пацієнтів, у яких тромботичні події були неспровокованими, або пов’язаними з транзиторними факторами ризику (нехірургічними), потрібно прийняти рішення про припинення або продовження антикоагулянтної терапії після 3 місяців її застосування. Продовження терапії понад 3 місяці знижує ризик рецидиву ВТЕ під час цього терміну щонайменше на 80%, але пов’язане з ризиком масивної кровотечі <1% на рік. Після припинення антикоагулянтної терапії, протягом періоду спостереження ризик виникнення рецидивів такий самий, як і для пацієнтів, які припиняють лікування через 3–6 місяців [27].
Рішення про припинення або продовження терапії антикоагулянтами після 3 місяців є складним і залежить від балансу між ризиками розвитку кровотечі та рецидиву ВТЕ (див. нижче). Клінічно досягнення балансу є загальним, важливими також є уподобання пацієнта. У Вставці 9 рекомендується тривалість антикоагуляційної терапії для різних типів ВТЕ на основі частоти рецидивів (Вставка 8) та факторів ризику рецидивів (Вставка 10), враховуючи уподобання пацієнта.
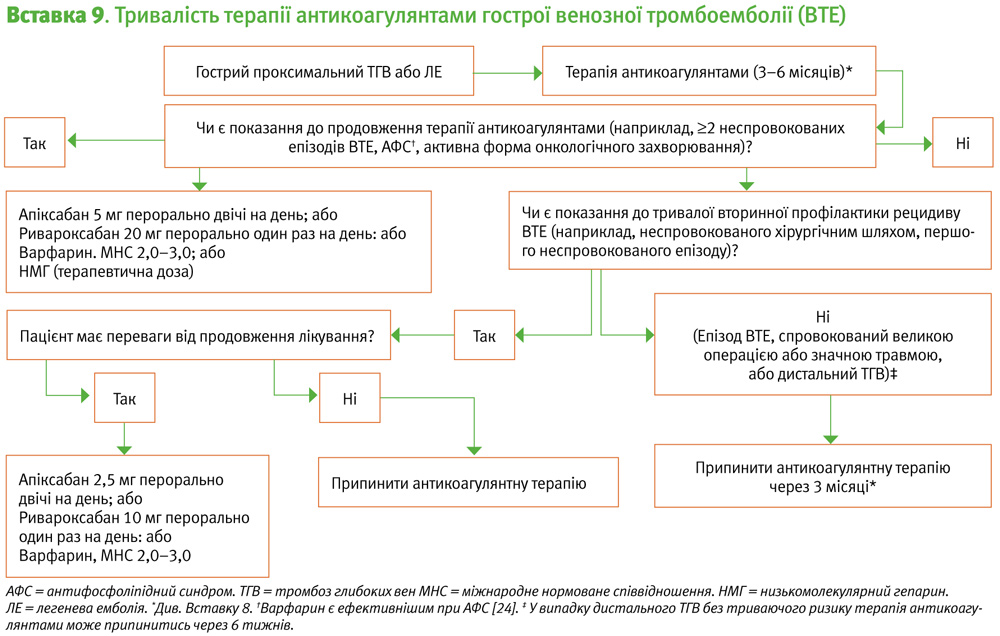
Для пацієнтів, яким було вирішено продовжити антикоагулянтну терапію, використовують антикоагулянти низької інтенсивності (Сила рекомендацій за GRADE: cильні; Рівень доказів: високий). Ризик масивних кровотеч та КВНМК при терапевтичному застосуванні антикоагулянтів (ПОАК або варфарин) коливається від 2% до 3% на рік [34], але є меншим у пацієнтів, які закінчили прийом пероральних антикоагулянтів протягом 6 місяців без розвитку кровотечі [5].
Для профілактики рецидиву ВТЕ протягом 6 місяців апіксабан 2,5 мг двічі на день є настільки ж ефективним, як 5,0 мг двічі на день, без різниці в ризику виникнення масивних кровотеч і тенденції до зниження ризику КВНМК [28]. Аналогічно, ривароксабан 10 мг один раз на день є настільки ж ефективним, як 20 мг один раз на день, із тенденцією до зниження ризику виникнення масивних кровотеч та КВНМК [29].
Призначення аспірину (100 мг на добу) зменшує ризик рецидиву ВТЕ значно меншою мірою, ніж пероральні антикоагулянти, але має ризики виникнення кровотечі, схожі на ризики при прийомі ривароксабану 10 мг на день [29, 35]. Тому у випадках, коли не можна застосовувати антикоагулянти, слід уникати призначення аспірину. Сила рекомендацій за GRADE: cильні; рівень доказів: високий.
Прогнози рецидиву венозної тромбоемболії
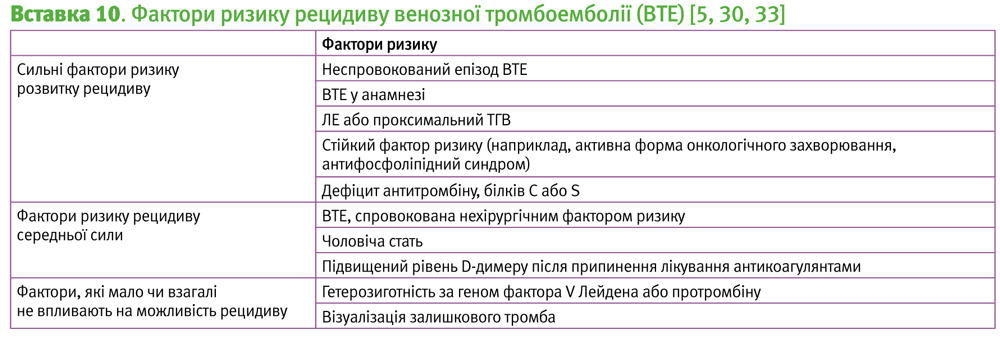
Ідентифіковано багато факторів ризику рецидиву ВТЕ, хоча лише деякі з них чинять сильний ефект (Вставка 10). Більшість клінічних рішень можна прийняти, оцінивши наступні прогнози розвитку рецидивів: не спровокований рецидив, нехірургічний провокуючий фактор та персистуючі фактори ризику проти спровокованих хірургічним втручанням; ЛE та проксимальний ТГВ проти дистального ТГВ;36 ВТЕ у анамнезі [5]; чоловіча стать [31].
Ризик кровотечі
Найсильнішим предиктором виникнення кровотечі є активна або недавня (<30 днів) кровотеча, при якій антикоагулянтна терапія зазвичай протипоказана [37]. Інші предиктори кровотечі включають кровотечу в анамнезі (особливо під час прийому антикоагулянтів), захворювання з потенційною можливістю кровотечі (наприклад, виразкова хвороба), недавню операцію (протягом 14 днів), тяжкі захворювання нирок та активну форму онкологічного захворювання. Прийняття рішення про те, чи ризик кровотечі перевищує переваги від антикоагуляційної терапії, може бути тяжким і часто суб’єктивним. Важливим є той факт, що серед пацієнтів, які не мають кровотечі і яким недавно було призначено терапію антикоагулянтами, ризик виникнення масивних кровотеч у майбутньому є дуже низьким (0,8–1,6% на рік), особливо під час прийому ПОАК з низьким рівнем інтенсивності, і подібним до ризику пацієнтів, які не приймають антикоагулянтів [5, 28].
Тестування на тромбофілію
Наявність вродженої тромбофілії не впливає на тактику початкового лікування антикоагулянтами. Тільки рідкісні дефіцити природних інгібіторів (антитромбіну, білка С або S) значно підвищують ризик повторної ВТЕ і вимагають розширеної антикоагулянтної терапії. Така невизначеність залишається й при гомозиготних, або інших поєднаних гетерозиготних станах [32, 38]. Наявність мутації гена фактора V Лейден чи гетерозиготні мутації гена протромбіну не змінюють тривалість лікування або характер порад для членів сім’ї, тому їх рутинний пошук не має сенсу (Вставка 4) [33].
Пацієнтів з незапровокованим епізодом ВТЕ доцільно перевірити на антифосфоліпідний синдром. Сила рекомендацій за GRADE: cильні; рівень доказів: середній.
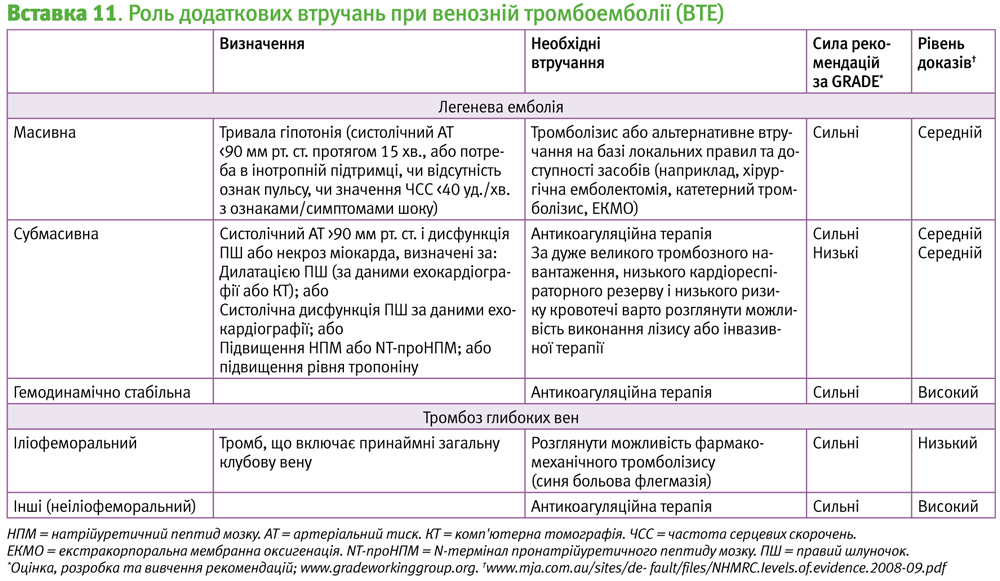
Ускладнення венозної тромбоемболії
Хронічна тромбоемболічна легенева гіпертензія (ХТЛГ) є прекапілярною формою легеневої гіпертензії, яка виникає після обструкції легенів тромбом та організованою фіброзною тканиною, і супроводжується легеневою артеріопатією. Захворюваність на ХТЛГ після гострої ЛЕ становить 3,4% [39]. Зазвичай пацієнти повідомляють про збереження задишки, незважаючи на антикоагуляційну терапію протягом наступних 2 років. За підозри на ХТЛГ слід проводити ВП сканування та ехокардіографію (Вставка 4). За відсутності лікування ХТЛГ має поганий прогноз, із 5-річною виживаністю 30%. Лікування варіюється від медикаментозної терапії, спрямованої на вазодилатацію судинної системи легенів, до легеневої ендартеректомії [40]. Сила рекомендацій за GRADE: cлабкі; рівень доказів: середній.
Перебіг ПТС характеризується клінічними особливостями (наприклад, набряком, дискомфортом, гіперпігментацією та ліподерматосклерозом) кінцівки, де спостерігався ТГВ [41]. Посттромботичний синдром після ТГВ зустрічається у кожного третього пацієнта [42]. Для діагностики ПТС рентгенологічних результатів недостатньо; найбільш часто використовуваною клінічною шкалою є шкала Вілланта [4.
Антикоагуляційна терапія не перешкоджає розвитку ПТС [44]. Тромболізис знімає обструкцію венозного відтоку і застосовувався для запобігання ПТС при поширеному ТГВ, хоча результати клінічних досліджень його застосування були неоднозначними [45, 46]. Клінічні дослідження, в яких оцінювали використання еластичного компресійного трикотажу серед пацієнтів з проксимальними ТГВ повідомили про суперечливі результати щодо зниження захворюваності на ПТС [47]. Отже, еластичні компресійні панчохи можуть бути корисними лише для контролю симптомів набряку ніг і больового синдрому. Сила рекомендацій за GRADE: cильні; рівень доказів: середній.
Агресивні стратегії менеджменту венозної тромбоемболії
Досліджено інвазивні способи оперативного видалення тромбу з метою швидкого зняття гострого перевантаження тиску в правому шлуночку при ЛЕ, і, тим самим, покращення виживаності або швидке поліпшення венозної прохідності для запобігання дисфункції вен та розвитку ПТС і зменшення ризику рецидиву ВТЕ.
З різними результатами були досліджені наступні стратегії: системне введення тромболітичних агентів; катетерний тромболізис, при якому використовуються менші дози тромболітиків з або без механічним руйнуванням згустка; хірургічна тромбектомія [46, 48–50].
Ці терапії відіграють обмежену роль у лікуванні гострої ВТЕ (Вставка 11).
Введення фільтра в нижню порожнисту вену може запобігти розвитку ЛЕ у пацієнтів з гострою ВТЕ та абсолютними протипоказаннями до терапії антикоагулянтами, наприклад при активній кровотечі. Проте воно не рекомендується пацієнтам, яким з приводу гострої ВТЕ призначались антикоагулянти [5]. Сила рекомендацій за GRADE: cильні; рівень доказів: високий.
Висновки
Настанова THANZ з діагностики та менеджменту ВТЕ була розроблена Робочою групою з вивчення ВТЕ на основі сучасних доказів та використання підходу, заснованого на доказових даних. Настанова спрямована на сприяння оптимальному менеджменту ВТЕ. Розширену версію настанови можна знайти на веб-сайті THANZ (www.thanz.org.au/resources/thanz-guidelines).
1 Raskob GE, Angchaisuksiri P, Blanco AN, et al. Thrombosis: a major contributor to global disease burden. SeminThromb Hemost 2014; 40: 724–735.
2 Ho WK, Hankey GJ, Eikelboom JW. The incidence of venous thromboembolism: a prospective, community- based study in Perth, Western Australia. Med J Aust 2008; 189: 144–147. https://www.mja.com.au/journal/2008/189/3/incidence-venous-thromboembolism-prospective-community-based-study-perth-western
3 Fletcher J, Baker R, Fisher C, et al. The burden of venous thromboembolism in Australia. Access Economics, 2008. https://www.safetyandquality.gov.au/wp-content/uploads/2018/10/Access-Economics_The-burden-of-VTE-in-Australia_2008.pdf (viewed Jan 2019).
4 Connors JM. Thrombophilia Testing and Venous Thrombosis. N Engl J Med 2017; 377: 1177–1187.
5 Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline. Chest 2016; 149: 315–352.
6 Kearon C, Ageno W, Cannegieter SC, et al. Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH. J Thromb Haemost 2016; 14: 1480–1483.
7 van Es N, Le Gal G, Otten HM, et al. Screening for occult cancer in patients with unprovoked venous thromboembolism: a systematic review and meta- analysis of individual patient data. Ann Intern Med 2017; 167: 410–417.
8 Mos IC, Klok FA, Kroft LJ, et al. Safety of ruling out acute pulmonary embolism by normal computed tomography pulmonary angiography in patients with an indication for computed tomography: systematic review and meta- analysis. J Thromb Haemost 2009; 7: 1491–1498.
9 Mitchell AM, Jones AE, Tumlin JA, Kline JA. Prospective study of the incidence of contrast-induced nephropathy among patients evaluated for pulmonary embolism by contrast- enhanced computed tomography. Acad Emerg Med 2012; 19: 618–625.
10 Di Nisio M, van Es N, Buller HR. Deep vein thrombosis and pulmonary embolism. Lancet 2016; 388: 3060–3073.
11 Linkins LA, Choi PT, Douketis JD. Clinical impact of bleeding in patients taking oral anticoagulant therapy for venous thromboembolism: a meta- analysis. Ann Intern Med 2003; 139: 893–900. 12 Righini M, Robert-Ebadi H, Le Gal G. Diagnosis of acute pulmonary embolism. J Thromb Haemost 2017; 15: 1251–1261.
13 Wells P, Anderson D, Rodger M, et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D- dimer. Thromb Haemost 2000; 83: 416–420.
14 Kline JA, Mitchell AM, Kabrhel C, et al. Clinical criteria to prevent unnecessary diagnostic testing in emergency department patients with suspected pulmonary embolism. J Thromb Haemost 2004; 2: 1247–1255.
15 Wells PS, Owen C, Doucette S, Fergusson D, Tran H. Does this patient have deep vein thrombosis? JAMA 2006; 295: 199–207.
16 Freund Y, Cachanado M, Aubry A, et al. Effect of the Pulmonary Embolism Rule- Out Criteria on Subsequent Thromboembolic Events Among Low- Risk Emergency Department Patients: the PROPER randomized clinical trial. JAMA 2018; 319: 559–566.
17 Righini M, Perrier A, De Moerloose P, Bounameaux H. D- Dimer for venous thromboembolism diagnosis: 20 years later. J Thromb Haemost 2008; 6: 1059–1071.
18 Bernardi E, Camporese G, Buller HR, et al. Serial 2-point ultrasonography plus D- dimer vs whole- leg color- coded Doppler ultrasonography for diagnosing suspected symptomatic deep vein thrombosis: a randomized controlled trial. JAMA 2008; 300: 1653–1659.
19 Carrier M, Rodger MA, Wells PS, et al. Residual vein obstruction to predict the risk of recurrent venous thromboembolism in patients with deep vein thrombosis: a systematic review and meta- analysis. J Thromb Haemost 2011; 9: 1119–1125.
20 Sostman HD, Stein PD, Gottschalk A, et al. Acute pulmonary embolism: sensitivity and specificity of ventilation- perfusion scintigraphy in PIOPED II study. Radiology 2008; 246: 941–946.
21 Anderson DR, Kahn SR, Rodger MA, et al. Computed tomographic pulmonary angiography vs ventilation- perfusion lung scanning in patients with suspected pulmonary embolism: a randomized controlled trial. JAMA 2007; 298: 2743–2753.
22 Cahill AG, Stout MJ, Macones GA, Bhalla S. Diagnosing pulmonary embolism in pregnancy using computed- tomographic angiography or ventilation–perfusion. Obstet Gynecol 2009; 114: 124–129.
23 Palareti G, Schellong S. Isolated distal deep vein thrombosis: what we know and what we are doing. J Thromb Haemost 2012; 10: 11–19.
24 Pengo V, Denas G, Zoppellaro G, et al. Rivaroxaban vs warfarin in high- risk patients with antiphospholipid syndrome. Blood 2018; 132: 1365–1371.
25 Young AM, Marshall A, Thirlwall J, et al. Comparison of an oral factor xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: results of a randomized trial (SELECT- D). J Clin Oncol 2018; 36: 2017–2023.
26 Raskob GE, van Es N, Verhamme P, et al. Edoxaban for the treatment of cancer- associated venous thromboembolism. N Engl J Med 2018; 378: 615–624.
27 Agnelli G, Prandoni P, Santamaria MG, et al. Three months versus one year of oral anticoagulant therapy for idiopathic deep venous thrombosis. Warfarin Optimal Duration Italian Trial Investigators. N Engl J Med 2001; 345: 165–169.
28 Agnelli G, Buller HR, Cohen A, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013; 368: 699–710.
29 Weitz JI, Lensing AWA, Prins MH, et al. Rivaroxaban or aspirin for extended treatment of venous thromboembolism. N Engl J Med 2017; 376: 1211–1222.
30 Boutitie F, Pinede L, Schulman S, et al. Influence of preceding length of anticoagulant treatment and initial presentation of venous thromboembolism on risk of recurrence after stopping treatment: analysis of individual participants’ data from seven trials. BMJ 2011; 342: d3036.
31 McRae S, Tran H, Schulman S, et al. Effect of patient’s sex on risk of recurrent venous thromboembolism: a meta- analysis. Lancet 2006; 368: 371–378.
32 Coppens M, Reijnders JH, Middeldorp S, et al. Testing for inherited thrombophilia does not reduce the recurrence of venous thrombosis. J Thromb Haemost 2008; 6: 1474–1477.
33 Segal JB, Brotman DJ, Necochea AJ, et al. Predictive value of factor V Leiden and prothrombin G20210A in adults with venous thromboembolism and in family members of those with a mutation: a systematic review. JAMA 2009; 301: 2472–2485.
34 Ageno W, Mantovani LG, Haas S, et al. Safety and effectiveness of oral rivaroxaban versus standard anticoagulation for the treatment of symptomatic deep- vein thrombosis (XALIA): an international, prospective, non- interventional study. Lancet Haematol 2016; 3: e12–e21.
35 Brighton TA, Eikelboom JW, Mann K, et al. Low- dose aspirin for preventing recurrent venous thromboembolism. N Engl J Med 2012; 367: 1979–1987.
36 Barco S, Corti M, Trinchero A, et al. Survival and recurrent venous thromboembolism in patients with first proximal or isolated distal deep vein thrombosis and no pulmonary embolism. J Thromb Haemost 2017; 15: 1436–1442.
37 Nieto JA, Bruscas MJ, Ruiz-Ribo D, et al. Acute venous thromboembolism in patients with recent major bleeding. The influence of the site of bleeding and the time elapsed on outcome. J Thromb Haemost 2006; 4: 2367–2372.
38 De Stefano V, Simioni P, Rossi E, et al. The risk of recurrent venous thromboembolism in patients with inherited deficiency of natural anticoagulants antithrombin, protein C and protein S. Haematologica 2006; 91: 695–698.
39 Hoeper MM, Humbert M, Souza R, et al. A global view of pulmonary hypertension. Lancet Respir Med 2016; 4: 306–322.
40 Prior DL, Adams H, Williams TJ. Update on pharmacotherapy for pulmonary hypertension. Med J Aust 2016; 205: 271–276. https://www.mja.com.au/journal/2016/205/6/update-pharmacotherapy-pulmonary-hypertension
41 Jain A, Cifu AS. Prevention, diagnosis, and treatment of postthrombotic syndrome. JAMA 2016; 315: 1048–1049.
42 Kahn SR, Comerota AJ, Cushman M, et al. The postthrombotic syndrome: evidence-based prevention, diagnosis, and treatment strategies: a scientific statement from the American Heart Association. Circulation 2014; 130: 1636–1661.
43 Villalta S, Bagatella P, Piccioli A et al. Assessment of the validity and reproducibility of a clinical scale for the post-thrombotic syndrome [abstract]. Haemostasis 1994; 24: 158a.
44 Morling JR, Yeoh SE, Kolbach DN. Rutosides for treatment of post-thrombotic syndrome. Cochrane Database Syst Rev 2015; (9): CD005625.
45 Enden T, Haig Y, Klow NE, et al. Long- term outcome after additional catheter- directed thrombolysis versus standard treatment for acute iliofemoral deep vein thrombosis (the CaVenT study): a randomised controlled trial. Lancet 2012; 379: 31–38.
46 Vedantham S, Goldhaber SZ, Julian JA, et al. Pharmacomechanical catheter- directed thrombolysis for deep- vein thrombosis. N Engl J Med 2017; 377: 2240–2252.
47 Kahn SR, Shapiro S, Wells PS, et al. Compression stockings to prevent post- thrombotic syndrome: a randomised placebo- controlled trial. Lancet 2014; 383: 880–888.
48 Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate- risk pulmonary embolism. N Engl J Med 2014; 370: 1402–1411.
49 Wan S, Quinlan DJ, Agnelli G, Eikelboom JW. Thrombolysis compared with heparin for the initial treatment of pulmonary embolism: a meta- analysis of the randomized controlled trials. Circulation 2004; 110: 744–749.
50 Sharifi M, Bay C, Skrocki L, et al; “MOPETT” Investigators. Moderate pulmonary embolism treated with thrombolysis (from the “MOPETT” trial). Am J Cardiol 2013; 111: 273–277.
51 Decousus H, Leizorovicz A, Parent F, et al. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d’Embolie Pulmonaire par Interruption Cave Study Group. N Engl J Med 1998; 338: 409–415.

коментарів