Вагінальний імплантат, що перешкоджає вторгненню вірусу
Вірус імунодефіциту людини. Один з найбільш лякаючих патогенів людства, що призводить до мільйонів смертей та погіршує якість життя мільйонам. Поширення ВІЛ у світі вважається пандемією. У сучасних умовах ВІЛ-інфекція належить до невиліковних хвороб, має тривалий хронічний перебіг і, у разі відсутності ефективної терапії, закінчується смертю хворого. Лікування не може повністю позбавити інфіковану людину від вірусу. Препарати, що наразі використовуються, лише пригнічують розмноження вірусу, суттєво зменшуючи його кількість. Але досі не знайдено способу вивести вірус з організму повністю
Щоправда, окрім тих двох випадків, коли у пацієнтів («лондонського» та «берлінського») замінили повністю кістковий мозок, оскільки вони хворіли ще й на лімфому. Донори при цьому мали мутацію у рецепторі CCR5, що відіграє ключову роль у потраплянні вірусу всередину клітин (ми писали про це у попередньому номері журналу «З турботою про жінку»).
Звісно, що пересадка кісткового мозку в тих випадках була лікуванням саме лімфоми і пацієнтам, які не мають онкозахворювань, ніхто не буде пересаджувати кістковий мозок, бо процедури, які для цього необхідні, дуже ризиковані та згубні для здоров’я і не використовуються без нагальних потреб. Сучасна антиретровірусна терапія дуже дорога, і не кожна країна може собі дозволити лікувати хворих безкоштовно, зокрема, в Африці, де найбільша кількість хворих.
Окрім того, препарати мають значні небажані дії і вірус має здатність мутувати та ставати резистентним до ліків. Тому найбільш ефективним способом боротьби із пандемією ВІЛ/СНІД є саме запобігання захворюваності: попередження проникнення вірусу в організм, в тому числі, використання презервативів, стерилізація інструментів тощо.
За даними UNAIDS, програми ООН з ВІЛ та СНІД, більше половини людей, які мають ВІЛ – жінки. Тридцять дев’ять відсотків людей, що інфіковані, живуть у країнах, що розвиваються і більше ніж 70% популяції розташовано в Африці на південь від Сахари. Незважаючи на те, що презерватив є чи не найкращим засобом попередження інфікування, низька частота його використання, обмежена соціокультурними факторами у цих країнах, перешкоджає захисту проти ВІЛ.
Проте у популяції існує частина жінок, які природньо резистентні до ВІЛ. Зокрема, серед секс-робітниць у Кенії, які дуже часто мали незахищені статеві контакти з ВІЛ-інфікованими партнерами, траплялись такі жінки, що залишались серонегативними [1], незважаючи на контакт з вірусом.
Як виявилось, у серонегативних жінок так чи інакше пригнічена місцева імунна система слизової оболонки статевих шляхів. Натхненні такою інформацією, група канадських дослідників (команда Emmanuel Ho спільно з Keith Fowke) вирішила пошукати рішення для захисту від інфікування ВІЛом. Можливо, природний імунітет допоможе знайти відповідь. Про що й піде мова далі.
Що саме відбувається в імунній системі ВІЛ-резистентних жінок? По-перше, слід згадати, що головною мішенню для вірусу є CD4+ Т-лімфоцити. Ці клітини мають рецептори ССR5, до якого приєднуються білки віріонів, що дозволяє їм у подальшому проникнути у клітину. Саме у цих клітинах відбувається масове розмноження вірусу, внаслідок чого вони гинуть.
Останнє і призводить до пригнічення імунітету хворого, оскільки Т-лімфоцити відіграють ключову роль у розпізнаванні та знищенні клітин, які заражені патогенами. У такому стані організму важко боротись з будь-якою інфекцією.
Але повернімось до резистентних жінок. Виявилось, що у них спостерігається зниження базової імунної активації у статевих шляхах і що їхні Т-лімфоцити перебувають у стані спокою. А найбільш сприйнятливими до ВІЛ є саме активовані Т-лімфоцити. Такий «імунно спокійний» стан асоціюється зі зниженою експресією маркерів Т-клітинної активації, зниженими рівнями транскрипції генів та продукції прозапальних цитокінів, що зазвичай залучені при інфікуванні ВІЛ.
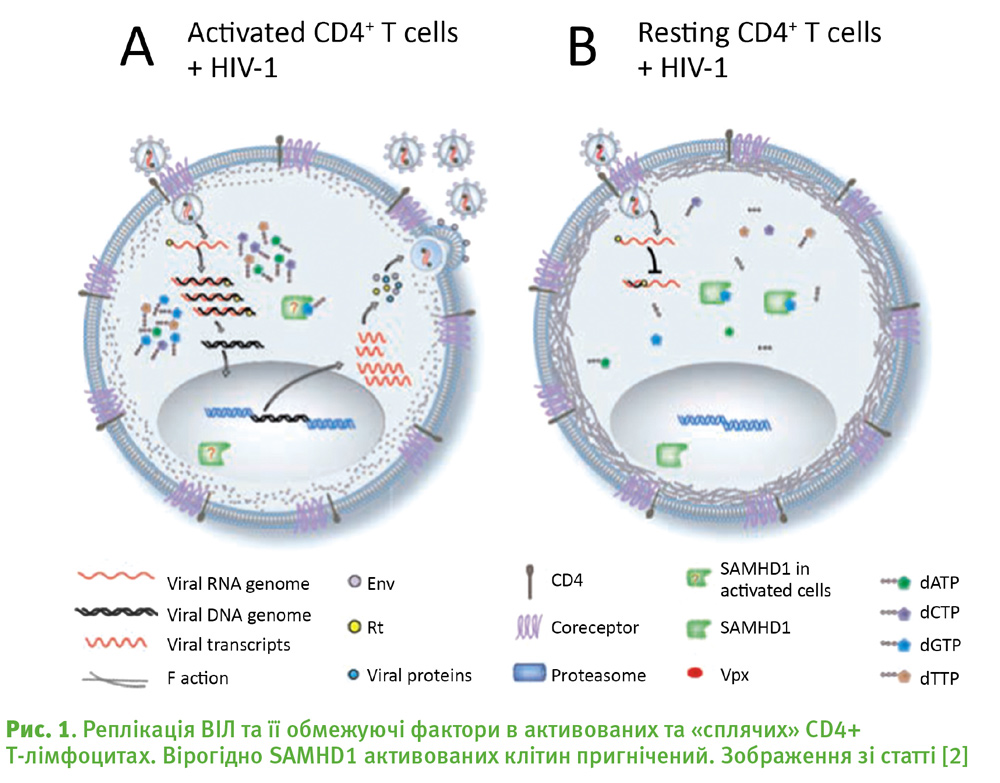
Які ж механізми пригнічення вірусу у неактивованих CD4+ Т-лімфоцитах? І чим відрізняються активовані CD4+ Т-лімфоцити від «сплячих»? Звісно, що вірус таки може потрапляти у неактивовані клітини, оскільки у них все одно на поверхні залишаються ті самі рецептори ССR5, з якими взаємодіють віріони. Такі клітини підступно можуть бути латентним резервуаром. Проте сплячі CD4+ Т-лімфоцити не підтримують вірусну реплікацію, тобто вірус не може розмножуватись всередині клітини. Як і інші віруси, ВІЛ є облігатним паразитом і повністю залежний від придатної внутрішньоклітинної машинерії хазяїна для більшості етапів свого життєвого циклу, використовуючи ресурси та апарат клітини на власні потреби.
Проте організм хазяїна еволюціонував разом із вірусом і за весь час спільного існування «винайшов» способи протидії. По-перше, у неактивованій клітині існує фізичний бар’єр у вигляді актину (рис. 1, В, actin), що попереджає проникнення вірусних часток глибше всередину клітини. Тоді як в активованих клітинах шар актину значно послаблений. Проте, вірус подекуди може подолати цей бар’єр сплячих Т-лімфоцитів за рахунок каскадних реакцій внаслідок взаємодії вірусної частки з рецепторами на поверхні мембрани.
Тим не менше, навіть якщо декілька вірусних часток досягне цитоплазми клітини, найбільш критичне обмеження не допустить подальшого розмноження вірусу. Перший етап після проходження клітинної мембрани – обернена транскрипція – буде заблокованою. Хитрість полягає у ферменті під назвою SAMHD1. Цей SAMHD1 володіє фосфогідролазною активністю і перетворює деоксинуклеозид трифосфати (dNTP, «будівельні блоки» для синтезу нуклеїнових кислот) на неорганічний фосфат та деоксинуклеозид дифосфат (тобто відщеплює одну фосфатну групу). У процесі синтезу ДНК можуть вбудовуватись лише трифосфати, а дифосфати – відбраковуються. Таким чином, SAMHD1 виснажує пул dNTP, доступних для зворотної транскриптази вірусу, не відбувається синтез комплементарної ДНК з РНК віріона і реплікація вірусу стає неможливою. Також SAMHD1 запобігає активації імунної системи і проявляє нуклеазну активність по відношенню до одноланцюгових ДНК та РНК.
Як відомо, для нашого організму одноланцюгові ДНК та РНК майже нехарактерні, тому це ще один захист від вірусів – розщеплювати чужорідні НК. SAMHD1 вважається основним стримуючим фактором для вірусної реплікації. Однак, крім нього існує ще декілька шляхів. Зокрема, якщо розглядати хід подій у Т-лімфоциті, як неактивованій клітині. За відсутності зовнішніх стимулів, які можуть запустити клітинну проліферацію та інші сигнальні процеси від Т-клітинних рецепторів, багато передбачених програм транскрипції (тобто активного зчитування) генів знаходяться на неактивній стадії. Клітина знаходиться у стані спокою, вона відповідно не активує транскрипцію власних генів, бо їй не потрібно ні на що реагувати. А гени ВІЛ якраз потребують тих самих факторів, які зазвичай використовуються у клітині щоразу, коли відбувається зчитування будь-якого гену. Зокрема, фактор елонгації pTEFb необхідний для запуску вірусної транскрипції.
У декількох дослідженнях показано, що важливі компоненти цього фактору pTEFb мають знижену експресію та активність у сплячих Т-лімфоцитах [2]. Також обмеження вірусної транскрипції здійснюється банально тому, що не вистачає транскрипційних факторів та факторів ініціації, які потрібні вірусу, бо в нього немає таких власних. А у клітині їх теж немає, тому що вона нічого зараз не синтезує.
Отже, таким чином, коли Т-лімфоцит знаходиться у стані спокою, відповідно і ВІЛ не буде розмножуватись.
Встановлено, що у серонегативних жінок, які мали контакт з ВІЛ, спостерігаються знижені рівні продукції прозапальних цитокінів та хемокінів, інтерферону [1], знижується експресія маркерів Т-клітинної активації. Окрім того, знижується ще й експресія самого CCR5.
На противагу цьому, будь-яке підвищення прозапальних медіаторів призведе до залучення нових Т-лімфоцитів та інших імунних клітин, до яких тропний ВІЛ. Будь-яке запалення, спричинене чи то тертям при вагінальному статевому акті, чи то присутністю інших існуючих інфекцій (бактеріальний вагіноз, гонорея…), або навіть використанням сперміцидних гелів буде підвищеним ризиком зараження. Втім, неактивний стан CD4+ Т-лімфоцитів та імунну сплячку можна підтримувати фармакологічно у жіночих статевих шляхах. Тим самим можна забезпечити захист жінок від ВІЛ-інфекцій. У якості нової стратегії попередження інфікування, нещодавно було проведено дослідження на моделі кроликів, де використовували вагінальний імплант з контрольованим вивільненням гідроксихлорохіну.
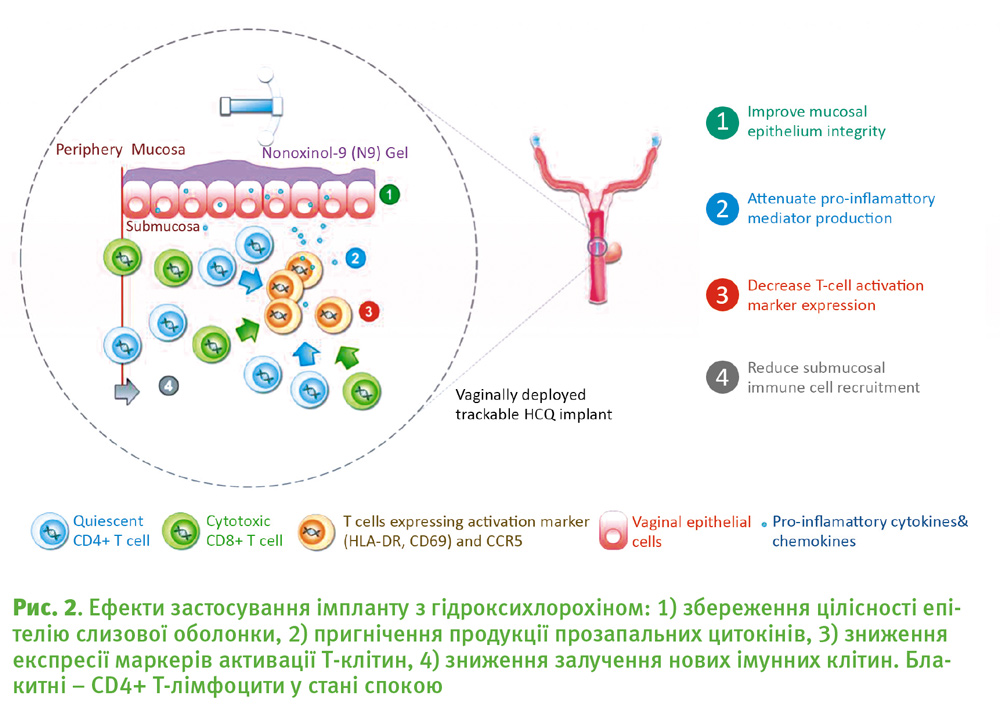
Гідроксихлорохін (HCQ) – препарат-імуномодулятор, що використовується для лікування малярії та ревматоїдного артриту та чинить пряму противірусну дію на ВІЛ. Він інгібує глікозилювання одного з рецепторів вірусу – gp120. У результаті віріони ВІЛ стають неінфекційними. Проте у дослідженні, про яке йде мова далі, використані саме імуномодулюючі властивості гідроксихлорохіну. З цим препаратом було створено неінвазивний імплант, що вводився у вагіну кролиць. Суть експерименту полягала в тому, що в однієї групи кролиць штучно викликали місцеве запалення статевих шляхів за допомогою ноноксинолу-9 (N9) і досліджували дію HCQ при такому запаленні. Відомо, що N9, який початково використовувався як ефективний сперміцид для знищення інфекційних бактерій та деяких вірусів, включно з ВІЛ, у більш пізніх клінічних дослідженнях призводив до підвищення інфікування ВІЛом внаслідок провокування випадків вагінального запалення.
Дане дослідження з імплантами вперше продемонструвало, що після індукованого запалення HCQ зменшував підслизове залучення імунних клітин, знижував експресію Т-клітинних маркерів активації та пригнічував індукцію ключових прозапальних медіаторів. Окрім того, HCQ пригнічував експресію маркерів активації Т-клітин – RLA-DR (Rabbit Leukocyte Antigen – аналог Human Leukocyte Antigen, HLA-DR) та експресію рецепторів ССR5 і СD69 у Т-лімфоцитів вагінальної слизової оболонки, знижував експресію N9-індукованих запальних маркерів (IL-1b, IL-8, TNF-a, MIP-3a). Отже, HCQ зменшував N9 індуковане запалення слизової оболонки та активацію Т-лімфоцитів.
Важливо зазначити, що при застосуванні окремо від інших речовин, гідроксихлорохін підтримував низький базовий рівень імунної активації і всі досліджувані показники не відрізнялись від контрольної групи та плацебо. Це означає що сам препарат та імплант не викликали імунної відповіді.
У чому перевага такого вагінального імпланту для захисту від ВІЛ-інфекції? Більшість випадків передачі ВІЛ трапляється саме через генітальні слизові оболонки.
Очевидно, що це ворота інфекції і саме тут реакції місцевого імунітету найбільш суттєві, значимі для підсумкового результату: відбудеться інфікування, чи ні.
Будь-яке запалення, супутнє й необов’язково пов’язане з ВІЛ, може зіграти тільки «на руку» вірусу. У такому випадку збільшується рівень прозапальних цитокінів, відбувається залучення та активація все більшої кількості нових Т-лімфоцитів у середовищі вагінальної слизової оболонки. Таким чином, буде більше «легкої здобичі» для інфекції саме у цьому місці, а не деінде.
Дані, отримані у ході багаторазових досліджень як ВІЛ, так і вірусів імунодефіциту мавп, свідчать про більш суттєвий вплив вірусу на початкових етапах саме на місцеву імунну систему слизової оболонки, порівняно із впливом на загальний імунітет. Тому логічно, що подібного роду препарати застосовуватимуться саме місцево. Жоден оральний препарат не досягне такого результату через особливості біодоступності. Тим більше, що HCQ у ході дослідження з вагінальними імплантами не виявляли у крові. Тобто HCQ не пригнічуватиме імунітет на системному рівні.
Серед недоліків такого методу захисту від інфікування залишається відкрите питання, що буде відбуватись у випадку інших інфекцій? Коли, навпаки, потрібна активація імунних клітин, щоб побороти патоген і не допустити розповсюдження інфекції далі. Чи не буде це тим самим імунодефіцитом, але місцевим?
Ще один підводний камінь – латентний резервуар вірусу, який в невеликих кількостях, але все ж потрапив до неактивованих Т-лімфоцитів. Якщо такі лімфоцити залишатимуться в організмі, то знову ж таки, будь-яка інша інфекція чи запалення можуть стати стимуляцією для таких клітин шляхом тих же прозапальних цитокінів. У такому випадку заблокована реплікація вірусу та транскрипція може бути запущеною. Наскільки вагінальний препарат буде стійким для пригнічення? Який поріг активації буде досягнено? Відповідно, якщо робити перерву у застосуванні імпланту, то це неабиякий ризик зараження?
Відповіді на ці та інші питання залишаються поки що відкритими, так само як і подальша розробка аналогів імплантів для людей та їх клінічні дослідження. Тим не менш, результат, отриманий у дослідженні з HCQ-імплантом , свідчить, що мікробіцид, розроблений для підтримки низького рівня імунної активації у жіночих статевих шляхах, може бути багатообіцяючою стратегією для зниження ВІЛ-інфекції.
Ось такий от парадокс. Пригнічення імунної системи (нехай лише місцевої, але пригнічення), замість звичного для нас стимулювання, може стати в нагоді для боротьби проти ВІЛ/СНІД.


коментарів