Атлас клітин людини (або Human Cell Atlas) — нове прогресивне слово для біологічної та медичної галузі. Це проект зі створення генетичних карт усіх клітин людини. Проект, який за масштабністю не поступається, а то навіть і переважає «Геном людини». Атлас клітин має на меті розробити каталог усіх типів та підтипів клітин організму, визначити їх локалізацію, розрізнити їх різні стадії розвитку, зафіксувати історію перетворень від стовбурових клітин до зрілих диференційованих. Це надзвичайно цінний ресурс, що дозволить глобальному дослідницькому співтовариству систематично вивчати біологічні зміни, пов’язані з різними захворюваннями, зрозуміти, де в нашому організмі активовані гени, пов’язані з хворобою, проаналізувати молекулярні механізми, які регулюють активність різних типів клітин, і розібратися, як різні типи клітин поєднуються і працюють разом, щоб утворити тканини.
Такий проект став можливий завдяки розвитку геноміки і одноклітинної транскриптоміки та їх методів (секвенування РНК, ДНК та біоінформатики, див. визначення нижче). Секвенування РНК окремих клітин (single-cell RNA-sequencing, скорочено scRNA-Seq) зробило можливими аналіз клітинного різноманіття у популяціях клітин, які вважалися раніше однорідними, аналіз траєкторій розвитку клітин і моделювання динаміки транскрипційних процесів. І все це при дуже високій біологічній «роздільній здатності», що була недосяжною при традиційному секвенуванні масивних популяцій клітин.
Геноміка – галузь молекулярної біології, що спрямована на дослідження організації та функціонування сукупності всієї генетичної інформації органзіму (геному).
Транскриптоміка окремих клітин – галузь біологічних досліджень, основним інструментом якої є методи кількісного аналізу експресії генів в індивідуальних клітинах. Ці методи включають сучасні технології секвенування РНК окремих клітин та біоінформатику. Грубо кажучи, транскриптоміка досліджує ефективність транскрипції тих чи інших генів, що є показником їх експресії.
Транскрипція – процес синтезу РНК на основі ДНК як матриці.
Транскриптом – сукупність всіх молекул РНК, утворених в результаті транскрипції в одній клітині або групі клітин. Тому транскриптоміка оцінює наявність, кількість та інші показники саме молекул РНК, а не ДНК.
Експресія генів – процес, в ході якого спадкова інформація, закодована у вигляді ДНК, використовується для синтезу функціонального продукту генів. Тобто, експресія – це вираження генів, їх безпосереднє функціонування.
Секвенування – метод для визначення послідовностей нуклеотидів у ДНК чи РНК.
Одним з перших в рамках проекту Human Cell Atlas стало дослідження ранньої вагітності. Репродуктивний успіх залежить від подій, які відбуваються під час плацентації у першому триместрі. Тому ця тема є найбільш гострою. Раніше проводились дослідження поклітинного РНК-секвенування на клітинах матки у кінці гестаційного періоду та мали обмежені популяції клітин плаценти фетального походження. Нещодавно було вперше створено коплексний поклітинний транскриптомний атлас материнсько-плодової взаємодії протягом перших тижнів гестаційного періоду.
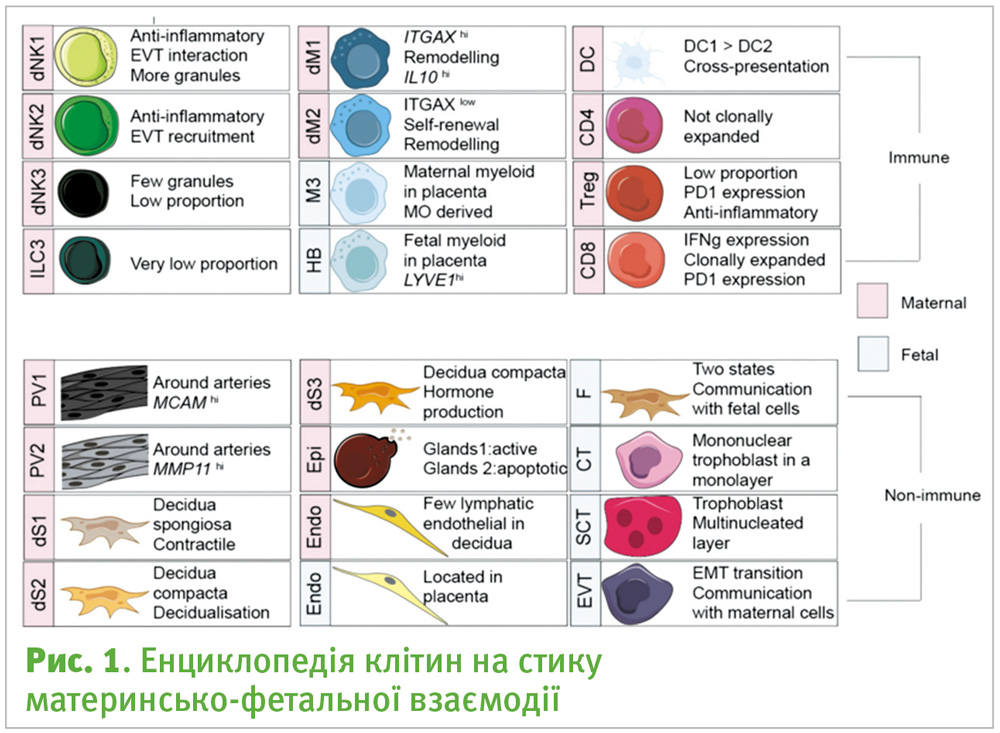
Дослідники з Інституту Wellcome Sanger, університетів Ньюкаслу та Кембриджу здійснили секвенування РНК понад 70 000 окремих клітин плаценти і матки на межі їх взаємодії у першому триместрі, а також відповідних клітин материнської крові. Даний атлас клітин із зони контакту між матір’ю та плодом на ранніх стадіях вже опублікований у журналі “Nature” [1]. Зразки плода, децидуальної оболонки та периферичної крові відбирали у жінок, які пройшли штучне переривання вагітності за власним бажанням. Всі пацієнтки були здоровими вагітними жінками (6–14 тижнів гестаційного періоду). У ході дослідження, шляхом групування клітин, що мали ідентичні транскриптоми, було визначено 29 клітинних популяцій (рис. 1).
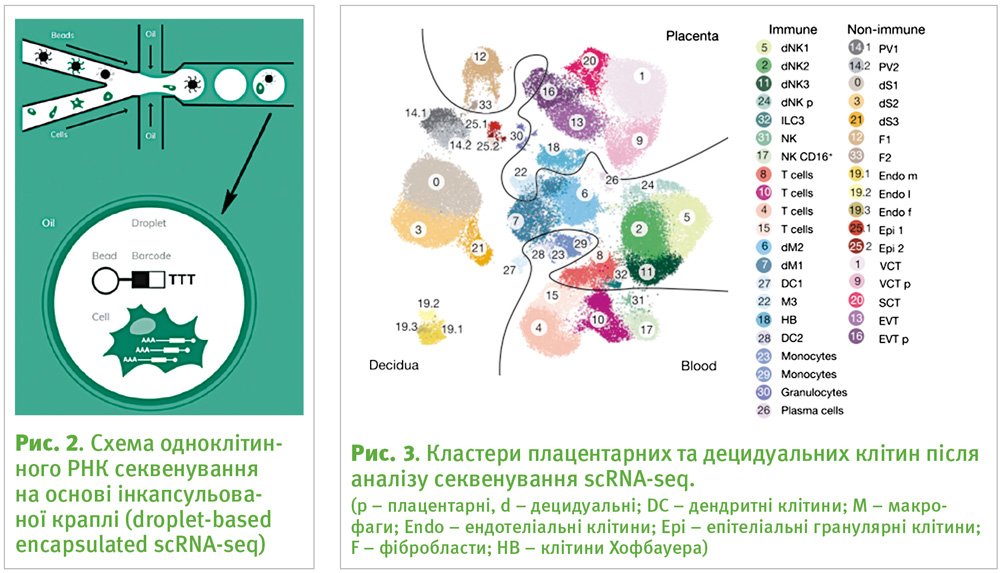
Як же відбувається процес секвенування РНК окремих клітин? Тут декілька етапів. По-перше, варто зазначити, що, незважаючи на суттєвий методичний прогрес, досі неможливо секвенувати РНК окремої клітини безпосередньо. Спочатку необхідно отримати з неї комплементарну ДНК (кДНК), а її вже можна секвенувати. Крім того, при одноклітинному секвенуванні РНК потрібно вирішити задачу відокремлення клітин одна від одної та ампліфікувати (збільшити кількість молекул) РНК, тому що у клітині її знаходиться надто мало, щоб здійснити якісне секвенування.
Окремі клітини можна виділити кількома способами: 1) за допомогою методу флюоресцентно-активованих клітин (Fluorescence-activated cell sorting, скорочено FACS), коли всі зібрані клітини тканини мітять специфічними антитілами до певних відомих маркерів, характерних певним типам клітин.
Далі ці клітини поміщаються в пристрій, в якому клітини вишукуються по одній, і в залежності від кольору флуоресцентної мітки на антитілах відбувається сортування клітин; 2) за допомогою оптичного пінцету – сфокусованого лазера для утримання та переміщення мікроскопічних об’єктів; або 3) за допомогою мікроманіпуляції скляною піпеткою, відокремлюючи по одній клітині від всієї популяції під мікроскопом. Після відбору окремих клітин їх лізують (руйнують клітинну мембрану, щоб дістатись до молекул РНК) і проводять зворотню транскрипцію (синтез ДНК, використовуючи РНК як матрицю).
При цьому зворотню транскрипцію проводять вибірково лише для матричних РНК (тих, з яких зазвичай синтезуються білки), оскільки у даному контексті саме цей тип представляє для дослідника найбільший інтерес і необхідно її відокремити від інших типів РНК (наприклад рибосомальної, яка складає більшу частину всіх РНК). Ампліфікація кДНК проводиться за допомогою відомого методу ПЛР (полімеразної ланцюгової реакції). Сукупність молекул кДНК називають бібліотеками. Далі такі бібліотеки відправляють на секвенування.
Цікавим технічним моментом є те, що, оскільки клітин дуже багато, секвенувати кДНК з кожної клітини окремо буде енергозатратно та повільно по часу. Тому до кДНК кожної клітини приєднують унікальний ідентифікатор, який становить собою певну коротку випадкову послідовність (баркод, або штрихкод) (рис. 2). Таким чином, можна здійснювати секвенування для багатьох клітин одночасно, а завдяки баркодам зберігається інформація, з якої клітини отримана та чи інша молекула РНК.
Процес безпосереднього секвенування також може відбуватися кількома способами. Наразі існує вже багато різних типів секвенувань у залежності від дослідницьких задач та необхідної якості отриманих даних на виході. У дослідженні, про яке піде мова нижче, користувались методом одноклітинного РНК секвенування на основі інкапсульованої краплі та планшетний Smart-seq2.
У першому випадку клітини по одній разом з баркодом на кульці поміщають у капсулу, оточену олією (рис. 2). У другому клітини розташовуються по одній у лунках планшету. Після контролю якості дані, отримані у результаті обох технологій, інтегрувались і оформлені графічно у вигляді кластерів клітин (рис. 3).
Окрім визначення типів клітин, отримані транскриптоми були ретельно проаналізовані для виявлення зв’язків між клітинами, використовуючи базу даних основних міжклітинних взаємодій (CellPhoneDB). Ця база даних враховує мультимерну природу лігандів та рецепторів, інтегрована зі статистичною структурою, яка передбачає клітинні взаємодії між двома типами клітин. Таким чином, були передбачені взаємодії між клітинами, збагаченими відомими лігандами, та клітинами, що мають рецептори до них [1].
Цікавою виявилась «поведінка» на молекулярному рівні трьох популяцій клітин трофобласту (SCT – синцитіотрофобласт, VCT – ворсинковий цитотрофобласт, EVT позаворсинковий трофобласт). Передбачається, що цитотрофобласти і синцитиотрофобласти взаємодіють тільки з іншими плацентарними клітинами для подальшого розвитку плаценти і обміну поживними речовинами. А позаворсинкові клітини трофобласту (ЕVТ), які були виявлені як в плаценті, так і в децидуальній оболонці, взаємодіють з різними підтипами клітин децидуальної оболонки, сприяючи інвазії, розміщенню в матці та імунологічному прийняттю ембріона.
Також у дослідженні визначили три стромальних (dS) і дві периваскулярні (PV) популяції клітин в децидуальній оболонці (рис. 3) і наголошують на важливості їх розподілу. Мікроскопічні дослідження показали, що зовнішній шар децидуальної оболонки (компактний) населений двома типами стромальних клітин, що продукують пролактин та IGFBP1 (плацентарний білок, що бере участь у регуляції циклу ендометрію, дозріванні ооцитів та ін.). Передбачається, що вони, в першу чергу, взаємодіють з ЕVТ клітинами вторгнення, що забезпечує імуномодуляцію. Третя популяція строми експресує периваскулярні маркери і тому була класифікована до внутрішнього шару (губчастого) між залозами, де вона може підтримувати розвиток судинної системи плаценти.
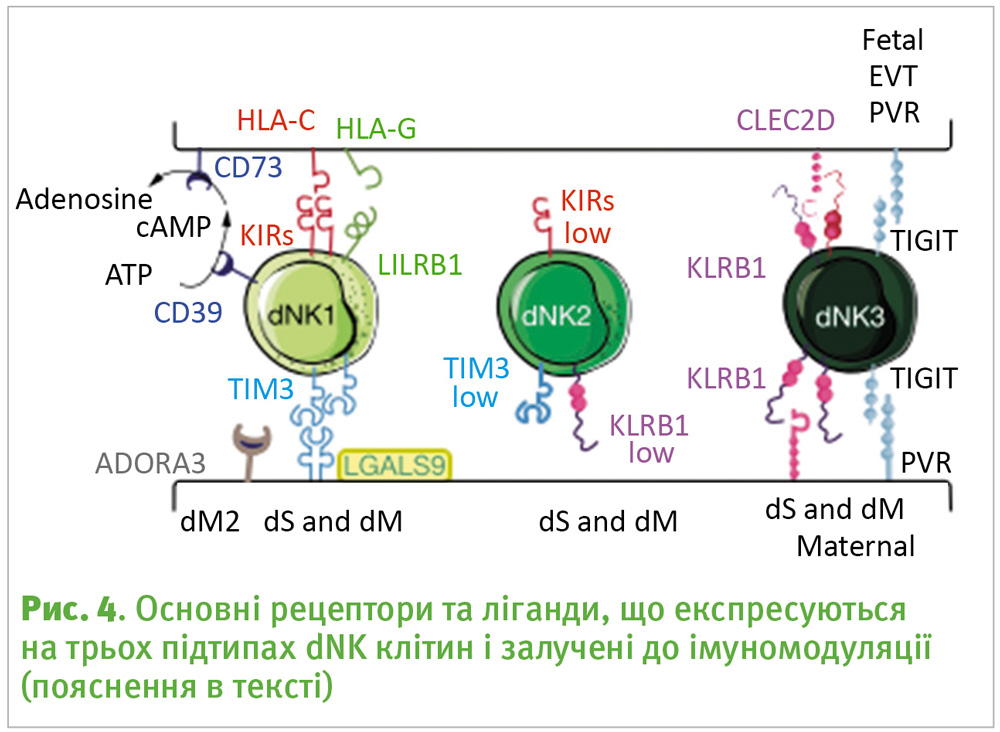
Особливістю дослідження є визначення трьох нових станів для клітин децидуальних природних кілерів (dNK). Із часів першої характеристики dNK в 1991 році вчені були здивовані їх ролями. Тепер автори прогнозують різноманітні взаємодії трьох dNK з іншими децидуальними або трофобластними клітинами для полегшення інвазії, імунотолерантності та судинного ремоделювання. Виокремлюється високосекреторна популяція CD39+ dNK, яка значною мірою бере на себе роль розпізнавання HLA-G (див. у статті [3]) та імунодепресанту галектину 9 (LGALS9) (рис. 4). Ця специфічна популяція dNK, на думку авторів, взаємодіє з EVT і стромальними клітинами компактного шару для припинення імунної активації, а отже, сильно впливає на результат імплантації.
Також було показано, що підтип децидуальних клітин NK1 експресує рецептори для молекул трофобластів HLA-C, HLA-E та HLA-G, і може бути метаболічно активований за рахунок збільшення експресії гліколітичних ферментів. Підвищена експресія гліколітичних ферментів у клітинах dNK1 (що представляє метаболічний праймінг) свідчить про те, що ці клітини можуть бути відповідальними за різні репродуктивні результати, що відрізняються у першовагітних порівняно з наступними вагітностями. Перші вагітності характеризуються нижчою концентрацією dNK, які експресують LILRB124 (імуноглобулін-подібний рецептор лейкоцитів), знижену вагу плода та підвищений ризик появи порушень, таких як прееклампсія. Все це може свідчити, що активація dNK1 клітин під час першої вагітності приводить до швидшої більш ефективної відповіді на імплантацію плаценти при наступних вагітностях.
Дане дослідження також свідчить, що будь-які шкідливі для плаценти або матки адаптивні чи вроджені імунні відповіді мінімізовані. Це є критичним для компромісу, необхідного для визначення «територіальної межі» між матір’ю та плодом. Таке середовище взаємодії має помітні паралелі з оточенням пухлин, де також зменшуються запальні та адаптивні імунні реакції. Децидуальні NK-клітини становлять близько 70% імунних клітин у першому триместрі.
У результаті вищеописаного дослідження було визначено три основні підгрупи NK-клітин і передбачено, що їхня ймовірна функція полягає в опосередкуванні ступеня інвазії трофобластів (про це також йшла мова у статті липневого номеру цього журналу [3]). Імунні реакції материнського організму пригнічуються різноманітними класами сигнальних молекул: експресією на поверхні клітин інгібіторів контрольних точок, таких як PD1, PDL1 (за їх відкриття та ефективне лікування раку присуджена Нобелівська премія 2018 [2]) або TIGIT (рецептори Т-клітин або натуральних кілерів, блокування яких так само призводить до підвищення клітинної проліферації, як блокування PD1), секрецією білків та малих молекул, таких як аденозин або стероїдні гормони.
Таким чином, на даному етапі вже визначено багато молекулярних і клітинних механізмів, які діють для створення фізіологічно «мирного» децидуального середовища. А вищеописаний клітинний атлас ранніх взаємодій між материнським організмом і плодом забезпечує необхідний ресурс для розуміння нормальної та патологічної вагітності, публічно представлений і може слугувати вченим і лікарям як допомога у наукових та практичних задачах.
Повний перелік літератури - на сайті extempore.info.


коментарів