Пренатальная диагностика является развивающейся, высокотехнологичной и достаточно сложной частью комплексной программы антенатальной охраны плода и матери, поскольку она находится на стыке таких прогрессивных клинических дисциплин как клиническая генетика, акушерство, цитогенетика, молекулярная и ультразвуковая диагностика. Прикладная сложность пренатальной диагностики обусловлена, с одной стороны, материальной и временной ограниченностью ее методов, а с другой стороны, неоднозначностью прогнозирования клинического исхода конкретного генетического заболевания по данным результатов пренатальных генетических тестов. В новейших рекомендациях по пренатальной диагностике различных стран [2, 17] сложности прогнозирования постнатального клинического течения заболевания по результатам генетического тестирования уделяется особое внимание.
Цель пренатального генетического тестирования – выявить проблемы со здоровьем плода и предоставить пациентке и ее врачу акушеру-гинекологу объективную и достоверную информацию, чтобы принять обоснованное решение о ведении беременности. Пренатальная диагностика не проводится исключительно для выявления показаний к прерыванию беременности. Тестирование предоставляет уникальную информацию для врача и пациента в плане управления акушерскими рисками, определения способов и сроков родоразрешения, возможности использования фетальной хирургии, раннего направления новорожденных к профильным специалистам, определение возможностей паллиативной помощи в случае, если прогноз для жизни плода несовместим с длительным выживанием [2, 17]. Пренатальное генетическое тестирование не может идентифицировать все аномалии или проблемы у плода, поэтому оно должно быть сосредоточено на рисках, репродуктивных целях и предпочтениях конкретного пациента [2].
В соответствии с данными мировой литературы, генетические синдромы диагностируются приблизительно у 5% новорожденных [19]. Считают, что из 1000 детей, рожденных живыми, 30–50 детей имеют определенные наследственные или врожденные заболевания. Из этого количества 5–14 человек страдают генными, 4–7 — хромосомными болезнями, 7–10 имеют заболевания с наследственной предрасположенностью, 19–22 — врожденные пороки развития (ВПР) [19]. Также, около 30% случаев перинатальной и неонатальной смерти обусловлено генетически детерминированной патологией [19] и часть из этих потерь является управляемой [19].
Пренатальная диагностика генетических синдромов, как комплекс диагностических мероприятий, направленных на выявление генетических расстройств у плода, включает в себя два компонента: первый – пренатальный генетический скрининг, который проводится в популяции низкого генетического риска и цель которого – выявить повышенный риск предрасположенности исследуемого плода к наиболее часто встречающейся генетической патологии, включает ультразвуковое исследование и исследование биохимических маркеров в сыворотке материнской крови.
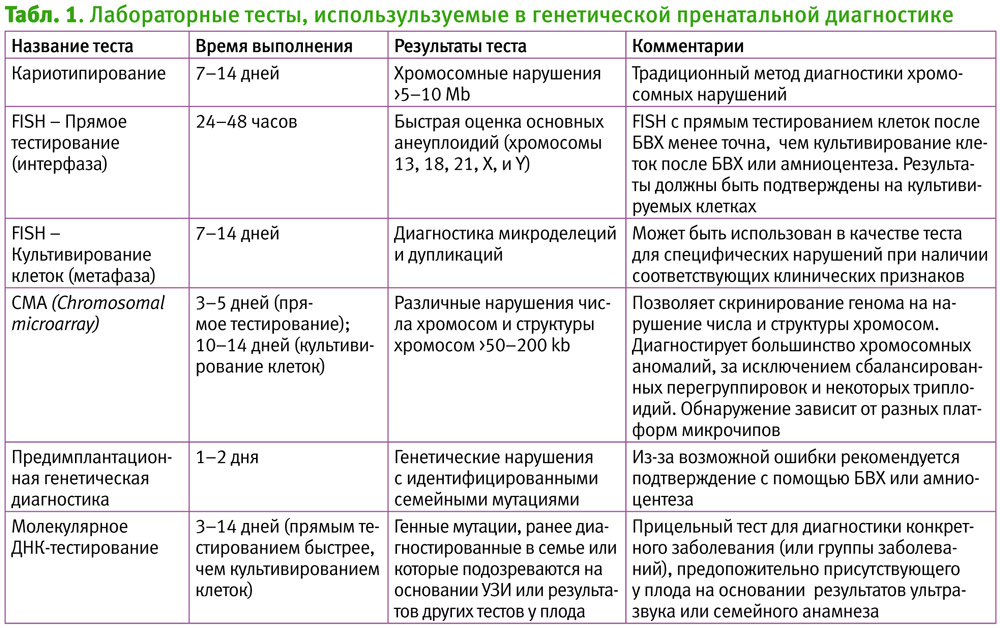
Второй компонент – пренатальное генетическое тестирование, которое проводится при высоком индивидуальном риске пренатального генетического скрининга или при наличии семейного анамнеза определенного генетического заболевания и представляет собой диагностику конкретных генетических синдромов по тестированию образцов тканей плодового происхождения, полученных в результате инвазивных диагностических процедур. В зависимости от искомой нозологии, традиционное цитогенетическое исследование плодовой ткани дополняется флуоресцентной гибридизацией in situ (fluorescence in situ hybridization, FISH), хромосомным микроматричным анализом (Chromosomal microarray analysis, СМА) или ДНК-тестированием [7]. Изначально пренатальное генетическое тестирование было разработано для трисомии 21 (синдром Дауна, наиболее часто встречающаяся в популяции анеуплоидия, популяционная частота в Украине составляет 1:1074 [19]), однако в настоящее время оно способно обнаруживать широкий спектр генетических нарушений.
В некоторых случаях, когда пренатальное тестирование невозможно, диагностика генетической патологии у плода может основываться на ультразвуковом синдромологическом анализе с эхокардиографией или магнитно-резонансной томографией, что позволяет диагностировать генетический синдром по совокупности структурных аномалий. Диагностика полигенных и мультифакториальных заболеваний с помощью генетического тестирования в настоящее время невозможна, хотя ряд пороков развития также может быть установлен пренатально с помощью ультрасонографии [2].
Особенности пренатальной диагностики в украинских реалиях своеобразны, поскольку, с одной стороны, отсутствует полноценный общепопуляционный пренатальный скрининг и только в отдельных медицинских учреждениях он проводится сертифицированными FMF специалистами (The Fetal Medicine Foundation – организацией, сертифицирующей проведение первичного скрининга хромосомной патологии во всем мире и предоставляющей программное обеспечение для расчета индивидуального риска наиболее часто встречающихся анеуплоидий). При этом у нас в стране доступно проведение неинвазивного пренатального теста (НИПТ). А с другой стороны, благодаря энтузиазму врачей-генетиков и цитогенетиков в ведущих украинских клиниках существует полноценная возможность проведения большинства методик пренатального генетического тестирования.
При этом, вопросы пренатальной диагностики генетических синдромов входят в компетенцию консультативной помощи врача акушера-гинеколога, который проводит первичное консультирование, назначает и оценивает результаты скрининга, определяет необходимость расширенной консультации врача-генетика. Поэтому, представленный обзор предназначен для информирования практикующих врачей акушеров-гинекологов о современных возможностях пренатального тестирования генетических синдромов.
Представленный материал носит ознакомительный характер с комплексом входящих в пренатальную диагностику методик, показаний и рекомендаций по их использованию на основании выборочного обзора последних мировых рекомендаций, гайдлайнов и статей, посвященных проблеме пренатальной диагностики генетических аномалий.
Пренатальное генетическое тестирование рекомендуется проводить с учетом индивидуальных потребностей пациентки и ее семьи. Назначение такого исследования, а также оценка его результатов не должны носить директивный характер [2,17].
Все беременные женщины должны быть проинформированы врачами о наличии и возможностях пренатального скрининга и диагностики генетической патологии у плода как можно раньше во время беременности, чтобы иметь время обсудить имеющиеся варианты и сделать осознанный выбор, пациентки вправе принять обоснованное решение не продолжать дальнейшие исследования. Также часть женщин могут сознательно отказываться от ультразвукового скрининга во время беременности, но они должны быть информированы о других важных преимуществах рутинного сканирования, включающих локализацию плаценты, подтверждение гестационного срока и многоплодия.
Информация о пренатальном тестировании должна подаваться четким, простым и понятным языком, с подтверждением того, что информация понята, а также преподноситься в формате, который легко понять беременным женщинам различного культурно-лингвистического происхождения и женщинам с особыми потребностями (физическими, сенсорными или ментальными).
По мнению The American College of Obstetricians and Gynecologists, 2016 [2], о возможностях пренатального тестирования генетических синдромов у плода следует информировать пациентов, имеющих следующие риски.
- Поздний репродуктивный возраст матери. Хотя риск развития анеуплоидии возрастает с увеличением возраста матери, только возраст не является эффективным маркером анеуплоидии. Напротив, структурные хромосомные аномалии, включая микроделеции и дупликации, не увеличиваются по частоте с возрастом матери [11].
- Поздний репродуктивный возраст отца ассоциируется с повышенным риском рождения ребенка с одним из моногенных заболеваний, как ахондроплазия, синдром Аперта или синдром Кроузона. Хотя по этому вопросу консенсус пока не достигнут, большинство исследований предложили определить возраст отца 40–50 лет как репродуктивно поздний. Генетический риск связан в основном с увеличением частоты мутаций генов, которые возникают во время сперматогенеза. В настоящее время нет скрининговых или диагностических тестов заболеваний, связанных с поздним репродуктивным возрастом отца.
Ведение беременности в данном случае ограничивается стандартным скринингом и диагностикой, включающей ультразвуковое исследование для оценки анатомии плода [2].
- Родители – носители хромосомной аберрации – женщины или мужчины, которые несут сбалансированную хромосомную аберрацию (транслокацию или инверсию). Пациенты имеют нормальный фенотип, но подвержены риску продуцирования гамет с несбалансированными хромосомами, которые приводят к генетическим аномалиям у потомства. Это может произойти из-за потери или дублирования небольшого количества генетического материала, нарушения структуры или изменения функции гена.
Для большинства этих пациентов риск рождения ребенка с несбалансированной аномалией меньше, чем теоретический риск ее реализации, поскольку определенная часть патологических беременностей абортируются в ранние сроки. Однако, носители хромосомных аберраций, которые диагностируются после рождения ребенка с генетической аномалией, имеют риск 5–30% для потомства с несбалансированными хромосомами в будущем, тогда как те, которые идентифицированы по другим причинам (например, во время бесплодия), имеют риск 0–5%. Исключениями являются некоторые перицентарные инверсии, такие как хромосома 9, которые рассматриваются как обычные варианты в общей популяции и не имеют клинических проявлений [10].
- У родителя – анеуплоидия или мозаичная форма анеуплоидии. Женщины с трисомией 21, хотя и субфертильные, имеют повышенный риск наличия потомства с трисомией. Женщины с 47, XXX и мужчины с 47, XYY обычно являются фертильными, и хотя данные о потомстве у этой категории пациентов ограничены, у них, как известно, нет повышенного риска наличия потомства с трисомией. Имеются данные о мужчинах с синдромом Клайнфелтера (47, XXY), в чьем потомстве, полученном в результате in vitro оплодотворения с интрацитоплазматической инъекцией спермы, отсутствовал повышенный риск анеуплоидии [14].
- Наличие в семье случаев ВПР. Большинство врожденных дефектов, таких как дефекты нервной трубки и врожденные пороки сердца, изолированы и являются результатом взаимодействия нескольких генов с факторами окружающей среды. Поскольку генетический компонент присутствует, есть риск повториться. Хотя риск рецидивов изолированных ВПР, которые не связаны с генетическими синдромами, варьируется в зависимости от аномалии и от пола больного ребенка, он обычно составляет 2–3%, но может быть выше в зависимости от числа повторных случаев подобных аномалий у родственников [12].
- Наличие у родителя носительства генетического заболевания. Родители, которые страдают или являются носителями генетических заболеваний, таких как серповидно-клеточная анемия, болезнь Тея-Сакса или кистозный фиброз, имеют повышенный риск рождения ребенка с соответствующей патологией. Родители, которые страдают заболеванием с аутосомно-доминантным типом наследования, например, нейрофиброматозом, имеют 50% риск реализации его у потомства. Однако, аутосомально-доминантные расстройства, наблюдаемые у предыдущего ребенка, но без семейной истории, вероятно, возникли как новая мутация. В таких случаях риск повторения невысокий.
Чтобы гарантировать родителям информативность тестирования на повторение конкретного заболевания во время беременности, необходим установленный молекулярным тестированием диагноз у больного ребенка [2].
- Наличие предыдущего плода или ребенка с аутосомной трисомией или половой хромосомной анеуплоидией. Риск рецидива после одной беременности с подобным нарушением в 1,6–8,2 раза превышает материнский возрастной риск аутосомных трисомий, в зависимости от типа трисомии и независимо от того, закончилась ли беременность самопроизвольным абортом, каков был возраст матери при рождении аномального плода и каков материнский возраст в настоящий момент. Риск рецидива меньше, но также повышен при 47, XXX и 47, XXY. Риск повторения не увеличивается при 45, X или 47, XYY [2].
- ВПР у плода, выявленные при УЗИ. Их диагностика увеличивает вероятность анеуплоидий, микроделеций и других генетических синдромов [8, 7, 18]. Риски зависят от количества и характера выявленных структурных аномалий. Комплексы определенных множественных ВПР являются конкретными генетическими синдромами. Связь анеуплоидии с маркерными ультразвуковыми находками варьируется в зависимости от выявленных изменений, но, как правило, она низкая при большинстве мелких эхо-маркеров [15].
Для проведения генетического тестирования необходимо произвести забор плодового материала с помощью методов доимплантационнной диагностики и методов инвазивной пренатальной диагностики.
Предимплантационная диагностика позволяет идентифицировать хромосомный набор и/или использовать методы молекулярной диагностики до пересадки эмбриона в полость матки. Генетическое тестирование проводят на полярных тельцах из ооцита и зиготы, одного бластомера из эмбриона, полученного in vivo, на стадии расщепления, или группы клеток из трофодермы на стадии бластоцисты. При данной методике для генетического тестирования используют только одну или несколько клеток эмбриона, и, во избежание ошибок, обычно рекомендуют подтверждать результаты с помощью биопсии ворсин хориона или амниоцентеза. [2]
Из методов инвазивной ПД преимущественно используются биопсия ворсин хориона и амниоцентез. Кордоцентез и биопсия тканей плода в настоящее время редко используются для диагностики генетических синдромов. Методики проведения инвазивных пренатальных вмешательств достаточно просты, выполняются в асептических условиях под постоянным ультразвуковым контролем и требуют постоянного использования мануального навыка оператором [1, 3, 6]. Общие показатели потерь плода после инвазивных процедур варьируются от 0,5 до 1,0% [3].
Главным преимуществом биопсии ворсин хориона (БВХ) является возможность его использования в первом триместре беременности, однако не ранее 10 недель, поскольку столь раннее вмешательство ассоциировано с повышенным риском редукционных пороков конечностей у плода [3]. Вторым веским критерием приоритета БВХ является сокращение сроков получения лабораторного ответа — 5–7 дней против 7–14 дней при культивировании амниоцитов [2].
Ведущим осложнением БВХ является вагинальное кровотечение, которое может наблюдаться у 32% пациентов при использовании трансвагинального доступа, но при использовании трансабдоминального доступа частота этого осложнения значительно ниже [1,3]. Такие осложнения как излитие околоплодных вод или инфицирование плодного яйца, составляют менее 0,5% [1,3].
Амниоцентез традиционно выполняется с 15 до 20 недель беременности трансабдоминальным доступом, однако возможно его проведение в более позднем или более раннем сроке.
Многие крупные многоцентровые исследования подтвердили безопасность генетического амниоцентеза, а также его цитогенетическую диагностическую точность [5, 6]. Наиболее частым его осложнением является спонтанное прерывание беременности, частота которого, по данным недавнего метаанализа, составляет 0,11% (1 из 900) [1]. Такие осложнения как кровянистые выделения и подтекание амниотической жидкости, составляют 1–2% случаев [13]. Если амниоцентез выполняется с 10 до 13 недель беременности, вероятность потери беременности возрастает до 2,5%, повышается вероятность спонтанного излития околоплодных вод и косолапости у плода до 1,3%, а из-за недостаточной митотической активности амниоцитов, частота неудач лабораторных тестов увеличивается [13]. Существенным преимуществом амниоцентеза перед БВХ является отсутствие в исследуемой культуре клеток так называемого плацентарного мозаицизма, поэтому руководствами по проведению пренатальной диагностики разных стран рекомендовано дополнять БВХ при получении аномального кариотипа культивированием амниоцитов или кордовой крови, при этом преимущество отдается амниоцентезу [2, 6].
Актуальным является риск трансмиссии инфекций во время проведения инвазивных процедур. Имеются небольшие исследования, посвященные вертикальной трансмисии вируса гепатита В и С, из которых следует, что при высокой вирусной нагрузке существует 21-кратное повышение риска вертикальной трансмисии при амниоцентезе в случае гепатита В, и повышенный ее риск в случае носительства HBs-антигена [2]. В случае гепатита С данные еще более ограничены, но на малых выборках риск трансмиссии оказался низким [2]. До применения комбинированной антиретровирусной терапии (combination antiretroviral therapy, cART) у ВИЧ-инфицированных беременных при выполнении инвазивных диагностических процедур риск вертикальной трансмисии был повышенный [16]. Однако, у женщин, принимающих сART и имеющих низкую или отсутствующую вирусную нагрузку, риск трансмиссии не увеличивается [16].
В целом, данных о степенях риска трансмисии инфекций в настоящее время недостаточно, и применение методов инвазивной пренатальной диагностики в случае наличия хронического носительства инфекций является сложной консультативной проблемой, когда следует обсудить преимущества и недостатки инвазивных и неинвазивных тестов и вариантов скрининга [2].
В случае многоплодной беременности при проведении генетического скрининга и расчетов рисков анеуплоидий важно правильное определение и понимание зиготности [9, 15].
Предтестовое консультирование в этом случае должно включать обсуждение вариантов дальнейшего акушерского ведения беременности, если только один из плодов имеет анеуплоидию. Необходимо рассмотреть все возможные варианты ведения такой беременности: продолжение беременности, прекращение беременности или выборочный фетоцид пострадавшего плода [2]. По данным небольших исследований, риск прерывания многоплодной беременности вследствие проведения амниоцентеза составляет 2%, а при БВХ – 1% [6, 9].
Генетическое тестирование не менее актуально в случае необъяснимой антенатальной гибели плода и мертворождения. В данном случае из инвазивных процедур лучше всего использовать амниоцентез, а из лабораторных тестов – СМА, поскольку он не требует использование только живых клеток, как кариотипирование, и возможно получить данные о микроделециях [4].
Возможности лабораторного тестирования плодового материала представлены в табл. 1 (American College of Obstetricians and Gynecologists. Practice bulletin No. 162, 2016: 120).
Выводы и рекомендации
Современные рекомендации по проведению генетического тестирования у беременных женщин различных стран базируются на общих принципах доказательной медицины и в качестве практических рекомендаций используют доказательные данные различного уровня. Рекомендации уровня доказательств А – доказательства, основанные на достаточном количестве последовательных научных исследований.
Рекомендации уровня доказательств В – рекомендации и выводы основаны на ограниченном или несогласованном научном обосновании.
Рекомендации уровня доказательств С – рекомендации, основанные на консенсусах и экспертных заключениях. Актуальны следующие рекомендации:
- Всем беременным женщинам должна предлагаться пренатальная оценка риска анеуплоидии путем скрининга или диагностического обследования, независимо от возраста матери или других факторов риска. (С)
- Возможности генетического тестирования должны обсуждаться как можно раньше во время беременности, в идеале при первом посещении врача акушера-гинеколога, и проводиться как можно раньше, чтобы определиться с тактикой ведения беременности в первом триместре.(С)
- Пренатальное генетическое тестирование не может идентифицировать все заболевания у плода, поэтому показанием к его проведению является высокий индивидуальный риск определенной генетической патологии. При определении показаний к его проведению необходимо учитывать репродуктивные планы и предпочтения конкретного пациента. (С)
- Частота потерь беременности в результате инвазивных диагностических процедур в настоящее время достаточно низкая и составляет 0,1–0,3% в руках опытных специалистов. (В)
- Ранний амниоцентез (до 14 недель беременности) не рекомендуется. (А)
- Риск вертикальной трансмиссии ВИЧ при амниоцентезе не увеличивается у женщин, получающих комплексную антиретровирусную терапию при отсутствии у них вирусной нагрузки. (В)
- Традиционное кариотипирование рекомендуется дополнять СМА, что позволяет дополнительно выявить 1,7% клинически значимых хромосомных микроаномалий при отсутствии ВПР у плода и 6% – при наличии ВПР. (А)
- Если выявленная структурная аномалия у плода является маркером конкретной анеуплоидии (например, атрезия двенадцатиперстной кишки или атриовентрикулярный септальный дефект, характерные для трисомии 21), кариотипирование (с или без FISH) может быть проведено без CMA. (А)
- Диагностика хромосомной патологии по результату FISH достоверна только в случаях, если этот результат подтвержден традиционным метафазным хромосомным анализом или СМА, или клиническими данными (например, наличием ультразвуковых маркеров хромосомной патологии или положительным результатом скрининга для трисомии 18 и 21). (В)
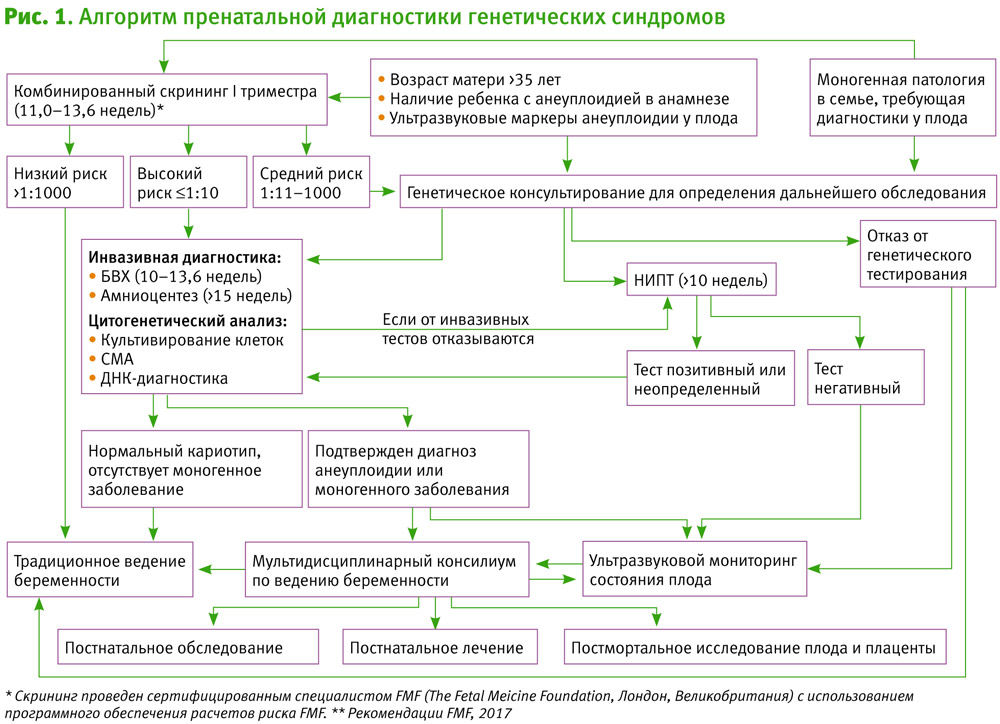
Для оптимизации консультативной помощи и определения тактики ведения на рис. 1 представлен алгоритм проведения пренатальной диагностики генетических синдромов.
Полный перечень литературы находится в редакции.


коментарів