Вступ
Негативний вплив надмірної маси тіла на здоров’я людини відомий від Гіппократа, якому належить афоризм: «Раптова смерть властивіша товстим, ніж худим». Проте сучасні уявлення про нормальну масу тіла почали формуватися тільки з 30-х років XX ст. До цього часу так звані хвороби цивілізації не були істотною проблемою для медицини, що важко боролася з інфекційними захворюваннями. За середньої тривалості життя менше 40 років вплив надмірної маси тіла на здоров’я людини не міг стати об’єктом дослідження. Нині ожиріння належить до найбільш глобальних захворювань [9].
Наявність ожиріння під час вагітності асоційована з розвитком серйозних ускладнень для матері та плода. Ускладнення, пов’язані з ожирінням, найбільш характерні для жінок з абдомінальним типом ожиріння (вісцеральним), яке у більшості випадків поєднується з комплексом гормональних і метаболічних порушень і є найбільш несприятливим у клінічних і прогностичних аспектах [6, 11, 12, 17].
Сьогодні особлива увага приділяється вивченню тромбофілічних ускладнень при ожирінні [10–12, 17]. Парадоксально, але при тому, що більшість відкриттів у гемостазіології пов’язані з акушерством, тривалий час в акушерстві вони ігнорувалися та впроваджувалися з великим запізненням порівняно з іншими клінічними дисциплінами. За ожиріння та наявності метаболічних порушень діагностують гіперкоагуляцію, знижується фібринолітична активність крові, що пов’язано з підвищенням тромбогенного потенціалу. Безсумнівною є роль тромбофілії не тільки у структурі тромбозів та тромбоемболічних ускладнень, але й у патогенезі низки захворювань та патологічних станів, до яких належать і акушерські ускладнення: звичне невиношування вагітності, пізній гестоз, синдром ЗРП, HELLP-синдром та інші [1–4, 12, 13, 15, 17].
Гіпергомоцистеїнемія (ГГЦ) у списку тромбофілій стоїть дещо окремо [2, 5, 7, 8, 15, 16]. На відміну від інших форм генетичної тромбофілії при ГГЦ, немає початкових порушень у системі гемостазу, вони розвиваються опосередковано, при порушенні в роботі ферментних систем, накопиченні гомоцистеїну (ГЦ) у плазмі крові, розвитку оксидантного стресу. ГГЦ при цьому стає незалежним чинником ризику розвитку тромботичних і акушерських ускладнень (незалежно від віку, дієти, наявності інших генетичних мутацій, які призводять до тромбозів), що пов’язано з розвитком артеріальних і венозних тромбозів [5, 7, 8, 15, 16].
Жоден з існуючих лікувальних протоколів не враховує ролі поєднання найбільш поширених тромбогенних форм тромбофілії, що призводить до гестаційних ускладнень і перинатальних втрат. Тобто жінок із надмірною масою тіла не відокремлюють із когорти вагітних, а наявну в їхньому організмі низку патогенетичних змін не беруть до уваги під час ведення вагітності.
Мета дослідження
Аналіз структури виявлених генних поліморфізмів та їхнього впливу на перебіг гестаційного процесу і систему гемостазу у вагітних залежно від фенотипу; оцінювання впливу міжгенної взаємодії генів–кандидатів тромбофілії та порушення обміну фолатів на виникнення акушерських ускладнень та перинатальних втрат у вагітних залежно від їхнього фенотипу.
Матеріали та методи
Для досягнення поставленої мети на базі відділення медицини плода й патології ранніх термінів вагітності комунального закладу «Дніпропетровський обласний перинатальний центр із стаціонаром «ДОР» (КЗ «ДОПЦС «ДОР») м. Дніпро проводили відбір жінок із загрозою невиношування вагітності та різною масою тіла, гестаційний термін у яких не перевищував 12 тиж. Було відібрано 175 жінок із загрозою невиношування вагітності віком від 20 до 41 років, які були залучені у дослідження та надалі розподілені по групах: І клінічна група (основна) – 120 (68,6%) жінок із загрозою невиношування вагітності на тлі надмірної маси тіла, ІІ клінічна група (порівняння) – 55 (31,4%) жінок із нормальною масою тіла (ІМТ 20–24,9 кг/м2) та із загрозливими для виношування вагітності симптомами, у яких було проведено поглиблене вивчення стану здоров’я.
Надмірну масу тіла діагностували у 50 (41,6%) жінок І клінічної групи, ожиріння І ступеня – у 59 (49,2%), ІІ–ІІІ ступеня – в 11 (9,2%) вагітних, середній ІМТ – 30,6±0,3 (95% ДІ: 30,1–31,2) кг/м2. У жінок ІІ клінічної групи ІМТ у середньому становив 21,3±0,2 (95% ДІ: 20,8–21,8) кг/м2 (р<0,001 між групами за t-критерієм).
Середній вік вагітних у І групі становив 30,9±0,4 (95% ДІ: 30,0–31,8) року, у ІІ групі – 30,3±0,6 (95% ДІ: 29,1–31,5) року (р=0,460 між групами за t-критерієм). Середній гестаційний вік на момент узяття на облік дорівнював 9,39±0,59 (95% ДІ: 8,22–10,56) тиж. і 8,42±0,69 (95% ДІ: 7,03–9,81) тиж. відповідно по групах (р=0,327 за t-критерієм). Отже, за цими показниками виділені клінічні групи були статистично зіставними (p>0,05).
Окрім загальноклінічних методів дослідження, які рекомендовані Наказами МОЗ №417 та №624, у розширеному обсязі за індивідуальною згодою жінки було проведено дослідження 8 генетичних варіантів поліморфізму генів тромбофілії та поліморфізму 4 генів, що відповідають за обмін фолатів, методом ПЛР у режимі реального часу на базі мережі лабораторій «Synevo» (сертифікована згідно з вимогами міжнародних стандартів ISO 9001:2001 та ISO 9001:2000; ліцензія МОЗ України АГ №599651 від 26.12.2011 р.; свідоцтво про атестацію № ПТ021/12 від 06.04.2012 р.). Для зручності розрахунків кожен геном (гомозигота за алелем 1 – нормальна гомозигота), гетерозигота і гомозигота за алелем 2 – патологічна гомозигота) кодували цифрами 0, 1, 2 відповідно.
Статистичне оброблення матеріалів дослідження проводили з використанням методів біостатистики [18], реалізованих у пакетах програм STATISTICA v.6.1 (Statsoft Inc., США; ліцензійний № AJAR909E415822FA) та MedCalс (MedCalc Software, Belgium) v.9.6.4.0.
Перевірку відповідності розподілу кількісних даних нормальному закону проводили за критеріями Колмогорова–Смірнова з поправкою Лілієфорса. Основні статистичні характеристики представлені у вигляді: кількості спостережень (n), середньої арифметичної величини (М), стандартної помилки середньої (±m), 95% довірчого інтервалу для середньої величини (95% ДІ), коефіцієнта варіації (С), відносних величин (%). Порівняння статистичних характеристик у різних групах і в динаміці спостереження проводили із використанням параметричних критеріїв: перевірка рівності дисперсій – за критерієм Фішера (F); оцінювання вірогідності відмінностей середніх – за критеріями Стьюдента для незв’язаних (t) вибірок; вірогідність відмінностей відносних показників – за критерієм Хі-квадрат Пірсона (c2). Для оцінювання взаємозв’язку між ознаками виконували кореляційний аналіз з розрахунком коефіцієнтів рангової кореляції Спірмена (rs). Критичне значення рівня значущості (р) приймали за £0,05.
Результати дослідження та їх обговорення
Нами не було виявлено достовірних відмінностей між групами як за паритетом вагітності: 2,5 [1,0; 4,0] вагітностей в основній групі проти 2,0 [1,0; 3,0] вагітностей у групі порівняння (р=0,232 за U-критерієм), так і за паритетом майбутніх пологів – 1,0 [1,0; 2,0] проти 1,0 [1,0; 1,0] відповідно (р=0,086 за U-критерієм). Водночас у жінок із надмірною масою тіла ці показники мали більш значні коливання: коефіцієнти варіації (С) дорівнювали 72,5% і 46,8% відповідно, а при нормальному ІМТ варіація становила 55,9% і 40,6% (р<0,001 і р=0,037 відповідно за критерієм F).
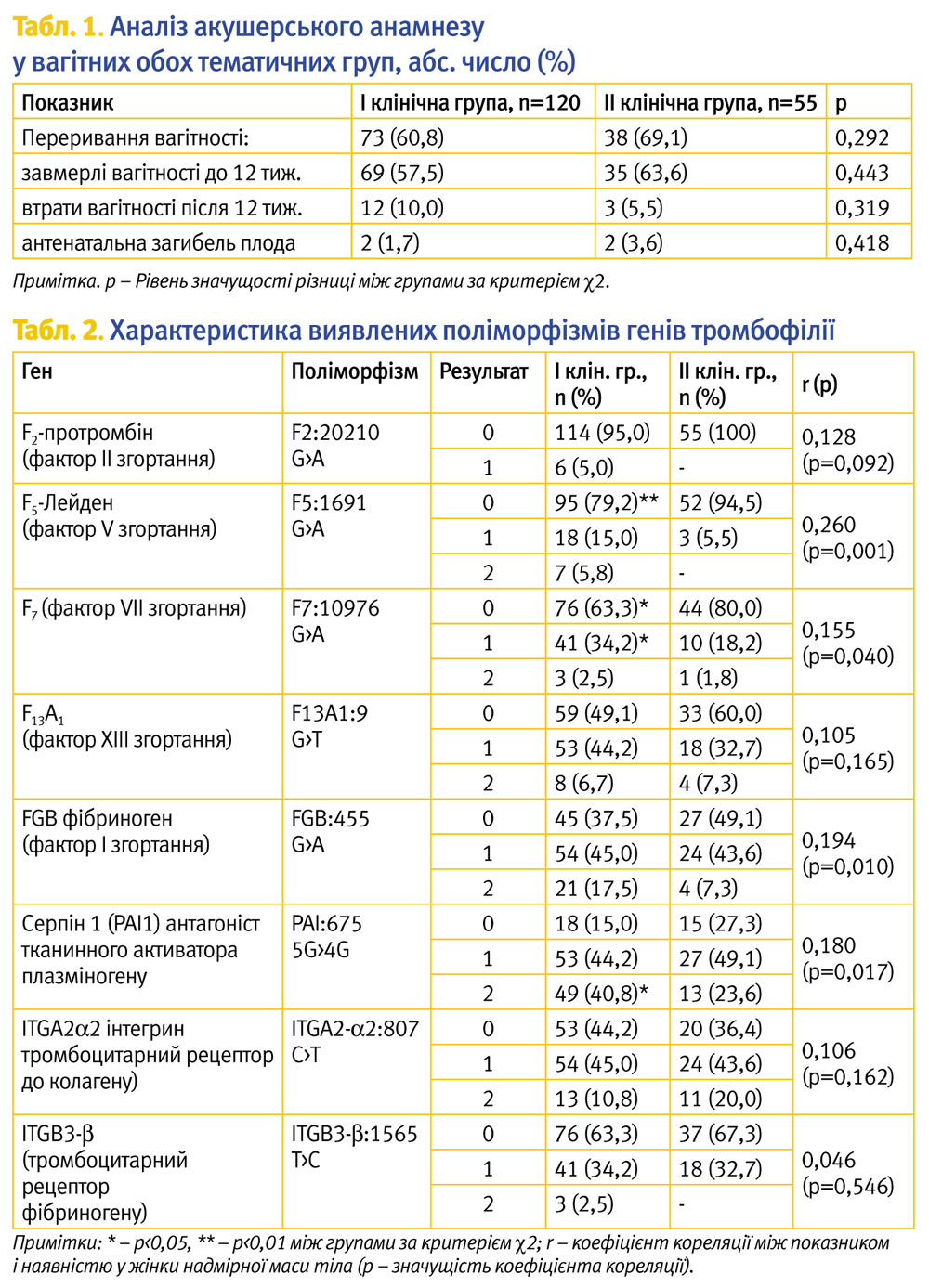
Вагітні обох тематичних груп під час госпіталізації до стаціонару скаржилися на ниючий біль унизу живота – 108 (90,0%) жінок основної групи та 53 (96,4%) групи порівняння (р=0,462 за критерієм c2); кров’янисті виділення зі статевих шляхів – 39 (32,5%) та 24 (43,6%) жінок відповідно (р=0,154 за критерієм c2); сполучення обох клінічних симптомів спостерігалося у 27 (22,5%) та 22 (40,0%) пацієнток обох клінічних груп відповідно (р=0,017 за критерієм c2). Вагітність настала самостійно за термін у середньому від 1 до 4 самостійних фертильних циклів без контрацепції у 97 (80,8%) жінок І групи та 48 (87,3%) – ІІ групи (р=0,294 за критерієм c2). У 23 (19,2%) жінок основної і в 7 (12,7%) пацієнток групи порівняння вагітність настала за допомогою допоміжних репродуктивних технологій (ДРТ). Проте лише в одному випадку у І клінічній групі і в двох – у ІІ групі використання ДРТ пояснювалося відсутністю прохідності маткових труб внаслідок перенесених запальних захворювань органів малого таза та наявністю спайкової хвороби як результату поширеного зовнішнього ендометріозу. В інших випадках трубний чинник неплідності, як і чоловічий, були виключені. Невдачі екстракорпорального запліднення (ЕКЗ) в анамнезі (напередодні вагітності, яку ми спостерігали) констатували у 7 (5,8%) та 3 (5,5%) жінок обох клінічних груп відповідно (р=0,920 за критерієм c2). Привертав увагу той факт, що у 111 (63,4%) жінок в анамнезі відзначалися випадки переривання вагітності (табл. 1). У тому числі завмерлі вагітності до 12 тиж мали 69 (57,5%) жінок основної групи і 35 (63,6%) пацієнток із групи порівняння (р=0,443 за критерієм c2); втрати вагітності після 12 тиж. – 12 (10,0%) і 3 (5,5%) вагітні відповідно (р=0,319 за критерієм c2). В однієї жінки ІІ клінічної групи констатовано в анамнезі народження дитини із недіагностованим напередодні пологів синдромом Дауна.
Результати дослідження поліморфізму генів тромбофілії наведені у табл. 2.
Продовження у наступному номері.
Перелік літератури знаходиться у редакції.

коментариев