Анемии часто встречаются в педиатрической практике. Также как и лихорадка, анемия – состояние, которое ВСЕГДА требует установления причины, приведшей к ее развитию. Причины анемий многообразны, они могут быть связаны как с различными заболеваниями системы крови (т. н. первичные анемии), так и являться следствием негематологических проблем (например, при хроническом воспалении, хронической почечной недостаточности, кровопотере и др.).
У нас принято всех детей с анемией направлять к гематологу. Конечно, при этом педиатр или врач общей практики страхует себя от диагностической или тактической ошибки, но с другой стороны, гематологу нередко приходится разбираться с сугубо «педиатрическими» проблемами – выявлять нарушения в питании ребенка, искать источники хронических кровопотерь, диагностировать синдром мальабсорбции, хронические заболевания почек и т. д.
Реалии сегодняшнего времени таковы, что диагностические и терапевтические полномочия врачей общей практики и педиатров становятся все шире. Многие вопросы дифференциальной диагностики анемий вполне возможно решить на уровне амбулатории. В данной статье мы хотели бы представить практический подход к оценке наиболее распространенных причин анемий у детей. Данный алгоритм (схема 1) несколько отличается от привычного нам поиска причин анемии в зависимости от уровня цветового показателя и степени регенерации (количества ретикулоцитов), он использует не слишком популярный у нас параметр – средний объем эритроцита, но, на наш взгляд, с практической точки зрения он весьма удобен.
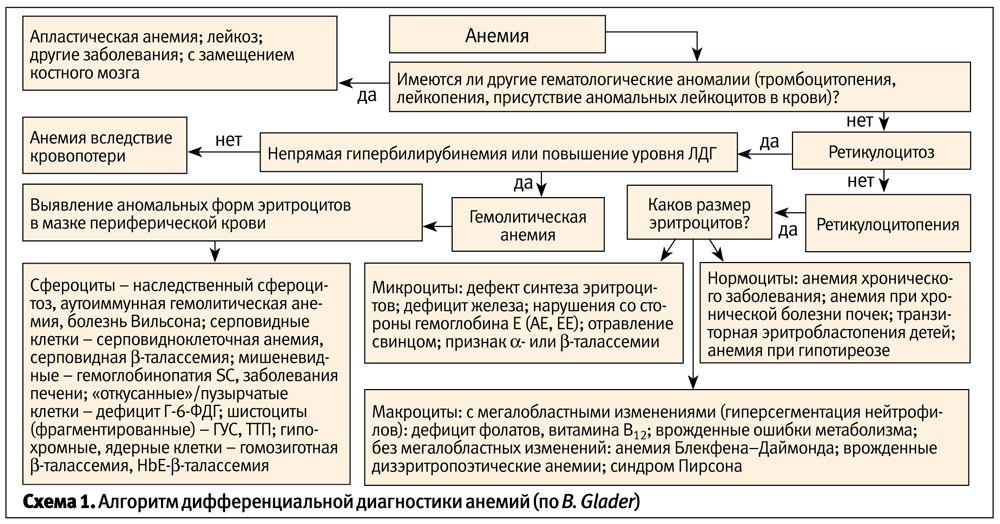
Итак, первый вопрос, который необходимо решить – имеет ли место анемия? Под анемией понимают снижение уровня гемоглобина и/или количества эритроцитов на 2 и более стандартных отклонения в сравнении с нормой для данного возраста. Нам более знакомо определение ВОЗ, согласно которому анемия диагностируется при уровне гемоглобина менее 110 г/л у детей младше 5 лет и менее 120 г/л у детей старше 5 лет. Безусловно, пользоваться вторым определением проще, но следует помнить, что под определение анемии ВОЗ не попадают дети младше 3 месяцев.
Как известно, нормальный диапазон колебаний уровня гемоглобина у новорожденного ребенка составляет 130–201 г/л (среднее значение – 168 г/л), в две недели жизни — 130–200 г/л (среднее – 165 г/л), а в три месяца — 95–145 г/л (среднее – 120 г/л). Поэтому у ребенка первой недели жизни анемия диагностируется при уровне гемоглобина ниже 140 г/л, у новорожденного третьей недели жизни – при уровне гемоглобина менее 120 г/л, а выявление у здорового доношенного ребенка в возрасте 8–12 недель уровня гемоглобина в пределах 90–110 г/л расценивается как физиологическое переходное состояние, не требующее медикаментозной и/или диетической коррекции.
Клинические проявления при анемии зависят от степени и скорости снижения уровня гемоглобина. Чаще всего снижение происходит постепенно, и основные клинические проявления появляются лишь тогда, когда его уровень опускается до 70–80 г/л. Основной клинический симптом – бледность кожи и слизистых оболочек. Различия в естественном цвете кожи у разных детей могут затруднять диагностику анемии. Для родителей и ближайшего окружения постепенное нарастание бледности кожных покровов ребенка часто остается незамеченным.
Для выявления бледности лучше всего оценивать цвет ладоней, ногтевых лож, конъюнктив, десен. Оценка цвета ладоней – очень удобный скрининговый тест на анемию, который обязательно должен проводиться при физикальном обследовании детей любого возраста, независимо от наличия жалоб и причины обращения.
Даже значительное (до 50–60 г/л) снижение уровня гемоглобина может хорошо переноситься детьми. Иногда при этом может отмечаться некоторая утомляемость, небольшая одышка. Чаще же симптомы, выявляемые у пациентов с анемией, связаны с тем заболеванием или состоянием, которое привело к ее развитию. Однако, при нарастании тяжести анемии, независимо от ее этиологии, появляется тахикардия, дилатация полостей сердца и застойная сердечная недостаточность.
При выявлении анемии у ребенка в первую очередь необходимо выяснить, связана ли анемия с другими гематологическими аномалиями. Сочетание анемии с тромбоцитопенией, лейкопенией или лейкоцитозом с присутствием в крови аномальных форм лейкоцитов может указывать на наличие лейкемии, апластической анемии или других заболеваний, при которых происходит замещение костного мозга опухолями, фиброзом или гранулемами. Тщательного сбора анамнеза, внимательного физикального обследования и анализа динамики гемограмм обычно достаточно, чтобы заподозрить эти заболевания и незамедлительно направить ребенка к гематологу.
Среди злокачественных заболеваний крови в детском возрасте чаще всего выявляется острый лейкоз. Для него характерно наличие общих симптомов (лихорадка, снижение аппетита, повышенная потливость, потеря массы тела), пролиферативный синдром (увеличение печени и селезенки, генерализованная или регионарная лимфаденопатия, боли в костях, болезненность при пальпации костей, лейкемиды), геморрагический синдром (пурпура, носовые кровотечения), инфекционный синдром.
Хронический миелолейкоз, хоть и редко, но также может протекать с хронической анемией. В развернутой фазе заболевания отмечается наличие интоксикационного синдрома, спленомегалии, высокого нейтрофильного лейкоцитоза со значительным сдвигом формулы влево.
К опухолям, которые могут метастазировать в костный мозг, относятся лимфогранулематоз и неходжкинские лимфомы, нейробластома, рабдомиосаркома и первичные опухоли костей.
Замещение костного мозга фиброзной тканью имеет место при миелофиброзе с миелоидной метаплазией – патологии, которая редко встречается в детском возрасте.
Обнаружение гранулем в костном мозге у новорожденных может быть связано с TORCH-инфекциями, а в более старшем возрасте – с туберкулезом.
Кроме того, панцитопении могут быть обусловлены наличием наследственных генетических дефектов. Наиболее частый вариант врожденной апластической анемии (врожденной панцитопении) – анемия Фанкони. Это заболевание характеризуется низкорослостью, наличием скелетных аномалий (микроцефалия, отсутствие или гипоплазия больших пальцев), аномалий развития внутренних органов, а также гиперпигментации кожи и пятен цвета «кофе с молоком». Отличительный признак анемии Фанкони – спонтанные или кластогениндуцированные разрывы хромосом. В случае отсутствия характерных фенотипических признаков у пациентов с врожденной апластической анемией и цитогенетическими аномалиями анемии Фанкони (14–25% случаев) устанавливают диагноз анемии Эстрена–Дамешека.
Врожденная панцитопения характерна также для врожденного дискератоза (гиперпигментация кожи, дистрофия ногтей, лейкоплакия, блефарит, катаракта), синдрома Швахмана–Даймонда, амегакариоцитарной тромбоцитопении.
Гематологические признаки врожденных панцитопений могут не проявляться в первые годы жизни и даже в первые десятилетия жизни. Нередко вначале определяется угнетение одной из клеточных линий (анемия, тромбоцитопения или лейкопения), а позднее развивается панцитопения. Поэтому диагноз анемии Фанкони может быть установлен при наличии характерных аномалий скелета и кожи в сочетании с низкорослостью даже при отсутствии гематологических признаков. И наоборот, если у ребенка выявляется явное снижение функции костного мозга (угнетение всех или нескольких ростков кроветворения), следует определить, не является ли это результатом генетических дефектов. Для этого применяются цитогенетические исследования, в том числе исследование хромосом на разрывы.
Кроме того, при анемии Фанкони и врожденном дискератозе нередко наблюдается макроцитоз, небольшой анизо- и пойкилоцитоз; в отличие от приобретенных аплазий в эритроцитах повышен уровень фетального гемоглобина (HbF) и і-антигена. У пациентов с врожденными апластическими анемиями повышен риск развития лейкоза и других видов рака.
Приобретенная апластическая анемия (панцитопения) может быть вызвана самыми различными воздействиями на костный мозг (табл. 1), поэтому тщательный сбор анамнеза очень важен.

Многие лекарственные препараты способны вызвать тяжелую апластическую анемию. Кроме указанных в таблице, это (в более редких случаях) могут быть антибиотики, нестероидные противовоспалительные препараты, антигистаминные, седативные средства, инсектициды, металлы. Длительное угнетение активности костного мозга может развиваться при вирусных гепатитах, инфекции ВЭБ, ЦМВ, герпес-вирусах, ВИЧ. Парвовирус В19 обычно вызывает парциальную красноклеточную аплазию, но у пациентов с иммунодефицитами и серповидноклеточной анемией может также приводить к развитию транзиторной панцитопении.
Приобретенная апластическая анемия характеризуется панцитопенией при повышенном уровне цитокинов в периферической крови в сочетании с гипоплазией или аплазией костного мозга. Клиническая картина напоминает таковую при лейкозе (анемия, геморрагический синдром, инфекционные осложнения), но отсутствуют признаки пролиферативного синдрома.
Критерии диагностики тяжелой апластической анемии включают: уменьшение клеточности костного мозга (менее 35%) в сочетании со снижением содержания в крови двух или более ее клеточных компонентов (после коррекции гематокрита уровень нейтрофилов менее 0,5 Г/л, тромбоцитов – менее 20 Г/л, ретикулоцитов – менее 1%). У всех пациентов с апластической анемией следует рассмотреть вероятность врожденной апластической анемии (анализ на разрывы хромосом для исключения анемии Фанкони). Повышение уровня HbF, хоть и характерно для врожденных панцитопений, но само по себе не является диагностически значимым.
Если анемия у ребенка не сопровождается другими гематологическими аномалиями, следующим этапом диагностики является оценка уровня ретикулоцитов. При этом важно помнить, что в норме у ребенка старше одного месяца количество ретикулоцитов составляет примерно 1% от общего количества эритроцитов, т. е. приблизительно 40 Г/л. При оценке пациентов с анемией количество ретикулоцитов должно соотноситься с количеством эритроцитов или уровнем гемоглобина. Так, например, обнаружение 2–3% ретикулоцитов у ребенка со сниженным на 1/3–1/2 уровнем гемоглобина нельзя рассматривать как ретикулоцитоз. Некоторые клиницисты предпочитают ориентироваться на абсолютное количество ретикулоцитов или пользоваться корригированным показателем содержания ретикулоцитов, который можно рассчитать по формуле:
В обычных условиях при анемии уровень ретикулоцитов и эритропоэтина в периферической крови повышается. Отсутствие или снижение ретикулоцитарной реакции при анемии указывает на относительную недостаточность костного мозга.
Если анемия сопровождается ретикулоцитозом, то ее причинами могут быть кровопотеря или гемолиз. Кроме того, кратковременно ретикулоцитоз может наблюдаться при заместительной терапии железо-, В12- или фолиеводефицитной анемии.
При анемии, развившейся вследствие кровопотери, ретикулоцитоз не сопровождается повышением уровня непрямого билирубина и/или ЛДГ. Потеря крови может осуществляться через:
- желудочно-кишечный тракт – обычно в визуально нераспознаваемых количествах (эрозивно-язвенные процессы, полипы, дивертикулы, нематодные инвазии и др.);
- легкие – например, при идиопатическом легочном гемосидерозе;
- почки – при пароксизмальной ночной гемоглобинурии;
- при обильных менструациях вследствие коагулопатии, тромбоцитопении или из-за дисменореи.
Причиной анемии с ретикулоцитозом и повышением уровня непрямого билирубина и/или ЛДГ в крови является гемолиз. При гемолизе имеет место укорочение времени жизни эритроцитов, вследствие этого повышается активность костного мозга, что, в свою очередь, сопровождается повышенным поступлением в кровоток ретикулоцитов. Повышение активности костного мозга проявляется эритроидной гиперплазией, которая при хроническом гемолизе, особенно при талассемии, может быть настолько выраженной, что приводит к изменению структуры костей – расширению медуллярного пространства. Эти изменения выявляются при физикальном обследовании и рентгенографии черепа и длинных трубчатых костей.
Повышенный распад гемоглобина приводит к повышению в крови уровня непрямого билирубина, свободного гемоглобина, снижению уровня гаптоглобина, а в моче и кале увеличивается содержание уробилиногена. В большинстве случаев у пациентов с хроническим гемолизом определяется спленомегалия. Повышенная экскреция билирубина с желчью нередко приводит к раннему образованию билирубиновых (пигментных) камней в желчном пузыре.
Гемолитические анемии могут быть врожденными и приобретенными, связанными с дефектами эритроцитов или внутрисосудистыми факторами (табл. 2).
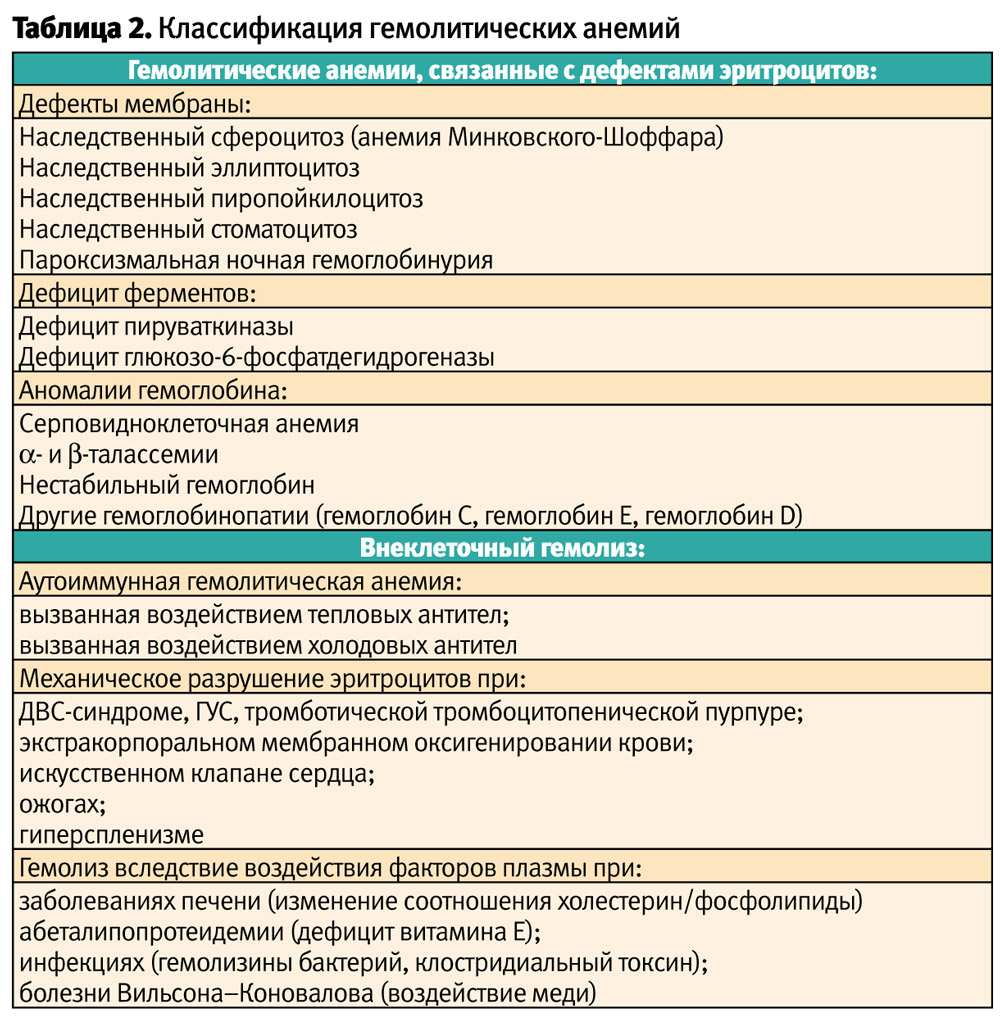
При сборе анамнеза у пациентов с гемолитической анемией большое значение имеет семейный анамнез, этническая принадлежность, пол.
Так, дефицит Г-6-ФДГ распространен среди жителей Средиземноморья, Ближнего Востока и Юго-Восточной Азии. Гемоглобин S-синдромы (серповидноклеточная анемия) часто отмечаются в популяциях центральноафриканского происхождения, гемоглобин C-синдромы – у выходцев из Западной Африки, гемоглобин D-синдромы характерны для жителей северной Индии, гемоглобин E-синдромы – для населения Юго-Восточной Азии; β-талассемии чаще встречаются среди жителей Средиземноморья, Ближнего Востока, Индии, Африки, в то время как a-талассемии более характерны для жителей Юго-Восточной Азии.
Дефицит Г-6-ФДГ чаще встречается у мальчиков, а аутоиммунная гемолитическая анемия – у девочек.
Указания на затяжную гемолитическую желтуху в периоде новорожденности может быть ключом для диагноза наследственного сфероцитоза или дефицита Г-6-ФДГ.
Для наследственного сфероцитоза также характерно наличие у ближайших родственников больного камней в желчном пузыре, ранней холецистэктомии и спленэктомии.
Гемолиз эритроцитов при дефиците Г-6-ФДГ провоцируется инфекциями, определенными лекарственными средствами (сульфаниламиды, хлорамфеникол, нитрофурантоин, противомалярийные препараты, ацетилсалициловая кислота, фенацетин, аналоги витамина К, метиленовый синий) и химическими веществами (нафталин, бензол, фенилгидразин), являющимися окислителями.
При объективном обследовании следует обратить внимание на наличие иктеричности склер, кожи и слизистых, спленомегалии. Экстрамедуллярный гемопоэз вследствие хронического гемолиза при большой β-талассемии или серповидноклеточной анемии может привести к лицевой дизморфии с выступающими скулами и высоким лбом.
Среди лабораторных тестов существенное значение для дифференциальной диагностики гемолитических анемий имеет исследование морфологии эритроцитов в мазке периферической крови. Примерами аномальной морфологии эритроцитов могут служить:
- сфероциты (имея меньший диаметр, они кажутся гиперхромными, центральное вдавление не так заметно, как у нормальных эритроцитов, встречаются при наследственном сфероцитозе, аутоиммунной гемолитической анемии, гемолитической болезни новорожденных вследствие АВО-конфликта);
- «откусанные» эритроциты / пузырчатые эритроциты (патогномоничны для дефицита Г-6-ФДГ);
- мишеневидные эритроциты (характерны для гемоглобинопатий C, а также отмечены у пациентов с железодефицитной анемией, талассемиями, серповидноклеточной анемией и заболеваниями печени);
- серповидные эритроциты / дрепаноциты (встречаются при серповидноклеточной анемии);
- шистоциты или фрагментированные клетки (характерны для микроангиопатической гемолитической анемии (ГУС, ТТП, ДВС);
- эритроциты с базофильной пунктацией (выявляют при всех состояниях с ретикулоцитозом, а также при отравлениях свинцом и дефиците 5'-нуклеотидазы).
Следует отметить, что нормальная морфология эритроцитов не исключает наличия гемолиза.
Лабораторным подтверждением наличия гемолиза является непрямая гипербилирубинемия, повышение в крови уровня ЛДГ, свободного гемоглобина, снижение концентрации сывороточного гаптоглобина, а также гемоглобинурия и повышение уровня уробилиногена в моче.
При подозрении на аутоиммунную гемолитическую анемию проводится прямой тест Кумбса, позволяющий выявить антитела, фиксированные на мембране эритроцитов. Непрямой тест Кумбса выявляет свободно циркулирующие антиэритроцитарные антитела.
Для гемолиза, обусловленного тепловыми аутоантителами, характерно обнаружение сфероцитоза, положительные прямой и непрямой тесты Кумбса на тепловые антиэритроцитарные антитела класса IgG. Обязательно проведение тестов на основное заболевание, вызвавшее гемолиз (табл. 3).

Если гемолиз вызван холодовыми аутоантителами, в мазке крови обнаруживается агглютинация эритроцитов или «монетные столбики», прямой тест Кумбса выявляет фиксированный на эритроцитах C3b-комплемент (некоторое количество C3b-комплемента на эритроцитах может определяться и при гемолизе, вызванном тепловыми антителами); показано серологическое обследование на инфекцию Mycoplasma pneumoniae, ВЭБ-инфекцию, определение титра холодовых антител (антитела класса IgМ к І/і-антигенам эритроцитов), диагностика основного заболевания.
Снижение осмотической стойкости эритроцитов характерно для наследственного сфероцитоза. Для диагностики гемоглобинопатий проводят электрофорез гемоглобина (различные виды гемоглобина обладают разной электрофоретической подвижностью).
Дефицит ферментов эритроцитов выявляют по снижению их концентрации в красных кровяных клетках.
Окончание в следующем номере


коментарів