На сьогодні вивчення вітаміну D (VD, 25 (OH) D) становить великий науковий інтерес, оскільки багатьма вченими встановлено, що окрім регуляції фосфорно-кальцієвого обміну та кісткового метаболізму, VD здійснює модулюючий вплив на більшість органів і систем організму за рахунок реалізації геномних та негеномних механізмів. Величезна кількість наукових досліджень свідчать про асоціацію рівня забезпеченості VD з розвитком, частотою і тяжкістю перебігу інфекційних, хронічних запальних, алергічних, аутоімунних, серцево-судинних і різних неопластичних захворювань.
Незважаючи на те, що в останні десятиріччя значно розширились уявлення про позаскелетні ефекти VD і його вплив на перебіг багатьох захворювань, актуальним залишається питання профілактики і корекції дефіциту VD серед дитячого населення.
Історично склалося, що недостатність VD пов'язували лише з захворюваннями кістково-м’язової системи, включаючи рахіт, остеопороз, остеомаляцію, переломи, проте біологічна роль VD не обмежується лише регуляцією кісткового метаболізму [1, 2]. Так, ще у 1903 році доктор Niels Ryberg Finsen отримав одну з найперших Нобелівських премій в області фізіології та медицини за відкриття позитивних впливів сонячного випромінювання на перебіг шкірного туберкульозу [3], однак все ж таки глобальне вивчення позаскелетних ефектів VD розпочалося набагато пізніше, коли у 1975 році вчені встановили, що ризик виникнення пневмонії у дитини з рахітом в 13 разів вище, ніж за його відсутності [4].
Внаслідок двоступеневої метаболізації в організмі людини VD перетворюється на якісно та кількісно значущий високоактивний метаболіт – 1,25-дигідроксивітамін D (1,25(OH)2D), так званий D-гормон (кальцитріол) (рис. 1).
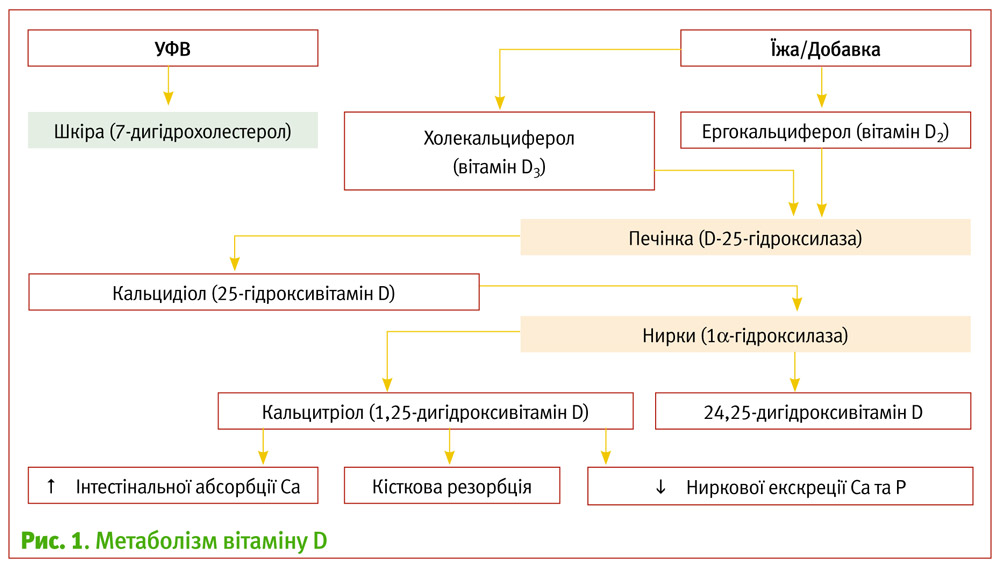
Встановлено, що утворення кальцитріолу відбувається не тільки у клітинах проксимальних відділів канальців коркового шару нирок, але й в кістковій і хрящовій тканинах, клітинах шкіри, нервової системи, плаценти, селезінки, лімфатичних вузлів, скелетних м’язів, печінки, моноцитах, макрофагах, стовбурових клітинах, слизових оболонках легень та товстого кишечнику, паращитовидних залозах [5]. Молекулярний механізм дії кальцитріолу полягає у взаємодії з рецепторами вітаміну D (VDR) [6], які представлені щонайменше у 40 органах і тканинах [7, 8, 9] (табл. 1).


VD відіграє важливу роль в регуляції імунної, серцево-судинної, репродуктивної систем, вуглеводного обміну, а також гальмує проліферацію кератиноцитів шкіри та активує їх диференціювання, інгібує ангіогенез, активує апоптоз в тканинах, що лежить в основі протипухлинного ефекту, стимулює синтез інсуліну, пригнічує секрецію реніну та підвищує синтез кателіцидину в макрофагах [11, 12, 13].
З огляду на плейотропні ефекти VD, недостатній рівень його забезпечення в організмі може впливати на перебіг багатьох захворювань, а не тільки на розвиток рахіту, як вважається. Згідно з результатами останніх популяційних досліджень, поширеність гіповітамінозу D серед дитячого населення варіює від 29 до 100% у залежності від географічного місцезнаходження, сезонності, етнічної приналежності [14, 15]. За даними Л. В. Квашніної та співавт. (2015), тільки у 9,4% здорових дітей від народження до 17 років спостерігається «бажаний» стан забезпеченості VD [16], однак все ж таки масштабні дослідження щодо вивчення статусу вітаміну D серед дитячого населення в Україні досі не проводились.
До загальних факторів, що визначають рівень забезпеченості VD, можна віднести географічні чинники (широта, сезон року, час доби, тінь, забрудненість повітря), використання сонцезахисних засобів, інтенсивність пігментації шкіри, материнський статус вітаміну D, рівень споживання збагачених вітаміном продуктів, нутритивний статус, наявність супутніх захворювань, поліморфізм генів, що кодують рецептори VD [17, 18, 19].
Нещодавнє дослідження статусу вітаміна D у дітей шкільного віку (5–11 років), які проживають на території Кувейту, показало, що найбільш значимими чинниками ризику дефіциту VD були вік дітей £8,5 років, жіноча стать, надмірна маса тіла або ожиріння [20].
Збільшення кількості осіб з надлишковою масою тіла призводить до підвищення поширеності дефіциту VD, що пов'язують з його депонуванням у підшкірно-жировій клітковині та недоступністю для центрального кровотоку [21].
На думку В. Г. Майданника (2015), найбільш значущими причинними факторами, які обумовлюють широку розповсюдженість дефіциту VD серед дітей, які проживають на території України, є відсутність достатньої інсоляції та незбалансоване харчування [4]. Відомо, що саме VD, який утворюється в шкірі під впливом ультрафіолетових променів сонячного світла, забезпечує 80–90% добової потреби у цьому вітаміні, при цьому найкращий час для його синтезу – між 10:00 та 15:00 годинами дня [18, 19].
У сучасному світі суттєво зменшився прямий вплив сонячних променів завдяки як широкому застосуванню дитячих сонцезахисних кремів, так і через проведення більшої частини часу в приміщенні. Так, застосування сонцезахисних засобів із фактором захисту SPF 8 і вище зменшує синтез VD в шкірі на 95–98% [22].
Як відомо, їжа не є основним джерелом VD, оскільки, по-перше, найбільша кількість вітаміну міститься у жирній рибі (лосось, тунець, скумбрія, тріска), що відсутня у щоденному раціоні у дітей, а по-друге, фортифікація продуктів харчування VD не має широкого застосування в Україні, на відміну від розвинених країн світу, в яких молоко, сир, деякі йогурти, більшість круп, апельсиновий сік, соєве та рисове молоко, маргарин, готові сніданки зі злакових збагачені невеликою кількістю даного вітаміну.
У табл. 2 наведені групи ризику щодо розвитку дефіциту VD.
Слід звернути особливу увагу на те, що при прийомі певних лікарських препаратів, які здатні впливати на метаболізм 25(OH)D у сироватці крові, можливий розвиток медикаментозно-індукованого дефіциту VD. Серед них протиепілептичні препарати (фенітоїн, карбамазепін, фенобарбітал, прімідон), антиретровірусні препарати (інгібітори протеази).
Rutstein R. та співавт. (2011) показали, що дефіцит VD у дітей з ВІЧ-інфекцією, які перебували на ВААРТ, зустрічався у два рази частіше порівняно з контрольною групою (36% і 15% відповідно). Інші групи препаратів, які можуть впливати на абсорбцію, метаболізм та активацію VD, включають глюкокортикоїди, азолові протигрибкові препарати, цитохром P450 3A4 індуктори [19]. Отже, регулярний моніторинг концентрації 25(OH)D в сироватці крові у дітей, які отримують вищевказані групи препаратів, може бути виправданим, хоча загальноприйнятих рекомендацій щодо подібного скринінгу в Україні досі немає.
Дискусії щодо оптимального рівня 25(OH)D у сироватці крові велися декілька років. Згідно з сучасними рекомендаціями, достатнім рівнем VD слід вважати показник 25(OH) D у сироватці крові понад 30 нг/мл (75 нмоль/л). Рівень 25(OH)D у сироватці крові від 21 до 29 нг/мл (50,1–74,9 нмоль/л) слід розглядати як недостатність VD. Концентрація 25(OH)D у сироватці крові нижче 20 нг/мл або 50 нмоль/л визначається як дефіцит вітаміну D [2].
З метою досягнення оптимального рівня забезпеченості VD у дітей всіх вікових груп найбільш доцільним є щоденний профілактичний прийом VD, особливо у зимово-весняний період, коли синтез даного вітаміну природньо знижений.
На сьогодні немає чітких стандартів або єдиних методичних рекомендацій щодо профілактики або корекції вже існуючого дефіциту VD. Відповідно до діючих рекомендацій, призначення VD новонародженим повинно починатися з другого місяця життя у дозі 500 МО/добу протягом 3-х років (згідно з Протоколом лікування та профілактики рахіту у дітей, затвердженим наказом МОЗ України від 10.01.05 №9).
Дітям та підліткам від 1 до 18 років рекомендовано призначення VD у дозі 600–1000 МО/добу залежно від маси тіла з вересня по квітень [23]. Слід зауважити, що на практиці більшість дітей старше одного року не отримують VD у профілактичній дозі, оскільки багато педіатрів і сімейних лікарів впевнені у відсутності потреби даного вітаміну після року, прийом якого помилково пов’язують тільки з профілактикою рахіту.
Згідно з рекомендаціями Американської асоціації ендокринологів (2011), добова доза VD для здорових дітей від новонародженості до 12 місяців становить 400 МО/добу та від 1 до 18 років – 600 МО/добу.
Водночас, провідний експерт у світі з вивчення VD Michael Holick зазначає, що верхня допустима границя профілактичної дози даного вітаміну складає 2000 МО/добу у дітей до трьох років і 4000 МО/добу у дітей від 3 до 18 років, при цьому гіпервітаміноз D не розвивається. Американська академія педіатрії рекомендує жінкам під час грудного вигодовування дитини приймати високі дози VD (4000–6400 МО), які не мають токсичного впливу на організм, при цьому вміст VD в грудному молоці підвищується до 873 МО/л [24], адже в материнському молоці міститься близько 25–78 МО/л VD, що не може повністю задовольнити добову потребу дитини у даному вітаміні.
Добова доза VD для груп ризику з розвитку його дефіциту має бути 400–800 МО для недоношених та 1200–2000 МО для дітей та підлітків з ожирінням [23].
Таким чином, вітамін D відіграє важливу роль не тільки в підтримані кальцієво-фосфорного гомеостазу, але й впливає на функціонування багатьох органів і систем. З огляду на те, що рівень забезпеченості VD серед дитячої популяції в сучасних умовах набуває масштабів пандемії, профілактика гіповітамінозу D має бути одним із пріоритетних напрямків сучасної педіатрії.
Повний перелік літератури знаходиться у редакції.


коментарів