Микоплазменные и хламидийные пневмонии относятся к так называемым «атипичным» пневмониям. Термин был предложен в 1938 г. H. A. Reimann для обозначения случаев нетяжелого заболевания нижних дыхательных путей, характеризующихся наличием сухого кашля, затрудненного дыхания/одышки, осиплости голоса, цианоза, заторможенности, профузной потливости, диффузной мелкоочаговой пневмонической инфильтрации, плохо поддающихся лечению пенициллином и сульфаниламидными препаратами. В 40-е годы был выделен возбудитель пневмонии, описанной H. A. Reimann, – агент Итона (Eaton agent). Сначала предполагалось, что агент Итона – вирус, но позднее его удалось вырастить на агаре, и в 1962 г. он получил свое современное таксономическое название – Mycoplasma pneumoniae.
В дальнейшем было отмечено, что пневмония, вызванная Legionella pneumophila (описана в 1976 г.) и хламидийная пневмония (описана в 1986 г.) клинически и рентгенологически во многом похожи на пневмонию микоплазменной этиологии. Так появилась концепция «синдромного» подхода к диагностике пневмоний, в основе которого – разделение пневмоний на типичные и «атипичные» с целью определения рациональной эмпирической антибиотикотерапии (табл. 1).
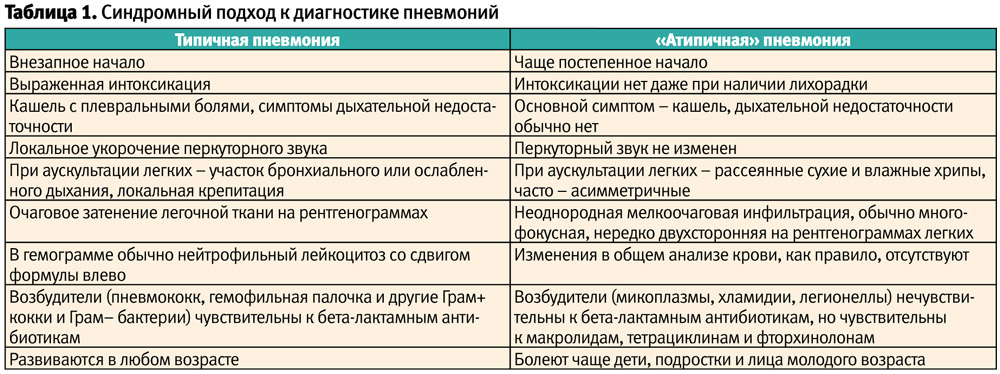
Со временем список возбудителей «атипичной» пневмонии существенно расширился, а также стало понятно, что клиническое течение пневмонии определяется не только характером возбудителя, но также и другими факторами (возраст, наличие сопутствующей патологии, иммунокомпроментированность и др.). В связи с этим целесообразность разделения пневмоний на типичные и «атипичные» все чаще стала подвергаться сомнению, и в настоящее время «атипичными» принято называть не пневмонии, а их возбудителей. При этом к «атипичным» возбудителям пневмонии относят лишь M. pneumoniae, C. pneumoniae и Legionella spp., с учетом схожести клинической симптоматики вызываемых ими легочных инфекций, общих подходов к диагностике и этиотропной терапии.
Как уже указывалось, пневмонии, вызванные «атипичными» возбудителями, у детей и молодых людей до 40 лет встречаются довольно часто. Поэтому именно в этой возрастной группе описанный выше «синдромный» подход к диагностике пневмоний сохраняет свою актуальность, несмотря на определенную степень его условности. Поскольку до сих пор не существует надежных лабораторных методов, позволяющих в ранние сроки заболевания подтвердить роль «атипичного» возбудителя в развитии пневмонии, диагностика таких инфекций основывается только на клинико-рентгенологических и эпидемиологических данных. А значит, от умения врача анализировать и интерпретировать эти данные зависит адекватность выбора антибактериальной терапии.
Так как легионеллезная инфекция встречается в детском возрасте очень редко, в данной статье мы рассмотрим подходы к диагностике и лечению только микоплазменных и хламидийных пневмоний.
Микоплазменная пневмония
Микоплазмы – наименьшие из свободно живущих форм жизни (150–250 нм). От других прокариотических бактерий микоплазмы отличаются отсутствием плотной бактериальной стенки, что обуславливает разнообразие их форм (отсюда и название – изменчивость форм микоплазм схожа с таковой у грибков) и устойчивость к бета-лактамным антибиотикам.
Микоплазмы обладают двухцепочечной ДНК, объем генома – наименьший среди прокариот. Вследствие своих ограниченных биосинтетических возможностей микоплазмы очень требовательны к условиям культивирования. На обычно используемых средах они растут медленно, что делает культуральный метод диагностики микоплазменной инфекции непригодным для клинической практики.
В макроорганизме микоплазмы паразитируют, прикрепляясь к мембранам эукариотических клеток и получая из них необходимые для существования вещества. Мембранное паразитирование микоплазм обеспечивает им возможность длительной персистенции в организме.
Из 14 видов микоплазм, когда-либо обнаруженных у человека, респираторную инфекцию может вызвать лишь М. pneumoniae. Адгезия М. pneumoniae к мембране реснитчатого эпителия дыхательных путей – сложный многоступенчатый процесс, в котором задействуются специальные белки. Штаммы М. pneumoniae, в результате спонтанных мутаций утрачивающие способность к синтезу белков адгезии, являются авирулентными.
После прикрепления микоплазмы к клеточной мембране двигательная активность ресничек эпителиальной клетки прекращается, и позднее пораженные эпителиоциты слущиваются. Микоплазмы обладают как прямым цитотоксическим действием на эпителий – вследствие способности к продукции перекиси водорода, так и опосредованным, являющимся результатом иммунных реакций макроорганизма.
Рецепторы на поверхности эпителиальных клеток, к которым прикрепляются микоплазмы, представляют собой длинноцепочечные сиалоолигосахариды, содержащие в своей структуре антиген I (тот же, что и в эритроцитах). Полагают, что при микоплазменной инфекции иммуногенность сиалоолигосахаридов может повышаться, и это приводит к выработке холодовых агглютининов (аутоантител класса IgM, вызывающих агглютинацию эритроцитов при температуре ниже 37°).
В большинстве случаев инфекция М. pneumoniae ограничивается дыхательными путями, однако иногда наблюдаются и эктрапульмональные проявления. Патогенез внелегочных осложнений неизвестен, но предполагается, что в его основе лежат иммунные механизмы. Системное распространение бактерии встречается очень редко.
Эпидемиология. Инфекции, вызванные М. pneumoniae, распространены повсеместно. По различным данным, от 10 до 40% пневмоний у детей и людей молодого возраста имеют микоплазменную этиологию.
Наиболее часто М. pneumoniae-инфекции нижних дыхательных путей встречаются у детей дошкольного, школьного возраста и подростков с пиком частоты в возрасте 5–9 лет. У детей младше 3 лет инфекция М. pneumoniae ограничивается поражением верхних дыхательных путей, а среди детей первого года жизни практически не встречается. Однако у новорождённых М. pneumoniae может вызвать серьезные респираторные нарушения и тяжелые внелегочные осложнения. Половых различий в частоте инфекций, вызванных М. pneumoniae, не наблюдается. Также отсутствует и сезонность.
Клинические проявления. В большинстве случаев инфекция затрагивает лишь верхние дыхательные пути и протекает с фарингитом, кашлем, головной болью, ознобами и миалгиями. Насморк и увеличение шейных лимфоузлов не характерны.
У 5–10% пациентов инфекция М. pneumoniae прогрессирует с развитием трахеобронхита или пневмонии. Основным симптомом заболевания является кашель, который обычно нарастает в первые 2 недели заболевания, а в течение последующих 3–4 недель уменьшается. Кашель часто сухой, хотя у пациентов старшего возраста и подростков может отходить белая пенистая мокрота. Нередко кашель становится навязчивым и истощающим. Боли в грудной клетке у пациентов с микоплазменной пневмонией, если и встречаются, то связаны с напряжением мышц при кашле. Физикальные изменения в легких могут появляться не сразу. Наиболее заметные из них – сухие свистящие и влажные мелкопузырчатые хрипы, похожие на хрипы при бронхиальной астме и бронхиолите, чаще всего асимметричные. Характерной является диссоциация между аускультативной картиной и самочувствием больных. Как правило, общее состояние не нарушено, одышки и симптомов интоксикации нет, и кашель – это единственное, что беспокоит пациента. Поэтому микоплазменную пневмонию часто называют «пневмонией на ногах». Воспаление барабанной перепонки – буллезный мирингит – классическое, но редкое осложнение микоплазменной инфекции.
Характерными рентгенологическими признаками микоплазменной пневмонии являются: двустороннее усиление легочного рисунка, многофокусная или диффузная мелкоочаговая сетчатая инфильтрация. У небольшой части больных (по разным данным – от 5 до 20%) может определяться плевральный выпот. Даже при своевременной и адекватной антибактериальной терапии рентгенологические изменения регрессируют медленно и могут выявляться спустя несколько недель после клинического выздоровления.
Инфекция М. pneumoniae является самолимитирующей. При отсутствии лечения пациенты выздоравливают, хотя явления постинфекционного бронхита могут сохраняться долго, в течение многих недель.
У пациентов с врожденными дефектами гуморального иммунитета и серповидноклеточной анемией повышен риск тяжелого течения инфекции М. pneumoniae с развитием плеврита с массивным выпотом, а также дыхательной недостаточности. Также сообщалось о необычно тяжелом течении инфекции у детей с синдромом Дауна, особенно при наличии врожденных пороков сердца.
В настоящее время доказана роль инфекции М. pneumoniae в патогенезе бронхиальной астмы: она способна как вызвать обострение астмы, так и быть фактором, провоцирующим первый эпизод заболевания.
Среди внелегочных осложнений инфекции М. pneumoniae чаще всего наблюдаются поражения кожи – 25%, реже – ЦНС (1–10%).
Сообщалось также о кардиальных, скелетно-мышечных, гематологических и желудочно-кишечных осложнениях (табл. 2).

Диагностика. Лабораторное подтверждение М. pneumoniae-инфекции целесообразно только в случае тяжелого течения заболевания и/или развития внелегочных осложнений.
Как уже указывалось, бактериологический метод диагностики имеет низкую практическую ценность из-за трудоемкости культивирования микоплазм и медленного их роста (7–14 суток и более).
Среди серологических методов диагностики наиболее доступным является тест на определение титра холодовых агглютининов, который может быть выполнен непосредственно у постели больного или в любой лаборатории. Повышенным считают титр агглютининов 1:32 и более. Однако данное исследование обладает низкой чувствительностью (50–90%) и невысокой специфичностью – около 75%.
«Золотым» стандартом диагностики микоплазменной инфекции является определение титра антимикоплазменных антител в парных сыворотках. Диагностически значимым является четрехкратное нарастание титра антител в сыворотках, взятых с интервалом 10–21 день (при использовании для выявления антител реакции связывания комплемента, чувствительность — 86–90%, специфичность — 87–94%). Тем не менее, этот тест не может быть полезным в определении диагностической и терапевтической тактики, так как о повышении титра антител можно будет судить лишь спустя три-четыре недели после начала заболевания. Кроме того, у иммунокомпрометированных пациентов и детей раннего возраста гуморальный ответ может быть сниженным.
Тест на определение антител к М. pneumoniae классов IgM и IgG методом ИФА имеет чувствительность 98%, а специфичность – более 99%, в случае, если получены оба результата. Но следует помнить, что IgM может отсутствовать в первые 7–10 дней заболевания и поэтому данный тест тоже не может помочь подтвердить микоплазменную этиологию в ранние сроки болезни.
Возможно также прямое обнаружение антигена М. pneumoniae в образцах мокроты, носоглоточном секрете и других средах с помощью ИФА или ПЦР. Эти методы обладают достаточно высокой чувствительностью, однако сами по себе не дают ответа на вопрос – имеет ли место активная инфекция, персистенция, носительство микоплазмы или просто контаминация материала.
Лечение. При микоплазменной инфекции верхних дыхательных путей антибактериальная терапия не показана. При инфекциях нижних дыхательных путей антибактериальная терапия назначается с целью сокращения длительности симптомов и возможного ограничения распространения возбудителя. В детском возрасте препаратами выбора для лечения микоплазменной пневмонии являются макролиды, у старших школьников и подростков альтернативными препаратами могут быть тетрациклины. Длительность лечения – 10 дней для кларитромицина и 5 дней для азитромицина.
Поскольку внелегочные осложнения чаще всего имеют аутоиммунную природу, в их лечении ведущее значение имеет назначение глюкокортикостероидов и внутривенного иммуноглобулина.
Хламидийная пневмония
Хламидии – мелкие грамотрицательные микроорганизмы, являющиеся облигатными внутриклеточными паразитами. Все три патогенные для человека разновидности хламидий способны вызвать пневмонию:
- Chlamydophila (ранее Chlamydia) pneumoniae – вызывает 10–20% внебольничных пневмоний у детей и лиц молодого возраста;
- Chlamydophila (ранее Chlamydia) psittaci – возбудитель орнитоза (пситтакоза), основным проявлением которого является поражение легких;
- Chlamydia trachomatis – возбудитель трахомы, урогенитального хламидиоза и венерической лимфогранулемы – может вызвать пневмонию у интранатально инфицированных новорожденных.
Хламидии не могут размножаться вне клеток макрорганизма, поэтому их невозможно вырастить на питательных средах. Как и другие грамотрицательные бактерии, хламидии имеют цитоплазматическую мембрану и клеточную стенку. В макроорганизме хламидии существуют в виде двух форм – элементарных и ретикулярных телец. Элементарные тельца – это инфекционная форма. Пребывая в состоянии элементарных телец, хламидии способны выживать во внеклеточной среде, их метаболическая активность минимальна. Элементарные тельца попадают в клетку макроорганизма путем фагоцитоза и там превращаются в ретикулярные тельца (репродуктивную форму). Ретикулярные тельца метаболически высокоактивны (и потому чувствительны к антибиотикам), внутри клетки они размножаются посредством бинарного деления, а затем превращаются в элементарные тельца новой генерации. Этот цикл длится около 48 часов, затем мембрана клетки разрушается, вновь образованные элементарные тельца попадают во внеклеточную среду и заражают новые клетки. Выход элементарных телец из клетки может и не сопровождаться ее разрушением – например, если тельца выталкиваются или покидают клетку путем экзоцитоза. Элементарные тельца способны длительно персистировать без выраженной симптоматики, особенно после воздействия некоторых цитокинов (например, ИФН-γ) и лечения антибиотиками. Вообще, способность вызывать длительные, часто бессимптомные инфекции – одна из наиболее характерных особенностей хламидий.
Пути заражения отличаются у каждой из 3 разновидностей хламидий, но все они могут вызвать системную инфекцию с гематогенным распространением. C. pneumoniae передается от человека человеку через секрет дыхательных путей, C. trachomatis – через секрет половых путей. C. psittaci – возбудитель зоонозной инфекции, человек заражается от инфицированных птиц при вдыхании воздуха, содержащего взвесь частичек их экскрементов и выделений. Чаще всего люди заражаются от попугаев (австралийских, длиннохвостых, ара) или от других птиц, с которыми часто контактируют (голуби, утки, индюки).
Эпидемиология. Пневмония, вызванная C. pneumoniae, составляет, по разным оценкам, от 5 до 20% всех случаев внебольничной пневмонии у детей и подростков. Хотя случаи инфекции регистрируются ежегодно, отмечается цикличность заболеваемости с лагом в 4 года. Лица мужского пола заболевают чаще (60–90%), возможно из-за курения. Болеют чаще дети и люди молодого возраста, но возможно и развитие пневмонии у пожилых. Серологические маркеры перенесенной ранее инфекции C. pneumoniae выявляются приблизительно у 50% взрослых и 75% пожилых людей.
- trachomatis-инфекция шейки матки имеет место примерно у 5–22% беременных женщин. В процессе родов инфицирование ребенка происходит в 30–50% случаев. Среди инфицированных новорождённых у 25–50% появляются симптомы конъюнктивита, который, по меньшей мере, в половине случаев сопровождается назофарингитом. У 11–20% младенцев, рожденных от матерей с активным хламидиозом, до 8-недельного возраста развивается пневмония. У детей с симптомами хламидийного назофарингита пневмония развивается примерно в 25% случаев. Сообщалось о пневмонии, вызванной C. trachomatis, у иммунокомпрометированных взрослых.
Случаи орнитозных пневмоний в настоящее время встречаются редко, но частота их достаточно стабильна — 1–3%. Дети болеют значительно реже взрослых, что, скорее всего, связано с ограничением тесных контактов детей с птицами, поэтому в данной статье орнитоз рассматриваться не будет.
Клинические проявления. C. pneumoniae-инфекция в большинстве случаев протекает бессимптомно, но у части инфицированных детей, подростков и молодых людей возможно развитие нетяжелой пневмонии или бронхита. У пожилых людей течение заболевания может быть более серьезным, возможно реинфицирование. Клиника пневмонии, вызванной C. pneumoniae, мало чем отличается от клиники микоплазменной пневмонии.
Инкубационный период длится 3–4 недели. Развитие заболевания обычно постепенное: вначале отмечаются симптомы поражения носо-ротоглотки (ринит, фарингит, ларингит, синусит), а через 1–4 недели у части пациентов процесс прогрессирует до развития пневмонии. Отличием хламидийной инфекции от микоплазменной является более высокая частота осиплости голоса, болезненности при перкуссии в области околоносовых пазух, а также наличие головной боли, которая наблюдается более чем у половины пациентов. Лихорадка при хламидийной инфекции может отмечаться в течение нескольких первых дней, 1 недели или дольше, но ко времени развития пневмонии у большей части больных температура тела нормальная.
Кашель – основной симптом хламидийной пневмонии – чаще сухой или с отхождением скудной мокроты, сохраняется длительно (несколько недель, нередко и месяцев), даже несмотря на проведенную антибиотикотерапию. Сухие и влажные хрипы выслушиваются над легкими большинства больных.
На рентгенограммах легких пациентов с хламидийной пневмонией обычно выявляется единичный субсегментальный негомогенный инфильтрат, чаще всего локализующийся в нижних долях. Обширные очаги уплотнения встречаются редко, хотя сообщалось о развитии острого респираторного дистресс-синдрома. Плевральный выпот отмечается в 20–25% случаев. Остаточные явления на рентгенограммах могут сохраняться в течение 3 месяцев, иногда – дольше.
Осложнения инфекции C. pneumoniae включают отит, нодозную эритему, обострение или дебют бронхиальной астмы, эндокардит, синдром Гийена–Барре и энцефалит.
Симптомы пневмонии, вызванной C. trachomatis, иначе называемой также «синдромом афебрильной пневмонии», появляются после 3 недель жизни. Им часто предшествуют явления назофарингита. Развитие пневмонии обычно постепенное, характеризуется появлением кашля и тахипноэ. Ребенок становится беспокойным, раздражительным, хуже ест. Температура тела при этом нормальная или может повышаться до субфебрильных цифр. Для C. trachomatis-пневмонии характерен кашель «стаккато» – сухой, отрывистый, когда каждому кашлевому толчку предшествует короткий вдох. Над легкими выслушиваются рассеянные звучные влажные мелкопузырчатые хрипы. Сухие хрипы, как правило, отсутствуют. У половины детей с пневмонией отмечается также конъюнктивит и изменения со стороны среднего уха.
На рентгенограммах легких при C. trachomatis-пневмонии выявляют повышение прозрачности легочных полей и двусторонние мелкие интерстициальные инфильтраты. В общем анализе крове обычно обнаруживается эозинофилия (более 400 в 1 мкл).
Лабораторная диагностика. При инфекции C. pneumoniae чаще всего используются серологические методы диагностики – повышение титра специфических IgM более 1:16, либо увеличение титра специфических IgG в 4 и более раза в реакции микроиммунофлюоресценции (MИФ) считают диагностически значимым. Однако серологические тесты плохо стандартизированы, а воспроизводимость их недостаточна. Кроме того, гуморальный ответ при C. pneumoniae-инфекции может быть отсроченным: IgM могут появиться лишь через 6 недель с момента инфицирования, а IgG – через 8 недель, поэтому отрицательные результаты серологических тестов в дебюте заболевания не исключают наличия инфекции.
Наиболее многообещающим методом экспресс-диагностики при C. pneumoniae-инфекции может стать ПЦР. Однако до настоящего времени этот метод все еще находится в стадии разработки.
Выделение культуры C. pneumoniae в мазках из носоглотки – самый надежный способ верификации инфекции, но для практики он непригоден, так как может быть выполнен только в научно-исследовательских лабораториях (хламидии можно вырастить только в культурах клеток).
Диагностика пневмонии, вызванной C. trachomatis, базируется в первую очередь на клинико-эпидемиологических данных. Подтверждает диагноз обнаружение хламидиальных включений или элементарных телец в окрашенных по Гимзе конъюнктивальных или назофарингеальных мазках. Кроме того, у детей можно обнаружить повышение титра специфических IgM. Показано обследование родителей на наличие урогенитального хламидиоза и других болезней, передающихся половым путем.
Лечение. Оптимальные схемы и длительность лечения при хламидийных пневмониях до конца не определены, так как с помощью применявшихся методов диагностики невозможно оценить, произошла ли эрадикация возбудителя. При C. pneumoniae-пневмонии рекомендуется 10-дневный курс эритромицина (40 мг/кг/сут.) или кларитромицина (15 мг/кг/сут.) или 5-дневный курс азитромицина (1-е сут. – 10 мг/кг, 2–5-е сут. – 5 мг/кг).
Для лечения пневмонии, вызванной C. trachomatis, применяют 14-дневный курс лечения эритромицином (50 мг/кг/сут). В одном исследовании было показано, что короткий курс лечения азитромицином (3 дня по 20 мг/кг/сут.) так же эффективен, как и 14-дневный прием эритромицина.
Список литературы находится в редакции


коментарів