Никогда, ни в каких случаях не надо отчаиваться. Надеяться и действовать – наша обязанность в несчастии.Бездеятельное отчаяние – забвение и нарушение долга.
Борис Леонидович Пастернак
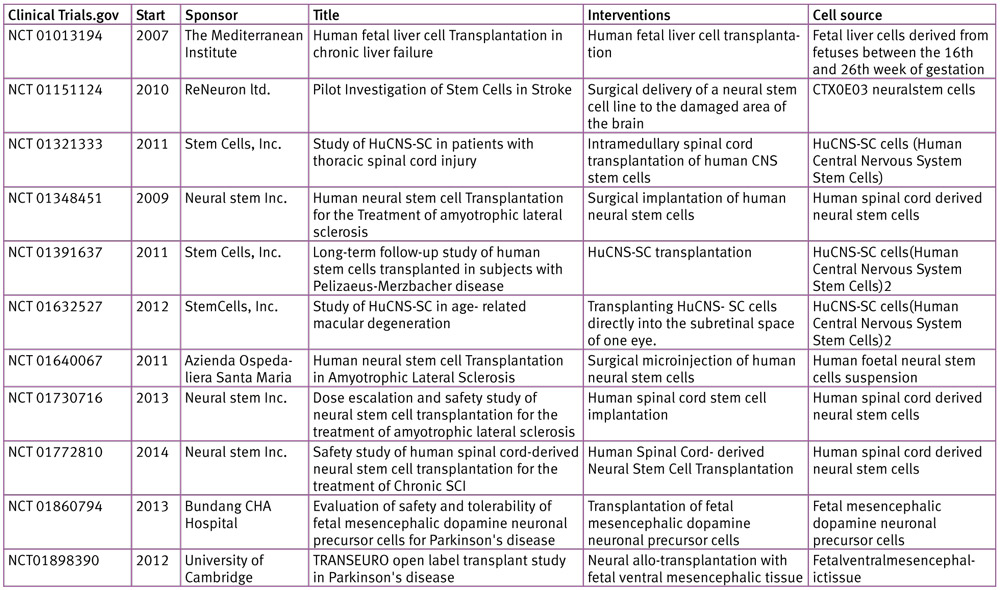
Количество клинических испытаний с использованием фетальных  прогениторных клеток за последние годы прогрессивно увеличивается.
прогениторных клеток за последние годы прогрессивно увеличивается.
В таблице представлены далеко не полные данные о таких испытаниях (TetsuyaIshii, KojiEto “Fetal stem cell transplantation: Past, present, and future” World J Stem Cells 2014 September 26; 6(4): 404-420 ISSN 1948-0210 (online) DOI: 10.4252/wjsc.v6.i4.404).
С 2000 года в академических учреждениях и частных компаниях разных стран инициированы сотни клинических испытаний по трансплантации фетальных клеток. Сегодня болезни, при которых отрабатываются технологии трансплантации прогениторных клеток, можно разделить на шесть категорий: неврологические болезни, недостаточность центральной нервной системы, сердечная недостаточность, сахарный диабет 1 и 2 типов, раны и несовершенный остеогенез («стеклянные кости»).
Неврологическая патология включает амиотрофический латеральный склероз, церебральный паралич, атрофию мозга, болезнь Хантингтона, болезнь Паркинсона, травматическую недостаточность головного мозга и спинальную травму. Нетрудно заметить, что в перечень заболеваний входят те, перед которыми сегодняшняя официальная медицина бессильна, либо способна оказать лишь паллиативную помощь.
Многочисленные попытки использовать трансформацию аутологических клеток костного мозга или жировой ткани заметного успеха в лечении этих болезней не принесли. И вполне логично медицинская наука повернулась в сторону использования иных источников стволовых клеток.
Таким источником стали ткани, полученные в результате медицинского прерывания беременности (об этических проблемах фетальных клеток я уже писал ранее). Фетальные прогениторные клетки не требуют размножения, предварительной дифференцировки в нужный для трансплантации тип клеток, имеют высокий потенциал размножения in vitro и, главное, in vivo. Кроме того, они функционально активны и легко образуют межклеточные связи, необходимые для репарации поврежденной ткани.
Такие свойства прогениторных клеток дают реальную надежду на жизнь миллионам смертельно больных людей, прикованным к инвалидным креслам.
Еще одна группа неизлечимых болезней, в лечении которых прогениторные клетки способны остановить прогрессию заболевания и значительно улучшить качество жизни пациента, это наследственная патология. В первую очередь, это миопатии и миопатия Дюшенна, в частности.
Миодистрофия Дюшенна (миопатия Дюшенна, миодистрофия Дюшенна–Беккера) – генетическая болезнь. Болеют мальчики и очень редко девочки. Болезнь вызывается делециями или дупликациями одного или нескольких экзонов, либо точечными мутациями в гене дистрофина – белка, отсутствие или изменение структуры которого ведет к прогрессивному распаду мышечной ткани. Основное проявление болезни – слабость мышц, затруднения при движениях с детского возраста, которые прогрессируют с течением времени. Признаками этого заболевания являются специфическая походка и осанка страдающих им детей, позднее начало ходьбы, ухудшенная по сравнению со сверстниками речь, псевдогипертрофия икроножных мышц.
С 8–10 лет больным необходимы костыли, с 12 лет большинство из них прикованы к инвалидным коляскам, а к 16–18 годам уже испытывают трудности с дыханием. Также характерны поражения сердца и снижение интеллекта. Смерть обычно наступает на втором-третьем десятилетии жизни. Средняя продолжительность жизни больных –25 лет. До сегодняшнего дня существовало только симптоматическое лечение. Только симптоматическое, потому что мы ранее априори представляли себе, что миопатии, связанные с делециями экзонов в гене дистрофина, стопроцентно фатальные.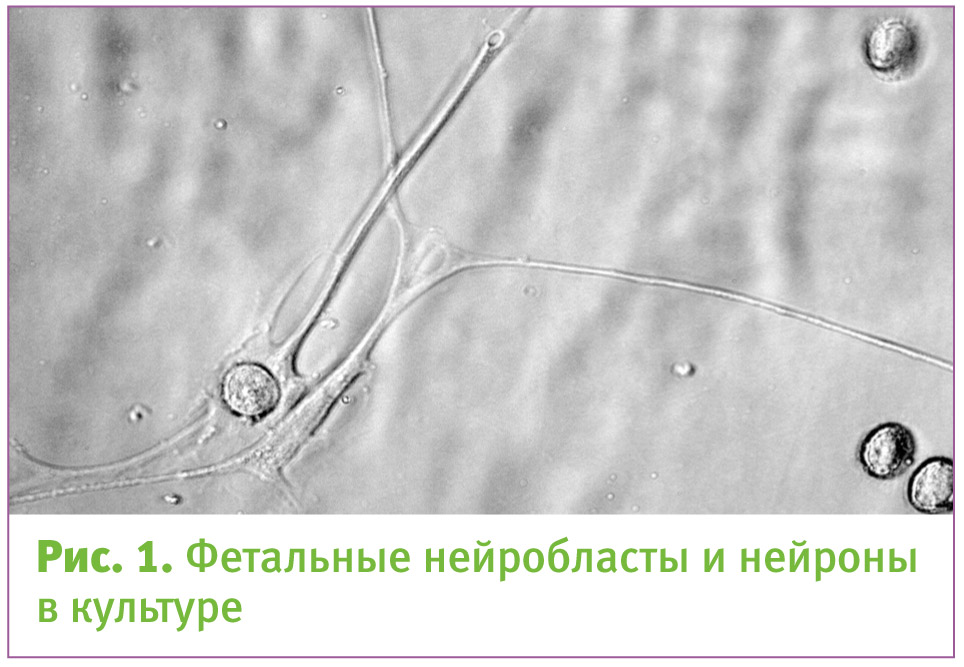
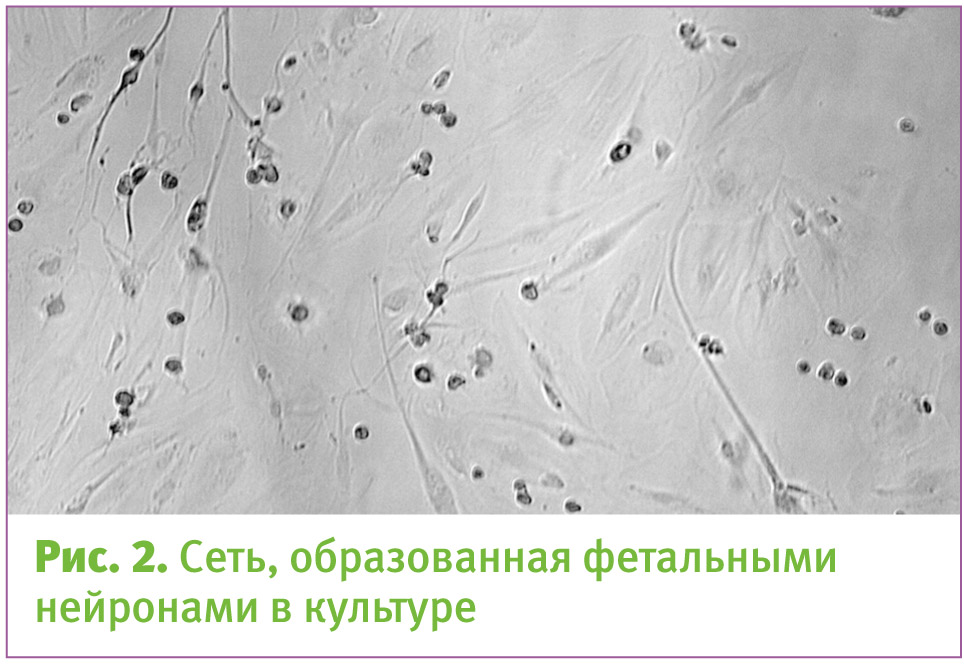 Дистрофин – уникальный белок, с большим количеством экзонов в гене, поэтому и уязвим.
Дистрофин – уникальный белок, с большим количеством экзонов в гене, поэтому и уязвим.
По сути, это пружина внутри миоцита, амортизирующая механическое повреждение мембраны скелетной мышечной клетки и препятствующая разрыву ее связей с внеклеточным окружением во время сокращения. Нет дистрофина, и мышца постепенно, волокно за волокном, погибает.
Генетики пытаются манипулировать на уровне гена дистрофина, но пока безуспешно. Что же могут стволовые клетки, которые вообще не подвергались никакой генетической манипуляции? Могут, и многое…

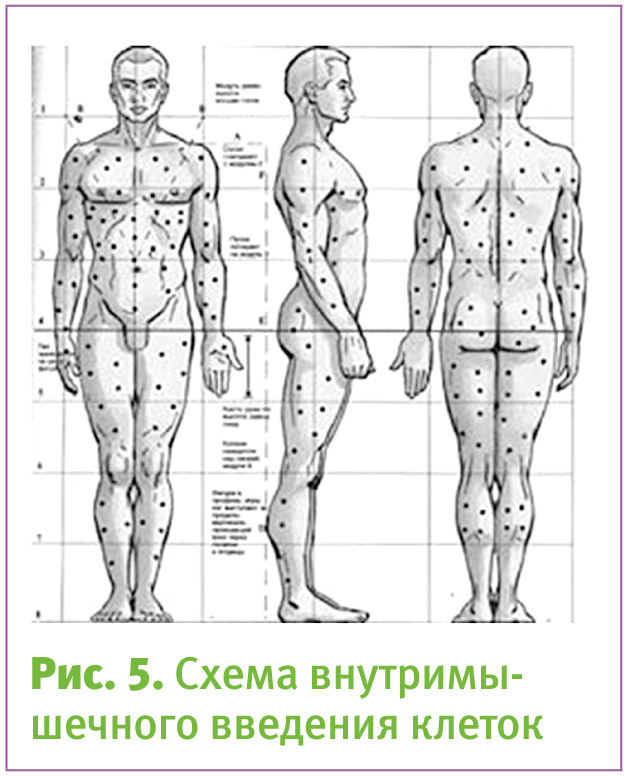
Миоцит – это синцитий, то есть, клетка, содержащая не одно, а десятки ядер.
Если взять генетически полноценные прогениторные клетки и ввести их в мышцы больного многократно
(от 200 до 500 инъекций во все группы мышц), то мы получимтот же синцитий, но уже с ядрами донора, белковые продукты которых, в том числе и дистрофин, прикрыты от иммуннойсистемы мембраной миоцита. И сегодня пациенты с миопатией Дюшенна после лечения клетками живут с возрастанием мышечной силы и не умирают от недостаточности дыхательных мышц.
А пациенты с болезнью Беккера встают из инвалидных кресел и способны обслужить себя сами, но пока только в самом необходимом. Конечно, это не идеальный результат, надо совершенствовать метод лечения, но эти люди – живы...
О лечении сахарного диабета и других заболеваний с помощью трансплантации стволовых клеток – в следующей статье…



коментарів