Грудное молоко – это физиологическое питание для новорожденных и младенцев, которое идеально подходит для роста, развития и профилактики инфекций. Его состав сформировался в течение миллионов лет эволюции. В недавнем мета-анализе «Грудное вскармливание в ХХІ веке», опубликованном в Lancet в январе 2016 года [1], указывается, что очевидную пользу от грудного вскармливания могли бы получить все страны, независимо от их социально-экономического уровня. Повышение уровня грудного вскармливания до физиологического может предотвратить не только 823 000 смертей детей младше 5 лет в год, но также и 20 000 ежегодных смертей женщин от рака молочной железы
В настоящее время существуют неоспоримые доказательства того, что вскармливаемые грудью дети реже страдают от инфекций и аномалий прикуса, имеют более высокий коэффициент интеллекта, а в старшем возрасте менее подвержены развитию ожирения и сахарного диабета. В то же время, данных, которые бы подтверждали протективный эффект грудного молока в отношении развития аллергии, по-прежнему недостаточно.
В недавно опубликованном обзоре (D. Munblit, V. Verhasselt, 2016) авторы высказывают предположение, что недостаточный профилактический эффект грудного вскармливания в отношении развития аллергических заболеваний связан с тем, что аллергия – это современная болезнь, которая широко распространилась в обществе сравнительно недавно, а состав грудного молока пока не успел адаптироваться под нужды профилактики аллергии [56]. Расширение наших представлений о патогенезе аллергии и свойствах грудного молока дают основания полагать, что путем определенных модуляций состава грудного молока можно повысить его защитный эффект.
Современная концепция развития аллергических заболеваний предполагает не только наличие дисбаланса между воспалительным и регуляторным иммунным ответом на воздействие факторов окружающей среды, в т. ч. и пищевые антигены, но также и наличие дисфункции эпителиальных барьеров. Окружающая среда и характер питания в раннем периоде жизни считаются критическими для последующей предрасположенности к аллергии [2]. В данном обзоре обсуждается, каким образом факторы грудного молока могут повышать противовоспалительную активность и барьерные функции кишечного эпителия, а также стимулировать регуляторные иммунные реакции; какие вмешательства могут способствовать изменению состава грудного молока с целью усиления его противодействия аллергии; и, наконец, имеются ли данные клинических исследований, подтверждающие эффективность подобных вмешательств.
Как грудное молоко может способствовать профилактике аллергии
Грудное молоко содержит сотни биологически активных молекул, участвующих в процессах роста ребенка, создающих пассивную иммунную защиту, активно модулирующих иммунную систему, влияющих на умственное развитие и обмен веществ [3]. Состав грудного молока уникален для каждой матери. Он изменяется в течение всего периода вскармливания и может модулироваться материнскими средовыми факторами, например, когда после перенесенной матерью инфекции в грудном молоке увеличиваются уровни специфических иммуноглобулинов А [4]. В таблице представлены те компоненты грудного молока, которые имеют значение для профилактики аллергии, а также возможные пути их модуляции (см. табл. 1).
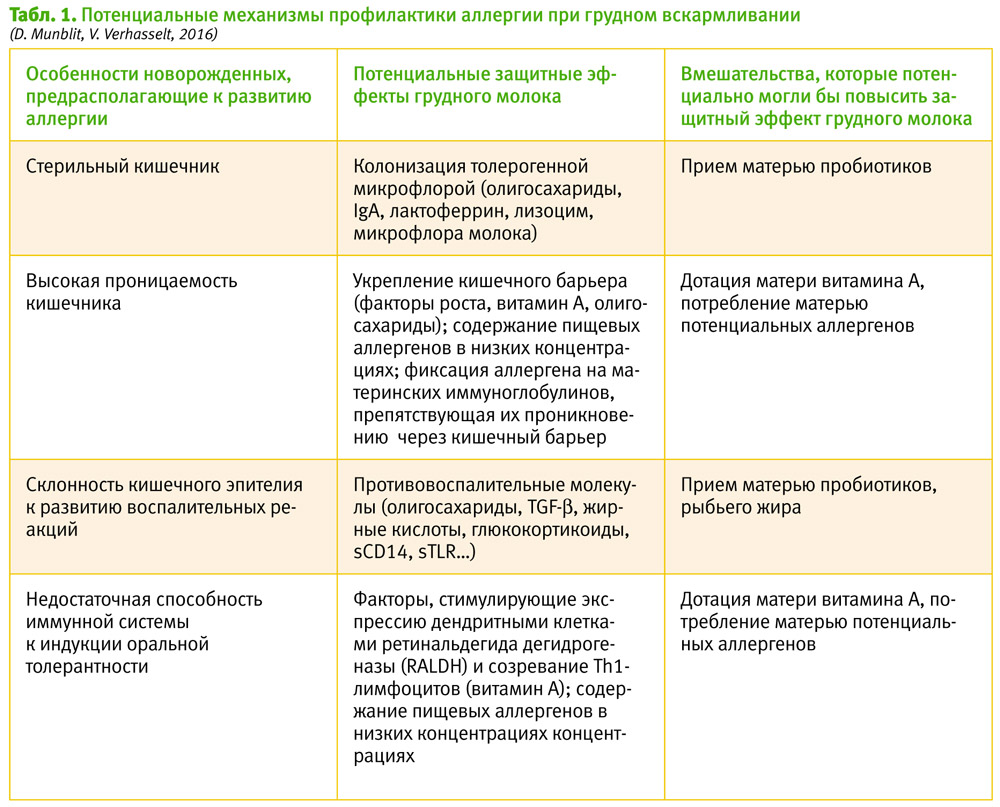
Может ли грудное вскармливание способствовать формированию противоаллергического кишечного барьера?
При аллергических заболеваниях поражаются барьеры организма (кожа при атопическом дерматите, слизистая оболочка бронхов при астме, слизистая оболочка кишечника при гастроинтестинальной аллергии). Первичный дефект барьерных функций – одна из предполагаемых причин развития аллергии. Наиболее наглядно это можно продемонстрировать на примере атопического дерматита – заболевание развивается у лиц с генетически обусловленным дефектом белка филаггрина, который необходим для адекватного функционирования кожного эпителия. Также предполагается, что и дисфункция кишечного барьера играет важную роль в развитии аллергической сенсибилизации, а также определяет тяжесть симптомов [5].
У взрослых барьерная функция кишечника обеспечивается благодаря наличию (1) секреторного IgA, который попадает в просвет кишечника путем трансцитоза через кишечный эпителий, (2) слизи, вырабатываемой бокаловидными клетками, (3) антимикробных пептидов, в основном вырабатывающихся в клетках Панета и бокаловидных клетках, а также (4) плотных соединений эпителиальных клеток. Функция кишечного барьера модулируется медиаторами, секретируемыми клетками, расположенными на lamina propria. В частности, врожденные лимфоидные клетки 2-го типа (type 2 innate lymphoid cells – ILC2) вырабатывают ИЛ-13 и амфирегулин, которые стимулируют секрецию слизи и тканевую репарацию, а ILC3 вырабатывают ИЛ-22, стимулирующий секрецию антимикробных пептидов и также репарацию тканей [6]. В совокупности эти механизмы противодействуют поступлению аллергенов, регулируют состав микробиоты и усиливают противовоспалительные свойства кишечного эпителия [2].
У новорожденных большинство этих механизмов функционирует «неудовлетворительно»: уровень секреторного IgA очень низок, клетки Панета и бокаловидные клетки единичны, эпителиальные клетки высокопроницаемы и секретируют множество провоспалительных цитокинов [7]. Данных о функции ILC у новорожденных очень мало, за исключением ILC3, также называемых LTi (Lymphoid tissue inducer), которые, как известно, в этом возрасте участвуют в постнатальном развитии лимфоидных органов [6].
Уже давно известно, что в грудном молоке присутствуют различные трофические факторы, способные активно стимулировать формирование крипт и ворсинок незрелого эпителия кишечника [3]. Также известно, что материнское молоко является основным фактором, способствующим уменьшению проницаемости эпителия кишечника для интактного белка, которая повышается в течение первой недели жизни как у людей [8], так и у грызунов [9].
При анализе слущенного кишечного эпителия из образцов кала трехмесячных младенцев, вскармливаемых грудью и смесями, были выявлены различия в экспрессии в общей сложности 1214 генов, обусловленные видом вскармливания [10]. Анализ генных сетей показал, что эти различия имели отношение к сигнальной трансдукции (WNT, NOTCH, TGF-b), ремоделированию цитоскелета, адгезии клеток и иммунному ответу.
Факторы роста, содержащиеся в грудном молоке, такие как эпидермальный фактор роста (ЭФР), инсулиноподобный фактор роста (ИФР), трансформирующий фактор роста-b (TGF-b), активируют пролиферацию и дифференцировку эпителиоцитов кишечника, а также стимулируют репарацию тканей [3]. Кроме того, молекулы, известные своей антибактериальной активностью, такие как лактоферрин, также, оказывается, стимулируют пролиферацию и дифференцировку кишечного эпителия [11].
Помимо эндогенных факторов роста материнского молока, уровень которых сложно модулировать, обнаружены и другие компоненты, присутствующие как в грудном молоке, так и в питании кормящих матерей, способные влиять на кишечный барьер новорожденных. Так, витамин А является мощным фактором дифференцировки кишечного эпителия [13].
Витамин А и его предшественники содержатся в большом количестве в молозиве и в меньших концентрациях – в зрелом молоке [14]. Хотя уровень витамина А в грудном молоке не зависит от уровня его потребления матерью [12], в экспериментальных исследованиях на мышах было обнаружено, что добавки витамина А в период лактации способствуют формированию крипт и уменьшению проницаемости кишечника у новорожденных [15]. Важно, что добавки витамина А не влияют на выработку кишечным эпителием ферментов, участвующих в процессах переваривания молока, таких как лактаза и b-галактозидаза [15].
Одним из основных проявлений незрелости тонкого кишечника новорожденных является его склонность к развитию более мощной воспалительной реакции в ответ на раздражители по сравнению со взрослыми [7]. Учитывая решающую роль воспалительного ответа кишечного эпителия в развитии аллергии [2], понятно, что эта возрастная особенность новорожденных может способствовать аллергической сенсибилизации к пищевым антигенам в раннем периоде жизни.
Содержащиеся в грудном молоке TGF-b, кортизол, жирные кислоты и лактоферрин, как известно, способствуют снижению продукции провоспалительных цитокинов эпителиальными клетками [16]. Исследование влияния олигосахаридов человеческого молозива на фетальные эпителиальные клетки человека показало значительное снижение острой фазы воспалительной секреции цитокинов, тогда как уровни цитокинов, участвующих в репаративных процессах и гемостазе, повышались [17]. Также было показано, что факторы грудного молока способны препятствовать механизмам микробной сигнализации в кишечных эпителиоцитах, таким как sTLR (Toll-подобные рецепторы) и sCD14, связывающим липосахариды (ЛПС) [18]. Последние работы подтвердили способность олигосахаридов человеческого молока снижать экспрессию СD14 в энтероцитах человека [19], а эпителиального фактора роста – подавлять TLR4-сигнализацию. Оба эти эффекта способствовали уменьшению индуцированного ЛПС воспаления [20]. Эти наблюдения важны, так как известно, что эпителиальные клетки новорожденных отличаются от эпителия взрослых отсутствием толерантности к ЛПС [7].
Интересно, что более десяти лет назад, Jones et al. [21] показали, что низкие уровни sCD14 в зрелом молоке ассоциированы с развитием экземы, а затем Savilahti et al. [22] сообщили об аналогичной тенденции при изучении молозива. Правда, в более поздних исследованиях, проведенных в Германии [23, 24], не удалось воспроизвести эти результаты и доказать защитный эффект данного растворимого рецептора в отношении развития экземы. Предполагается, что различия в результатах исследований могут быть связаны с разными генотипами СD14: сообщалось, что у детей со CT/CC генотипом риск развития атопической сенсибилизации ниже [25].
Таким образом, барьерная функция кишечного эпителия напрямую зависит от факторов материнского молока.
Может ли грудное вскармливание способствовать развитию толерантности?
Как известно, аллергические реакции являются следствием неадекватного Тh2-иммунного ответа на антиген, в то время как у людей без атопии в ответ на воздействие антигена развиваются Тreg/Тh1-реакции [2]. В раннем периоде жизни иммунная система характеризуется склонностью к развитию Тh2-иммунного ответа, но по мере ее созревания начинает преобладать Тreg/Тh1-иммунитет [26]. В данном разделе более подробно будет рассмотрено, как именно грудное молоко может влиять на иммунную систему новорожденного и ее созревание.
1) Грудное вскармливание и кишечная микробиота детей раннего возраста
Одним из основных факторов, влияющих на регуляцию иммунного ответа, является кишечная микробиота. Лучше всего это было показано на мышах, когда в случае искусственной стерилизации кишечника у них отмечалось слабое развитие иммунной системы, недостаточность индукции оральной толерантности и склонность к повышению Тh2-иммунного ответа.
Кроме того, были идентифицированы конкретные штаммы бактерий, которые могут способствовать дифференцировке Treg-лимфоцитов (Сlostridia, Вacteroides fragilis) или, наоборот, стимулировать провоспалительные Тh17-лимфоциты (СФБ – сегментированные филаментные бактерии) [27]. Параллельно с исследованиями на мышах, было отмечено, что изменения в составе кишечной микрофлоры в раннем возрасте могут предрасполагать к развитию аллергических заболеваний [28]. Эта гипотеза подтверждается и результатами сравнительно недавнего проспективного когортного исследования, которое показало, что у детей с риском развития астмы имел место транзиторный дисбиоз кишечника в течение первых 100 дней жизни [29].
Первичная колонизация кишечника происходит при рождении, во время естественных родов, когда бактерии, полученные из влагалища и кишечника матери, становятся основой для заселения кишечника новорожденного.
Таким образом, состав материнской микрофлоры и способ родоразрешения являются важными факторами инициации формирования микробиоты ребенка.
Грудное молоко способствует дальнейшему развитию кишечной микрофлоры. Множество исследований подтвердили, что IgA, содержащийся в женском молоке, является важным связующим звеном между составом микробиоты матери и ребенка. Секреторный IgA синтезируется в кишечнике матери и специфичность его определяется составом ее микрофлоры. Попадая в кишечник ребенка с грудным молоком, этот IgA способствует формированию микробиоты, подобной материнской [4].
Кроме того, в последнее время было доказано, что женское молоко не является стерильным, оно содержит примерно 103–104 КОЕ бактерий в 1 мл. То есть, микробиом молока может рассматриваться как постоянный источник бактерий-комменсалов для кишечника ребенка [30]. Недавние исследования показали, что микробиом грудного молока можно изменить путем дотации матерям пробиотических бактерий. Было продемонстрировано, что применение пробиотиков, как оральным, так и вагинальным путем, сопровождается повышением уровней лактобактерий и бифидобактерий в молоке кормящих женщин [31].
Значительные успехи в выявлении механизмов модулирования микробиотой функций иммунной системы дали определенные новые ключи к пониманию того, каким образом грудное молоко может оказывать протективный эффект и каким образом оно может определять состав микробиоты. Исследования последних лет показали, что влияние микробиоты на иммунную систему опосредуется, в основном, теми метаболитами, которые образуются в процессе переработки кишечными бактериями пищевых нутриентов.
Так, при ферментации клетчатки некоторыми видами бактерий, такими как клостридии, образуются короткоцепочечные жирные кислоты (КЖК) – пропионат, бутират и ацетат, которые стимулируют дифференцировку Тreg-лимфоцитов и препятствуют развитию аллергических реакций. Противовоспалительный эффект КЖК продемонстрирован также и в отношении других типов клеток, таких как эпителиальные и врожденные иммунные клетки [32]. У детей с повышенным риском аллергических реакций и дисбиозом кишечника обнаруживали снижение уровня ацетата в кале [29].
Открытие важной роли КЖК в регуляции иммунного ответа породило интерес к исследованию факторов, которые способны влиять на уровень КЖК в грудном молоке и/или факторов, которые бы стимулировали продукцию КЖК бактериями. В этой связи, олигосахариды грудного молока могут оказаться одним из основных кандидатов.
Концентрация олигосахаридов в грудном молоке колеблется от 10 г/л до 15 г/л, что в 100–1000 раз превышает их уровень в коровьем молоке, а в молозиве их содержание еще выше [33].
Олигосахариды грудного молока являются пребиотиками, представляя собой метаболические субстраты для определенных бактерий (например, Bifidobacterium longum подвид іnfantis) и стимулируя их преимущественный рост [33]. Bifidobacterium longum способны превращать олигосахариды грудного молока в КЖК, оказывающие выше описанные эффекты.
Важно, что эти пребиотики могут модулировать экспрессию генов Bifidobacterium longum, участвующих в процессах деградации углеводов и клеточного взаимодействия [34]. Кроме того, олигосахариды грудного молока непосредственно могут оказывать и такие благотворные эффекты, как ингибирование адгезии патогенных микроорганизмов на поверхности эпителиальных клеток и индукция секреции противовоспалительных медиаторов эпителиальными и иммунными клетками [33].
В опубликованном в 2016 году исследовании M. Gomez de Aguero et al. было показано, что различные метаболиты, которые производятся микрофлорой кишечника матери во время беременности, передаются через грудное молоко и оказывают влияние на раннее постнатальное созревание иммунной системы и выработку антимикробных пептидов кишечными эпителиоцитами [35]. Причем, эти эффекты зависели от уровня иммуноглобулинов материнского молока и не зависели от микробной колонизации новорожденного.
С учетом веских доказательств иммуномодулирующего действия кишечной микрофлоры, во многих исследованиях изучалась возможность профилактики аллергии назначением пробиотиков беременным женщинам с целью модуляции их кишечной микробиоты, а впоследствии – и их детей. В одних исследованиях было выявлено увеличение числа бифидобактерий в кишечнике младенцев, матери которых получали бифидобактерии во время беременности, в других такие результаты не были воспроизведены [36]. Помимо непосредственного влияния пробиотиков на состав микрофлоры кишечника матери и ребенка, было выявлено их воздействие на уровни иммуномодулирующих факторов грудного молока.
Так, Prescott et al. [37] показали, что к концу первой недели лактации в молоке матерей, получавших B. lactis HN019, обнаруживались более высокие уровни TGF-b1 и IgA, и более высокий уровень IgA при приеме L. rhamnosus HN001. Два других исследования [38,39] не выявили влияния приема пробиотиков во время беременности на уровень TGF-b.
В исследовании Rautava et al. [40] сообщалось о возможном протективном эффекте применения пробиотиков во время беременности и лактации в отношении развития атопических заболеваний у детей. В мета-анализе, опубликованном в 2015 году, был сделан вывод о том, что применение пробиотиков способно обеспечить определенную защиту от развития атопического дерматита [41].
Что касается факторов, которые могли бы повлиять на уровень олигосахаридов грудного молока, то в настоящее время они неизвестны, а последствия влияния пребиотических добавок на развитие аллергических болезней у детей требует дальнейших исследований
[42].
2) Грудное вскармливание и витамины
Пищевые нутриенты могут влиять на функцию Treg-лимфоцитов не только посредством их переработки кишечной микрофлорой, но и напрямую. В многочисленных исследованиях изучалась роль витамина D в качестве иммуномодулятора и протолерогенного агента [32]. Однако, несмотря на очевидную связь между уровнем витамина D2 в крови и частотой развития аллергических заболеваний, убедительно доказать, что дотация витамина D может защитить от аллергии, пока не удалось.
В последних руководствах Всемирной организации аллергии (WAO) не рекомендуется использование витамина D у беременных женщин, кормящих матерей и здоровых доношенных детей в качестве средства профилактики аллергических заболеваний из-за очень низкой достоверности доказательств [43].
Влияние витамина А на иммунный гомеостаз также активно изучалось в последние годы [32]. В исследовании на мышах было показано, что непосредственно после рождения отмечается физиологический дефицит витамина А – его уровень в крови достигает значений взрослых особей лишь к 3 неделям жизни [15]. Низкий уровень витамина А при рождении был связан с повышенной проницаемостью кишечника, недостаточной функцией дендритных клеток CD103+ брыжеечных лимфатических узлов, что сопровождалось неэффективной Т-клеточной активацией и неспособностью формировать оральную толерантность у новорожденных. Но дотации витамина А матерям во время кормления грудью было достаточно для повышения барьерных функций кишечника новорожденных и устранения описанных иммунологических дефектов при условии назначения витамина сразу после рождения.
Важно также, что данное исследование показало, что витамин А участвует в созревании иммунных реакций новорожденных, т. е. стимулировании Тh1-иммунного ответа [15].
Низкий уровень ретинола был выявлен и в исследованиях на людях, в частности – у здоровых младенцев в странах, где население питается удовлетворительно. Наблюдательные исследования показали, что между низким уровнем ретинола и повышением риска развития атопических заболеваний существует связь [44]. В то же время в одном исследовании, проводившимся в Гвинее-Бисау, сообщалось, что дотация витамина А сопровождалась повышенной частотой развития атопии у девочек [45].
Авторы обзора предполагают, что поскольку витамин А стимулирует провоспалительные реакции при наличии воспаления слизистой оболочки кишечника, то, возможно, такие результаты связаны с высокой частотой кишечных инфекций в Гвинее-Бисау. В любом случае, необходимы дальнейшие исследования по изучению эффективности дотаций витамина А кормящим матерям с целью профилактики аллергии в развитых странах.
3) Грудное вскармливание и формирование оральной толерантности
В последние годы появилась концепция, согласно которой раннее воздействие пищевых антигенов может быть необходимым для индукции толерантности к ним и долгосрочного предотвращения неадекватных иммунных реакций на пищевые аллергены [46]. Всемирная организация здравоохранения рекомендует исключительно грудное вскармливание в течение, по крайней мере, 6 месяцев для всех детей [47]. В связи с новыми данными, в некоторых исследованиях этот подход подвергается критике и предлагается более раннее введение прикорма с целью снижения риска развития пищевой аллергии [48]. Но на самом деле эти данные лишь подчеркивают важность трансфера пищевых белков через грудное молоко, так как именно этим путем осуществляется первое знакомство ребенка с различными продуктами.
В исследовании на мышах было показано, что потомство матерей, которым во время лактации вводили лишь несколько нанограмм антигена яичного овальбумин (ОВА), в последующем было защищено от индуцированных ОВА аллергических заболеваний дыхательных путей и что решающее значение для индукции толерантности имеет TGF-b грудного молока [49]. При этом защита от аллергических заболеваний была выше у мышей, матери которых получили ОВА орально, а не парентерально [50]. Эти данные указывают на то, что степень защиты от аллергических заболеваний у вскармливаемых грудью младенцев может зависеть от состава грудного молока, и в частности – от содержания в нем аллергенов, TGF-b и аллерген-специфических иммуноглобулинов.
Данные о связи между потреблением различных продуктов матерями и последующим обнаружением пищевых белков в их молоке ограничены. Концентрации пищевых антигенов, обнаруживаемых в грудном молоке, колеблются в пределах нескольких нанограмм в 1 мл, тогда как в искусственных смесях их концентрации измеряются миллиграммами на 1 мл. Большинство исследований показывают отсутствие прямой корреляции между количеством потребляемых матерью пищевых аллергенов и их уровнями в грудном молоке [51].
В настоящее время проводится исследование QUEST, в котором изучается влияние потребления яиц кормящими матерями на развитие аллергии на яичный белок у детей. Результаты этого исследования позволят получить дополнительную информацию о возможностях индукции оральной толерантности через грудное молоко, т. е. будет ли способствовать отсутствие диетических ограничений для кормящих матерей профилактике развития аллергии у их детей. Одно недавнее исследование показало, что исключение из рациона кормящих матерей коровьего молока было связано с более низкими концентрациями специфических секреторных ІgА и развитием аллергии на белок коровьего молока у их детей уже в раннем возрасте, что демонстрирует возможные прямые и косвенные последствия вмешательств в рацион кормящих матерей [52]. Таким образом, разумной стратегией профилактики аллергии может быть не раннее введение прикорма, а отмена диетических ограничений для кормящих матерей.
Одним из объяснений противоречий в выводах о профилактике пищевой аллергии при грудном вскармливании может быть разница в длительности грудного вскармливания. У мышей, которые получали антиген яичного белка через грудное молоко, профилактика пищевой аллергии имела ограниченный срок. Введение добавок, содержащих TGF-b, после отлучения от груди позволило пролонгировать защитный эффект.
Потребность в экзогенном TGF-b в раннем периоде жизни может быть связана с недостаточной продукцией эндогенного TGF-b. Это подтверждается данными, продемонстрировавшими низкий уровень экспрессии TGF-b в тонкой кишке крыс в период до отлучения от груди [53]. У детей также были получены доказательства сниженной продукции TGF-b: уровень TGF-b в кале в период от рождения до шестимесячного возраста был в пять раз ниже, чем в возрасте одного года [54]. Таким образом, можно предположить, что в раннем периоде жизни низкая продукция эндогенного TGF-b в сочетании с недостаточным его поступлением извне может препятствовать длительному поддержанию толерантности и профилактике пищевой аллергии. В систематическом обзоре Oddy and Rosales [55] выявили обратную связь между концентрацией TGF-b1 в молозиве и грудном молоке и частотой развития атопических заболеваний у детей грудного возраста.
Заключение
Не смотря на то, что убедительных данных о защитном эффекте грудного вскармливания в отношении развития аллергических заболеваний пока недостаточно, имеются неоспоримые свидетельства того, что грудное молоко способствует формированию барьерной функции кишечного эпителия, регуляции и созреванию иммунной системы, дифференцировке и репарации тканей, становлению кишечной микробиоты. Очевидно также, что состав грудного молока может изменяться в зависимости от материнских средовых факторов. Необходимы дальнейшие исследования для того, чтобы определить, влияет ли длительность грудного вскармливания и рацион кормящей матери на «противоаллергические» свойства грудного молока, и можно ли их усилить путем целенаправленных вмешательств, таких как прием пробиотиков, витамина А и других пищевых добавок.
Список литературы находится в редакции.


коментарів