
ПРОГЕСТЕРОН:«ЗА» І «ПРОТИ» (Частина 2)
 Шановні колеги, Вашій увазі надаються дані рандомізованих досліджень стосовно використання прогестерону при передчасних пологах.
Шановні колеги, Вашій увазі надаються дані рандомізованих досліджень стосовно використання прогестерону при передчасних пологах.
Відповідні документи, зокрема, дані рандомізованих досліджень, були отримані з PubMed (Національної медичної бібліотеки США) за період з 1983 р. по лютий 2012 р. Оцінюваними прогестагенами були вагінальний прогестерон та 17-альфа-гідроксипрогестерона капроат. Крім того, для виявлення відповідних статей були використані Кокранівська бібліотека, організаційні керівництва і результати досліджень
(Початок – у №5 (53) 2014).
Детальніше
ПЕРЕДЧАСНІ ПОЛОГИ ПРИ ОДНОПЛОДОВІЙ ВАГІТНОСТІ
Сучасні можливості прогнозування та запобігання
Недоношеність є основною причиною захворюваності і смертності немовлят. Незважаючи на багаторічні пошуки предикторів передчасних пологів, передбачення цього ускладнення залишається складним. У цій статті пропонуємо огляд літератури про прогнозування передчасних пологів та можливість запобігання їм
Недоношеність – основна причина неонатальної захворюваності і смертності. Особливо це стосується неврологічної патології (внутрішньо-шлуночкові крововиливи, перівентрикулярна лейкомаляція), легеневих (хвороба гіалінових мембран) та шлунково-кишкових (некротичний ентероколіт) ускладнень. Шанси на виживання народженого передчасно немовляти залежать від його гестаційного віку: це рідко трапляється до 24 тижнів, натомість у віці більше 29 тижнів виживає понад 90% немовлят.
Детальніше
ПЕЙЗАЖ, НАМАЛЬОВАНИЙ МОРЕМ
 XІII-й Світовий Конґрес з Медицини Плода
XІII-й Світовий Конґрес з Медицини Плода
Ніцца, Франція, 29.06-03.07.2014
Побачивши море з вікна літака, відводиш погляд. Очам болить. Ясна річ, солона вода і теплі скелі не належать нікому. У всі часи перетягування народами ковдри узбережжя нагадує поділ собаки блохами. Та болить все одно. Відтято окраєць серця. Одібрано ландшафт найкращих спогадів. Перерізано судину з пахощами та звуками спекотних вечорів юності. Знекровлення пам’яті. Розчарування в людській подобі. Літак заземлюється. Старовинна Нікея обіймає за плечі, мовляв, не журися, це лазурове золото на тиждень твоє.
Детальніше

ІЄРАРХІЯ СТАТІ

Порушення статевого диференціювання
Порушення статевого диференціювання – це результат порушення у комплексному процесі, що зароджується у генетичній інформації та розповсюджується на всі рівні статевої організації
МКХ-10: Е25.0, Е25.8, Е29.1, Е34.5, Q56, Q99
Статеве диференціювання може порушитися на будь-якому етапі. Це порушення викликається абераціями статевих хромосом, мутаціями генів, які приймають участь у становленні гонадної або фенотипічної статі, а також негенетичними причинами (наприклад, прийомом вірилізуючих лікарських препаратів під час вагітності).
Детальніше
ПРАВО НА ЖИТТЯ
Етіопатогенез, діагностикА та лікування гемолітичної хвороби плода (частина 2)
(Початок – у номері 4(52) 2014).
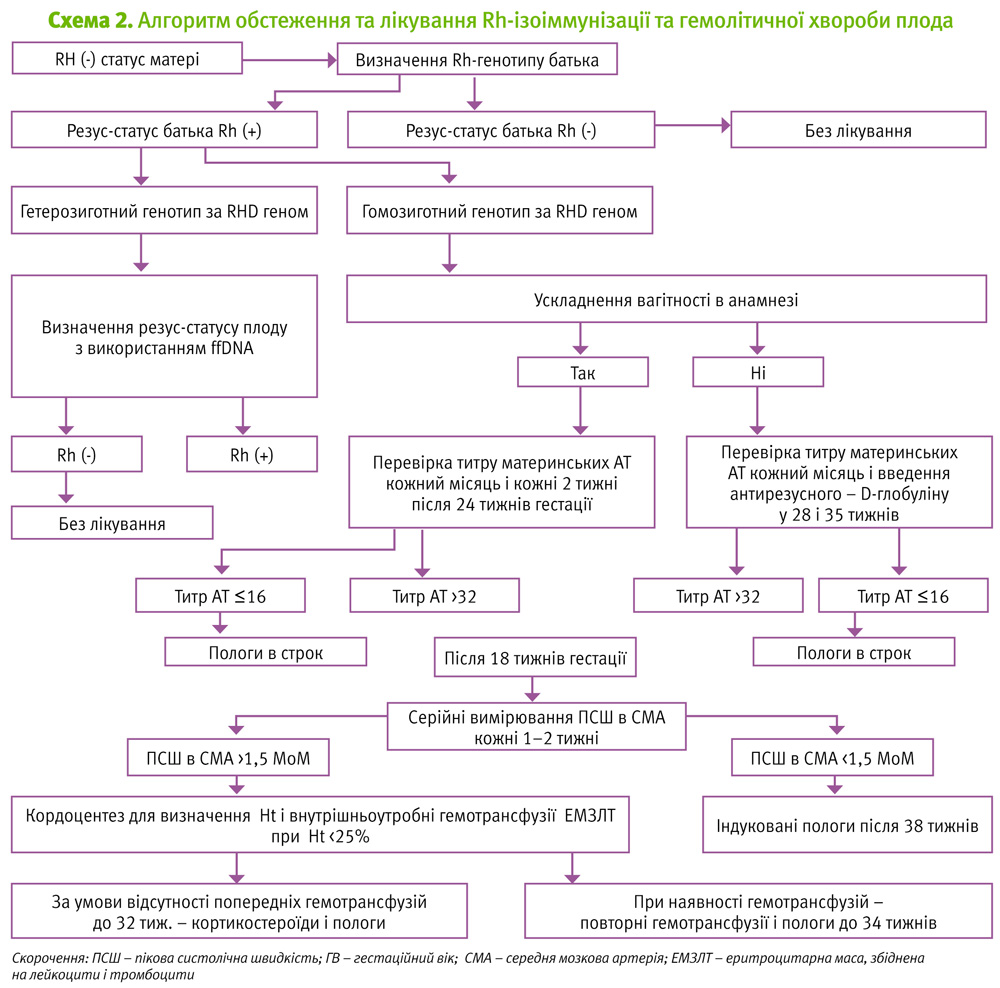
Тактика ведення вагітності при Rh-ізоіммунізації вагітної
Тактика ведення залежить від Rh-належності плода (див. схему 2).
Люди з резус-позитивною кров'ю можуть бути гомо- (DD) та гетерозиготними (Dd). Якщо батько гомозиготний (DD), що відзначається у 40–45% всіх чоловіків з резус-позитивною кров'ю, то домінантний ген D завжди передається плоду. Отже, у жінки з резус-негативною кров'ю (dd) плід буде Rh-позитивним у 100% випадків.
Якщо батько гетерозиготний (Dd), що спостерігається у 55–60% всіх резус-позитивних чоловіків, то плід буде резус-позитивним в 50% випадків, оскільки можливе успадкування і домінантного, і рецесивного гена. Метод ПЛР-визначення гетерозиготності батька на даний період часу є доступним і впроваджений у рутинну практику.
Існує можливість визначення Rh-генотипу плода за допомогою молекулярно-генетичних методів з використанням будь-яких клітин плодового походження, що дає унікальну можливість визначати тактику ведення Rh-імунізованих жінок вже на початку вагітності.
Полімеразна ланцюгова реакція має 100% чутливість і специфічність при визначенні Rh-генотипу плода. Для проведення пренатальних молекулярно-генетичних досліджень відбирають зразки ворсин хоріону, плаценти, амніотичної рідини чи крові плода (у залежності від терміну вагітності).
Амніоцентез є найбільш безпечним інвазивним втручанням для плода в період з 14 по 18 тиждень вагітності, оскільки це найкращий термін для Rh-типування плодів у Rh-імунізованих вагітних жінок. При дослідженні плідного матеріалу виділення ДНК (для наступного типування гену RHD тощо) проводиться мікрометодом (зважаючи на невелику кількість матеріалу, що можна отримати).
Однак, враховуючи певний ризик самовільних викиднів (0,5–1,5%) та ще більшої RH-імунізації жінки при про веденні інвазивних процедур, для отримання зразків ДНК плода у найближчому майбутньому в клінічній практиці широко будуть застосовуватися неінвазивні методи досліджень.
Неінвазивні методи визначення резус-статусу плоду
Неінвазивні методи базуються на виділенні циркулюючої позаклітинної плідної ДНК з периферійної крові матері (виявляється вже з 4-го тижня вагітності за рахунок плодово-маткових трансфузій). Необхідна для діагностики концентрація накопичується вже з 7-го тижня (необхідний мінімум складає 3–4% від загальної концентрації позаклітинної ДНК плазми матері).
Нині для виділення достатньої кількості плідної ДНК необхідно використовувати великий як для сучасних молекулярно-генетичних технологій об’єм крові (до 7 мл). Для виділення плідної ДНК переважно використовують методи, що базуються на застосуванні сорбції ДНК на мікромембрані (з подальшою екстракцією у робочий розчин); однак, такі методи мають суттєвий недолік – застосовується обмежена кількість крові, що може містити недостатню кількість плідної ДНК. Такого недоліку позбавлені методи виділення із застосуванням різноманітних неорганічних сорбентів, але вони менш чутливі. Тому на даний час методики виділення вільної циркулюючої ДНК плідного походження знаходяться на етапі вдосконалення.
Окрім того, на сучасному етапі достовірність отриманого результату не досягла 100%, що пов’язують як зі специфікою структури фетальної позаклітинної ДНК (висока фрагментація та нестабільність, низька концентрація), так і з підбором високоспецифічних маркерних фрагментів з урахуванням вищевказаних особливостей.
Лікування гемолітичної хвороби плода
До теперішнього часу етіопатогенетичних методів лікування ГХ плода у початковій стадії розвитку не існує.
Лікування ізосерологічної несумісності крові матері і плода не проводять. Сьогодні визнані неефективними методи, що знижують ступінь сенсибілізації (рівень титру АТ) під час вагітності: неспецифічна десенсибілізуюча терапія, трансплантація шкірного клаптя від чоловіка, гемосорбція, плазмаферез. Останній метод може використовуватися лише на етапі передгравідарної підготовки.
На сьогодні можна стверджувати, що основним методом («золотим стандартом») лікування важких форм ГХ плода є проведення внутрішньоутробного переливання (ВПК) відмитих/фільтрованих еритроцитів донора у вену пуповини під ультразвуковим контролем. У деяких клініках ВПК проводиться під внутрішньопечінковий відділ пуповинної вени. Запропоновані раніше інтраперитонеальне, а також інтракардіальні переливання крові у даний час практично не проводяться.
ВПК плода підвищує рівень гемоглобіну і гематокриту, знижує ризик розвитку набрякової форми ГХ і дозволяє пролонгувати вагітність. Показанням до ВПК є зниження показників гемоглобіну і гематокриту на 15% і більше по відношенню до гестаційної норми. При відсутності набряку у плода після переливання спостерігається повна нормалізація показників його крові, зокрема, гематокрит підвищується у середньому в 1,9 разів. Навіть при важкій гемолітичній анемії на тлі розвиненого набряку у плода цей метод дозволяє здійснити повну корекцію анемії при збільшенні значень гематокриту в 3 рази (при тяжкій анемії гематокрит після ВПК не можна підвищувати більш, ніж у 4 рази за одну гемотрансфузію). ВПК можуть проводитися неодноразово до 32–34-х тижнів вагітності, після цього строку вирішується питання про дострокові пологи. У більш пізні терміни перед пологами відбувається посилення транспорту ізоантитіл через плаценту і наростання тяжкості ГХ.
Інвазивні маніпуляції проводяться методом «вільної руки», одно- або двоголковим способом, голками 18G–22G під ультразвуковим контролем, місцевою анестезією і токолізом. Трансамніально або трансплацентарно виконується кордоцентез і пункція кореня пуповини або її вільної петлі.
Релаксація плода (тільки для трансфузії) досягається введенням у вену пуповини розчину Ардуану в дозі 0,05–0,08 мг на кілограм передбачуваної маси плода.
При набряковому синдромі плода необхідно визначати каріотип. У разі зниження гемоглобіну менше 90 г/л і гематокриту менше 30% плода, проводять трансфузію крові, відповідно до регламентуючих нормативних документів.
Обсяг трансфузії визначається за формулою: V=Ht3–Ht1/Ht2 x ПМПх V1, де V – необхідний обсяг трансфузії, Ht1 – передопераційний гемотокрит плода, Ht2 – гематокрит донорської крові, Ht3 – нормальний рівень гематокриту для даного гестаційного віку, ПМП – передбачувана маса плода, V1 – ОЦК плода для даного терміну вагітності. Також обсяг розраховується за спеціальними номограмами.
Для розрахунку обсягу трансфузії також можуть використовуватися показники гемоглобіну. Окремі клініки практикують внутрішньоутробні замінні переливання крові плода, які виконуються невеликими обсягами у процесі трансфузії, виходячи з обсягу ОЦК плода і його гестаційного віку.
Повторне ВПК призначається, виходячи із середньої швидкості падіння гематокриту 1–2% на добу. Зниження рівня гематокриту пояснюється подальшим зростанням плода, збільшенням фетоплацентарного обсягу і, частково, руйнуванням донорських еритроцитів. При використанні ПСШ кровотоку в СМА, у якості критерію відбору для повторного ВПК вже після другої гемотрансфузії рекомендується застосувати порогове значення 1,4 Мом, з кожним наступним ВПК істотно зростає похибка при оцінюванні ПСШ в СМА, частіше у бік хибно-негативного результату.
Зазвичай для внутрішньоутробних трансфузій застосовують донорські «відмиті» еритроцити з терміном зберігання не більше 24 год. з гематокритом 80–85%. Крім того, для фетальної гемотрансфузії при гемолітичній хворобі плода стали використовувати свіжу фільтровану еритроцитарну масу (збіднену на лейкоцити і тромбоцити ЕМЗЛТ 0 (I) RH (-) нег.
Використання свіжих відмитих еритроцитів 0 (I) RH (-) нег. для цієї мети до теперішнього часу практикується у різних країнах світу, проте відмиті еритроцити поступаються за рядом своїх якостей фільтрованим еритроцитам, одержаним за допомогою більш досконалих технологій, які мають меншу травматизацію, кращі реологічні властивості, значно більшу тривалість «життя» і термін зберігання за рахунок того, що при їх виготовленні використовуються замкнуті, закриті системи пластикових контейнерів для донорської крові та її компонентів з інтегрованим лейкофільтром, у той час як відмиті еритроцити виходять за допомогою 3–5-кратного відмивання у фізіологічному розчині NaCL, кожен раз з видаленням надосадової рідини після центрифугування, що збільшує механічне навантаження на еритроцити.
Оскільки відмивання ЕМ проводиться у відкритій системі, термін її зберігання до використання (через ризик бактеріального забруднення) – не більше 24 годин при температурі +1–+6ОС.
На відміну від фільтрації, відмивання повністю не очищає ЕМ від клітин лейкоцитарного ряду, що зберігає деяку небезпеку ізосенсибілізації, а також повністю не рятує ЕМ від трансмісії вірусів гепатиту, ВІЛ, цитомегаловірусу та інших інфекцій. Крім того, у вимитій в сольовому розчині ЕМ через 24 години збільшується рівень вільного гемоглобіну, тобто відбувається гемоліз еритроцитів і понад 35–40% еритроцитів руйнується (термін життя вимитої ЕМ можна збільшити до 3–4 діб і більше, якщо відразу після відмивання у пакет додати 50–100 мл декальцинованої модифікованої желатинолі, однак це суттєво знизить показник гематокриту і вимагатиме збільшення обсягу трансфузії плода). Тому краще використовувати фільтровану ЕМЗЛТ.
Переливання здійснюється за допомогою шприців об'ємом 10 мл через систему, що складається з провідника і триходового крана, у вену пуповини зі швидкістю від 1 до 5–10 мл/хв., але не більше.
Для верифікації положення голки у вені пуповини використовують такі критерії: оцінка положення голки в В-режимі, колір витягуваної крові (з вени вона яскраво червона), візуалізація потоку розчину піпекуронія у вені пуповини. Пункція артерії у 5 разів збільшує ризик брадикардії та може стати причиною асистолії у плода. Протягом всієї операції здійснюється спостереження за положенням голки, потоком донорської крові у вені пуповини, видимим в В-режимі та режимі КДК, і серцебиттям плода (зміщення голки може викликати різні ускладнення: гематому, наскрізну перфорацію вени, кровотечу та ін.)
Перед початком та у кінці трансфузії проводиться експрес-оцінка показників гемоглобіну і гематокриту. Трансфузія завершується при досягненні гематокриту 48–55%, у разі водянки плода – 40–45% (або менше у залежності від стану плода).
Контроль за станом плода під час ВПК, щоб уникнути перевантаження його серцево-судинної системи і розвитку важкої брадикардії, проводиться шляхом постійного кардіомоніторного спостереження за серцевим ритмом.
Для знерухомлення плода внутрішньосудинно вводиться міорелаксант піпекуроній (ардуан). Ардуан не пригнічує серцеву діяльність у плода та у дозі 0,05 мг на 1 кг розрахункової маси плода викликає повну його іммобілізацію протягом 40–50 хвилин. Знерухомлення плода дозволяє скоротити тривалість внутрішньоматкових втручань, значно знизити частоту випадків виходу кінця пункційної голки з просвіту судини пуповини і, отже, уникнути трансфузії крові донора в амніотичну порожнину і необхідності виконання повторних кордоцентезів з метою продовження переливання. Введені до плода міорелаксанти сприяють збільшенню частоти серцевих скорочень. Без них виникають брадикардії (особливо при водянці плода) і зниження серцевого викиду, який необхідний для виведення кислих продуктів консервованої крові. Ардуан дозволяє зберегти частоту серцебиття плода на попередньому рівні. Для зменшення стресу плода при тривалій імобілізації доцільно введення: фентанілу 10 мкг/кг із наступним введенням піпекуронія броміду 50–60 мкг/кг на тлі попередньої премедикації матері – гідазепам 40–60 мг всередину; атропін 0,5–0,7 мг в/в; седація пропофолом – за показаннями.
Навіть при набряку плода показники червоної крові можуть бути успішно кориговані.
Ризик ускладнень, безпосередньо пов'язаних з діагностичними втручаннями при проведенні тільки кордоцентезу, незначно перевищує 1%. При проведенні тривалих внутрішньоматкових втручань – а саме такими є трансфузії – ризик підвищується до 2,6–4,0%.
Можливі ускладнення кордоцентезу і фетальної гемотрансфузії
- кровотеча з місця пункції;
- транзиторна брадикардія;
- рефлекторна асистолія;
- спазм судин;
- гематома і тампонада пуповини;
- тромбоз судин пуповини;
- розрив оболонок амніону;
- внутрішньоутробне інфікування, хоріонамніоніт;
- дистрес плода;
- загибель плоду;
- смерть новонародженого.
Тому ВПК повинні виконувати лікарі, які досконально знають проблему ГХ плода і мають великий особистий досвід проведення інвазивних пренатальних втручань під контролем ехографії. В той же час, у досвідчених руках фетальна гемотрансфузія є достатньо безпечною процедурою.
Існують деякі особливості застосування фетальних трансфузій у плодів з анемією і набряковою формою ГХ. Набрякова форма ГХ може розвиватися вже протягом II триместру вагітності і в цьому випадку практично 100% таких плодів гинуть антенатально до 30-го тижня вагітності.
Водянка плода розвивається при вираженій анемії, коли гемоглобін знижується на 6–7 D (стандартних відхилень) відносно нормативних значень для даного гестаційного віку плода. Тим не менше, навіть при набряку плода показники червоної крові можуть бути успішно кориговані. Однак при проведенні переливання тільки ЕМЗЛТ донора, незважаючи на повну нормалізацію показників крові у плода, набряк зникає після першого переливання лише у третини плодів. Тому був розроблений метод поєднаного переливання плоду ЕМЗЛТ 0 (I) RH (-) нег. донора і 20% розчину альбуміну у співвідношенні 5:1. Така терапія призводить до зникнення вираженого набряку у всіх плодів. При цьому відбувається нормалізація як показників червоної крові, так і вмісту сироваткового альбуміну.
В той же час, у зв’язку з тим, що альбумін дуже швидко втрачається з судинного русла й переходить у тканини, багато дослідників все ж таки вважають недоцільним використовувати альбумін для фетальних трансфузій.
Незважаючи на те, що плоди досить толерантні до анемії, з її прогресуванням розвивається метаболічний ацидоз і збільшується вміст лактату.
Точний механізм розвитку набряку плода залишається до кінця не ясним. Серцева недостатність, що розвивається у 90% плодів і пов'язана з гіпоксичним ураженням міокарда, вносить свій внесок у розвиток набряку, про що свідчить швидке зменшення набряку після трансфузії і нормалізації венозного тиску у пуповині.
Нітратна кров має рН 6,98–7,01. Закономірне зниження рН крові після трансфузії є значущим для плода. Встановлено, що всі втрати плодів з набряком були пов'язані саме з ацидемією у плода. Введення 1mEq гідро карбонату натрію (2 мл 4%-го розчину) дозволяє утримати рН на рівні більше 7,3 і збільшити відсоток виживання плодів з водянкою до більше ніж 90%.
Що стосується прогнозу тяжкості ГХ, виживання плодів з тяжкою анемією та ефективності лікування за допомогою фетальних гемотрансфузій, високоінформативним інструментом є оцінка одного з чотирьох типів натрій-уретичних пептидів Nt-pro BNP за допомогою імунохемілюмінесцентного методу. Під час внутрішньоутробного розвитку плоду натрійуретичні пептиди відіграють подвійну роль: на ранніх термінах вагітності вони залучені до процесу ембріокардіоморфогенезу, а у ІІ триместрі вони відображають функціональну спроможність міокарду.
У плодів з анемією спостерігається підвищення рівня натрійуретичного пептиду NT-proBNP вище 10 000 нг/л, особливо при водянці плоду. Показник екскреції NT-proBNP прямо корелює зі ступенем тяжкості анемії та міокардиальної дисфункції. Проведені дослідження показують, що після серії фетальних гемотрансфузій відбувається нормалізація рівня NT-proBNP, що може бути індикатором адаптації серцевої діяльності в умовах коригованої хронічної анемії. Оцінка цього показника може бути корисна при спостереженні плодів з гемолітичною анемією, як предиктора серцево-судинної недостатності, особливо при наявності високого ризику водянки у плодів, що потребують проведення неодноразових внутрішньоутробних гемотрансфузій.
На сьогодні внутрішньоутробна гемотрансфузія визнана єдиним ефективним методом лікування тяжкої гемолітичної анемії плода. Ефективність методу підвищується додатково на 36% при комбінації з внутрішньосудинною імуноглобулінотерапією плоду. Але цей метод є достатньо вартісним (6000 USD – щотижня).
Заключення – ключові положення або основні принципи ведення вагітності при ізоімунізації:
- визначення зиготності Rh-антигенів батька дитини;
- при гетерозиготному батькові необхідно визначення резус статусу плода за допомогою амніоцентезу або шляхом виділення фетальної ДНК з крові матері;
- при позитивному Rh-факторі плода: УЗ-моніторинг ПСШ в СМА; це дозволяє більш ніж на 70% знизити кількість інвазивних процедур, частина з яких супроводжується втратою вагітності і значно поліпшити перинатальні наслідки при імуноконфліктній вагітності;
- у разі перевищення ПСШ в СМА >1,5 МОМ провести кордроцентез і внутрішньоутробну гемотрансфузію ЕМОЛТ 0 (I) Rh-отр. для корекції анемії;
- для подружньої пари з ізоімунізацією вагітної, особливо при втраті плода в анамнезі, з важкою формою гемолітичної хвороби, сучасні методи лікування ГХ, в тому числі внутрішньоутробне переливання донорської ЕМЗЛТ плоду, по суті, є єдиною можливість доносити і народити дитину.

Розродження вагітних з гемолітичною хворобою плода
Час розродження вагітних жінок при резус-конфлікті залежить від наявності та ступеня тяжкості гемолітичної хвороби плода, акушерського анамнезу та поточних результатів антенатального догляду. При відсутності клінічних прояв гемолітичної хвороби плоду (у т. ч. доплерометричних ознак анемії) розродження проводиться у 38 тижнів вагітності. При ГХП легкого та середнього ступеню важкості, компенсованому стані плоду, при наявності зрілих пологових шляхів можливі природні пологи у термін понад 34 тижні вагітності. Враховуючи, що прогностична цінність максимальної систолічної швидкості кровообігу в СМА плода після 35 тижнів знижується (зростає доля хибнопозитивних результатів), на більш пізніх термінах вагітності можливо виконання амніоцентезу для визначення показника концентрації білірубіна у навколоплідних водах та відповідно тяжкості ГХ.
При наявності важкої наростаючої анемії (у т. ч. субкомпенсованої завдяки в/у гемотрансфузіям) водянці, дистресі або сумнівному стані плода, розродження плода проводиться при досягненні зрілості легень плода або на тлі профілактики РДС (у терміні до 34 тижнів вагітності) за допомогою кесарського розтину.
Найближчий постнатальний прогноз
Що стосується ведення новонароджених з ГХ, які перенесли внутрішньоутробні гемотрансфузії, то у відомому Наказі МОЗ України №255 від 27.04.2006 «Про затвердження клінічного протоколу надання неонатологічної допомоги дітям "Жовтяниця новонароджених”» немає абсолютно ніякої інформації щодо особливостей їх стану, тактики подальшого ведення та спостереження.
У той же час відомо, що у певної кількості дітей можуть проявитися серйозні проблеми у вигляді пізньої пролонгованої гемолітичної анемії, або пізньої гіпогенераторної анемії, значно рідше – гіпо/апластичної анемії.
Гіпорегенераторна анемія – не стільки нозологічне, скільки функціонально-морфологічне поняття.
Найчастіше вона виникає як кінцева стадія розвитку хронічної постгеморагічної або аутоагресивної гемолітичної анемії при великій тривалості процесу, а також у зв'язку із загальною інтоксикацією (азотемією і пр.) і виснаженням необхідних для побудови еритроцитів субстанцій – заліза, білків, вітамінів, мікроелементів.
Гіпорегенераторна анемія у новонароджених характеризується неефективним еритропоезом у новонародженого, що проявляється недоліком еритроцитів у периферичній крові і низьким рівнем або відсутністю ретикулоцитів. Цей стан спостерігається у пацієнтів, які перенесли кілька в/у гемотрансфузій (але механізми її точно не встановлені).
Крім тривалого гемолізу, серед її причин можливе пригнічення кровотворення у кістковому мозку після в\у ГТ і дефіцит еритропоетину; а також руйнування анти-D пов'язаних еритроцитів, ретикуло-ендотеліальною системою і прямим інгібіторним анти-D-ефектом, попередниками еритроцитів, подібно до дії антитіл системи Kell.
Пізню гіпогенераторну анемію слід диференціювати з так званою пізньою анемією гемолітичної хвороби ("Late anemia of hemolytic disease"), як вважають, викликаної:
- комбінацією триваючого гемолізу;
- скороченням t1\2 перелитих при в\у трансфузії еритроцитів;
- природним зниженням Hb до мінімально критичного фізіологічного рівня;
- швидким збільшенням внутрішньосудинного об'єму плазми у зростаючої дитини.
Диференціальна діагностика
Диференційно діагностичні критерії пролонгованої анемії у новонародженого наведено у табл. 1.
Для дифдіагнозу проводиться аспірація кісткового мозку з визначенням рівня еритропоетину. При гіпорегенераторній анемії кістковомозковий пунктат характеризується:
- пригніченням еритропоезу аж до майже повного зникнення гемоглобінізованих нормобластів, але зі збереженням базофільних форм еритробластів (що свідчить про зберігання резервів кровотворення);
- відзначається також розлад гранулопоезу із затримкою визрівання на мієлопромієлоцитарній стадії;
- порушення тромбоцитопоезу, однак, при збереженні мегакаріоцитів кісткового мозку.
У новонароджених, яким проводилося переливання крові тільки після народження, гіпорегенераторна анемія зустрічається набагато рідше: одна з причин – одночасне зменшення Rh–At при замінних трансфузіях.
Якщо персистує високий титр At, це провокує пролонговану анемію, викликає інтрамедулярну деструкцію.
Стратегія лікування
Стратегія лікування гемолітичної хвороби плода наведена у табл. 2.
Віддалений прогноз
У світі є обмежена кількість публікацій щодо довготривалого катамнезу дітей з тяжкою алоімунною анемією, що перенесли в/у гемотрансфузію.
Рівень ДЦП, вираженої затримки розвитку, двобічної глухоти у таких дітей не перевищує загальної популяційної частоти, у країнах, де проводили такі дослідження.
Загалом неврологічні порушення зустрічалися у 4,8–10% цих дітей.
Фактори збільшеного ризику неврологічних порушень:
- водянка плода;
- часті в\у гемотрансфузії;
- важкі хвороби у неонатальному періоді (асфіксія, сепсис, НЕК, цефало-геморагічні порушення, ПВЛ).
Незалежний фактор впливу на когнітивний розвиток дитини: соціальний статус та освітній рівень батьків.
Таким чином, не менш ніж у 90% випадків дітей з тяжкою ГХ, що в/у перенесли гемотрансфузії, можливо очікувати нормальний неврологічний розвиток.
Детальніше
КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ СОВРЕМЕННЫХ ЛЕКАРСТВЕННЫХ ФОРМ МИКРОНИЗИРОВАННОГО ПРОГЕСТЕРОНА, ПРИМЕНЯЮЩИХСЯ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Результаты анализа демографических показателей за последние 15–20 лет свидетельствуют о том, что Украина находится в состоянии глубокого демографического кризиса. Особую значимость в свете этих данных имеет проблема невынашивания беременности: связанные с ней прямые репродуктивные потери каждый год составляют в Украине 36–40 тыс. неродившихся детей [1], что ставит исследования в данной области в ряд важнейших задач современной медицины
При невынашивании беремености в 85% случаев на разных сроках выявляется недостаточность лютеиновой фазы (НЛФ) [2], с учетом чего ведущей группой препаратов, применяющихся для подготовки к беременности и ее сохранения при НЛФ, являются препараты гормона желтого тела и его аналоги, что является патофизиологически обоснованным способом профилактики и коррекции cвязанных с дефицитом прогестерона состояний.
Жестким требованиям по эффективности и безопасности для матери и плода в наибольшей мере отвечают препараты натурального прогестерона [26].
Натуральный прогестерон синтезируется из диосгенина – стероида растительного происхождения, экстрагируемого из ямса (рода Diascorea), он полностью идентичен прогестерону, продуцируемому яичниками [27]. Причиной отличий натурального и синтетических гестагенов являются особенности их метаболизма: только препараты натурального прогестерона являются субстратами для восстановленных 5a- и 5b-метаболитов, оказывающих специфическое действие на миометрий, половую дифференцировку плода, кожу и клетки мозга [28].
Фармакокинетика прогестерона
Создание микронизированных форм прогестерона [29, 30], благодаря увеличению его биодоступности, расширило возможности введения препарата за счет создания новых лекарственных форм и новых путей его введения, каждый из которых имеет свои преимущества и недостатки.
Основным преимуществом прогестерона для применения внутрь является удобство применения, однако при этом в кровь абсорбируется всего 50–60% дозы вследствие метаболизма препарата из-за эффекта первого прохождения через печень. Биодоступность препарата зависит от приема пищи, различий в наполнении желудка, в кишечном кровообращении и пр., что в ряде случаев мешало созданию предсказуемых концентраций в сыворотке крови [31–36]. Не наблюдается также стабильного поддержания концентрации препарата в сыворотке: через 1 час после приема внутрь уровень прогестерона сыворотки составлял 4,2 нг/мл, через 2 час – 11,7 нг/мл, уже после 4 час – 8,4 нг/мл, снижаясь к 8 часу до 1,6 нг/мл [37]. Показатели сывороточного прогестерона после приема внутрь были ниже, чем после в/м или вагинального введения [38–39] (Табл. 1), причем, даже при хорошем уровне концентрации в сыворотке, в эндометрии она была не очень высокой [40].
К недостаткам энтерального приема препарата относят более высокую частоту таких побочых эффектов как сонливость, головокружение, тошнота и рвота, а также то, что прием прогестерона внутрь может быть затруднен при гастрите и других заболеваниях ЖКТ [34, 41] и невозможен при рвоте беременных во время токсикоза.
Преимуществом внутримышечного (в/м) введения прогестерона является высокая биодоступность. При сравнительном исследовании параметров фармакокинетики после в/м инъекции и при оральном применении было установлено, что в/м применение способствует более быстрому, выраженному и длительному, благодаря депо в жировой ткани, его накоплению в сыворотке крови (Табл. 1) [33]. Для создания эффективных концентраций требуются небольшие дозы препарата: концентрация гормона в сыворотке, наблюдавшаяся в лютеальной фазе, создается после инъекции 25 мг прогестерона [43]. 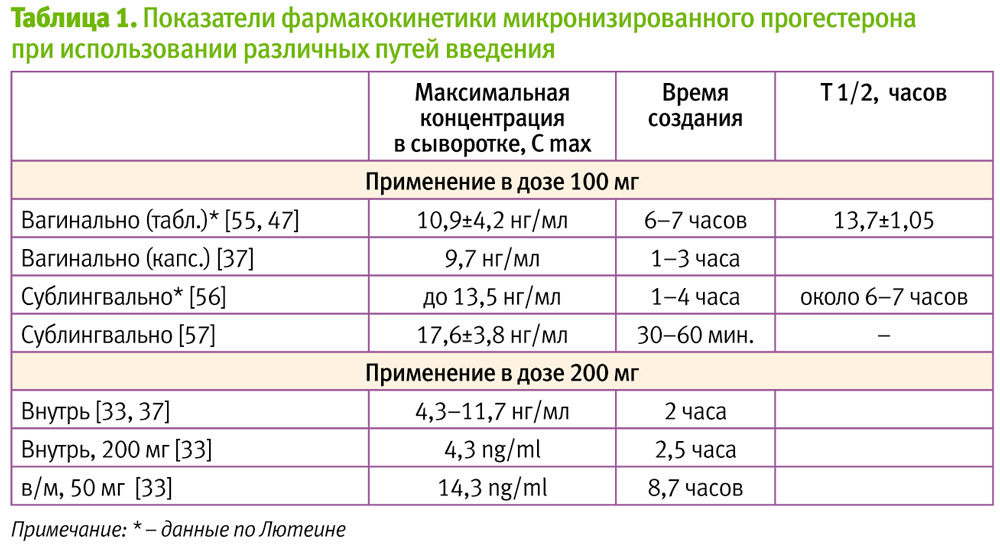
В то же время, применение препарата в/м неудобно (требуется помощь медперсонала) и ассоциируется с большим количеством побочных эффектов. Помимо системных, он оказывает также местные побочные эффекты: кровоизлияния в мышцу, боль в месте инъекции; масляные растворы могут способствовать также появлению олеогранулем, имеется болезненность в месте введения (кроме растворов в этилолеате); описаны случаи эозинофильной пневмонии; препарат не должен применяться у женщин с аллергией на арахисовое масло. Такая форма введения препарата является менее предпочтительной с точки зрения пациенток [44–45].
С учетом сказанного, в последнее время более широко применяется вагинальный прогестерон, более предпочтительный в ряде клинических ситуаций, что обусловлено, прежде всего, его фармакокинетическими характеристиками. Так, показано [39, 46], что при вагинальном применении концентрации прогестерона в плазме более чем в 3 раза выше, чем при оральном приеме, что объясняется хорошим всасыванием препарата со слизистой влагалища и отсутствием эффекта первого прохождения его через печень, в связи с особенностями анатомии венозных сосудов данной локализации. В то же время, эти концентрации ниже, чем после в/м введения [39], поэтому для достижения уровня гормона в сыворотке, соответствующего лютеальной фазе, эквивалентными являются дозы прогестерона для вагинального и в/м введения соответственно 100 мг и 25 мг [43].
В ряде работ было показано, что относительно низкие дозы гестагенов (50, 100 и 200 мг) при применении вагинально создают клинически эффективные концентрации в матке, несмотря на невысокий уровень гормона в плазме крови [47, 48], что объясняют накоплением гормона в высоких концентрациях именно в эндометрии, причем в концентрациях даже более высоких, чем при в/м введении: после вагинального введения 200 мг прогестерона в эндометрии создавалась концентрация 11,50±2,60 нг/мг, а после в/м инъекции 50 мг препарата – намного меньшая, 0,30±0,10 нг/мг [49, 50]. Подобное несоответствие объясняют «эффектом первого прохождения через матку» – накоплением препарата в высокой концентрации в матке благодаря хорошей резорбции из влагалища через его богатую венозную и лимфатическую систему [51–54]. Благодаря этой особенности фармакокинетики вагинально применяемый прогестерон отличается высокой клинической эффективностью. Не менее ценна особенность вагинального микронизированного прогестерона, которая также имеет значение для его клинической эффективности – создание стабильной концентрации препарата в сыворотке между введениями [18].
При сравнении (согласно инструкциям к препаратам) сывороточных концентраций прогестерона, создаваемых при введении различных его лекарственных форм – вагинальных таблеток ЛЮТЕИНА [55] и вагинальных капсул [37], обращают на себя внимание более высокие концентрации прогестерона сыворотки, создаваемые после введения вагинальных таблеток (Табл. 1) и составляют, соответственно, 10,9 и 9,7 нг/мл прогестерона.
Что не менее важно, вагинальные формы микронизированного прогестерона отличаются лучшей переносимостью и меньшим количеством побочных эффектов по сравнению с наблюдавшимися при применении гормонального препарата другими путями (в/м, внутрь) [58, 59]: клинический опыт свидетельствует, что диспепcические расстройства возникают в 2 раза реже, боль в животе – в 2,3 раза, головная боль – в 1,8 раза, сонливость – в 6 раз реже, чем в группах сравнения; метаболические эффекты микронизированного вагинального прогестерона также были выражены слабее, чем при системном энтеральном применении [60]. К недостаткам вагинальной лекарственной формы можно отнести возникающие иногда ощущения дискомфорта, раздражения и жжения, а также неудобство применения этой лекарственной формы при вагинальных кровотечениях (если кровотечение сильное, препарат может вымываться) [61, 62]. Определены некоторые ограничения по применению прогестерона вагинально. Как было показано в нерандомизированном исследовании [63], его использование в лечении женщин с цервикальной дисплазией 1 ст. замедляло регрессию дисплазии, что ассоциировалось с более длительным ее лечением/прогрессированием/потребностью в хирургическом лечении, однако в инструкции к препарату цервикальная дисплазия как противопоказание не зафиксирована.
С учетом сказанного, анализируя соотношение «польза–риск», в последнее время большинство авторов более предпочтительным считают вагинальный путь введения, основным преимуществом которого является возможность применения меньших доз прогестерона, обеспечивающих высокий уровень терапевтического действия – благодаря эффекту первого прохождения через матку, и вызывающих меньшее количество системных и местных побочных эффектов благодаря меньшим сывороточным концентрациям гормона [64].
Для достижения быстрого и сильного эффекта с минимальным побочным действием возможен также выбор сублингвального пути введения микронизированного прогестерона [55, 65].
В 2009 г. в Украине зарегистрирована инновационная лекарственная форма прогестерона – таблетки для сублингвального применения ЛЮТЕИНА 50 мг (Адамед, Польша). Благодаря отсутствию эффекта первого прохождения через печень и хорошей абсорбции с места введения, при их использовании создается высокая концентрация в сыворотке крови, на 39–71% превышающая концентрацию при вагинальном введении таблеток и капсул [37, 47, 55–57], а также существенно более высокая, чем создаваемая при энтеральном приеме удвоенной (!) дозы [33, 37], однако сопоставимая с концентрацией, возникающей при парентеральном введении [33, 56, 57] (Табл. 1).
Как установлено [56], для регуляции секреторного обмена эндометрия и сохранения беременности требуются концентрации прогестерона в сыворотке крови в пределах 12–15 нг/мл, соответствующие физиологической ранней лютеальной фазе. Надежное достижение такой концентрации также является преимуществом сублингвальных лекарственных форм перед применяемыми энтерально (Табл. 1), что подтверждатся результатами исследований [65] по сравнению уровней прогестерона сыворотки после введения микронизированного прогестерона сублингвально (ЛЮТЕИНА, сублингвальные таблетки, 100 мг 3 раза в день) и дидрогестерона внутрь (10 мг 3 раза в день): в группе получавших Лютеину уровень прогестерона сыворотки был выше на 23%.
Cистемные побочные эффекты микронизированного прогестерона при сублингвальном применении были незначительны [56]: отмечались единичные случаи сонливости, нарушений концентрации внимания, страха, депрессивные состояния, головная боль, головокружение, тошнота, редко – дисменорея, кровомазание, аменорея, покраснение кожи, угри, аллергические реакции, холестатическая желтуха.
Благодаря описанным фармакокинетическим преимуществам сублингвальной лекарственной формы – отсутствию эффекта первичного прохождения через печень и исключению пресистемного метаболизма, удобству применения (в том числе при рвоте) и хорошей переносимости, она может стать хорошей альтернативой другим лекарственным формам прогестерона, прежде всего энтеральным и препаратам для в/м введения, применяемым для поддержки беременности.
Клинические аспекты применения прогестерона
Использование гестагенов при угрозе выкидыша регламентируется Клиническим протоколом по акушерской помощи «Невынашивание беременности» (дополнение к приказу МЗУ №624 от 03.11.2008) [66]. В соответствии с ним, для лечения угрожающего аборта при наличии показаний используются различные препараты прогестерона: масляный раствор для в/м применения, микронизированный прогестерон для вагинального и перорального применения, синтетические производные прогестерона для энтерального применения. Первая и на данный момент единственная сублингвальная форма прогестерона – таблетки ЛЮТЕИНА – была зарегистрирована уже после создания Клинического протокола в Украине, в 2009 году. Дозы и сроки использования гестагенов протоколом не регламентированы.
При вагинальном применении микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки, 100 мг 2 раза в день) при угрозе прерывания беременности в сроке от 4–5 до 10–11 нед. у получавших препарат в 1 и 11 триместрах не отмечалось прерывания беременности до 22-й недели, была продемонстрирована высокая клиническая эффективность и хорошая переносимость интравагинальных таблеток. Через 5 нед. лечения редуцирование симптоматики позволило уменьшить дозу для дальнейшего применения до 50–100 мг [67]. Один из механизмов благоприятного воздействия прогестерона был раскрыт в рандомизированном двойном плацебо-контролируемом исследовании [68], в котором сравнивали эффекты различных форм прогестерона на маточно-плацентарное кровообращение на раних стадиях беременности (до 12 нед.). Использование вагинального (ЛЮТЕИНА), но не орального прогестерона (дидрогестерон), способствовало снижению индекса пульсации спиральных артерий и индекса резистентности. Анализ индексов сопротивления спиральной артерии свидетельствовал, что применение именно вагинального прогестерона лучше снижало повышенное сосудистое сопротивление в данных сосудах, улучшая доставку кислорода и питательных веществ к эмбриону, что делает более предпочтительным применение именно вагинальной лекарственной формы.
Группой очень высокого риска по невынашиванию беременности являются женщины с лейомиомой матки (угроза прерывания беременности почти в 75% случаев!). Сублингвальную форму микронизированного прогестерона (ЛЮТЕИНА) применяли [65] по 100 мг 3 раза в день, препарат сравнения (дидрогестерон) использовали по 10 мг 3 раза в день внутрь. При использовании прогестерона сублингвально отмечались достоверно более быстрый регресс УЗ-маркеров угрозы прерывания беременности (нормализация толщины миометрия, регресс ретрохориальной гематомы), было отмечено меньшее количество осложнений беременности и меньшая продолжительность пребывания в стационаре. Концентрация прогестерона в плазме крови при приеме Лютеины была достоверно выше (на 23,9%), что, в свою очередь, опосредованно свидетельствовало о более высокой его концентрации в матке, необходимой для сохранения беременности.
Критерием выбора дозы прогестерона может быть, по данным исследований [69], не только выраженность клинических признаков угрозы прерывания беременности, но и уровень гормона в сыворотке. Беременным с нормальным уровнем гормона назначали по 50 мг микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки) 2 раза в день, у беременных с дефицитом прогестерона до 35% использовали по 100 мг (2 таблетки) 2 раза в сутки; а женщинам с дефицитом прогестерона более 53% назначали по 150 мг прогестерона (3 таблетки) 2 раза в сутки. Под действием препарата была ликвидирована угроза выкидыша в I группе на 100%, во II–III группах сохранили беременность в 86 и 62% случаев, что объясняли изначально неблагоприятным в них прогнозом беременности.
Важным условием, определяющим выбор препарата для лечения, является его безопасность. Был проведен мониторинг [70] всех возможных нежелательных явлений и оценка переносимости природного микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки) у пациенток с симптомами угрозы выкидыша во время І триместра беременности. Полученные результаты клинического исследования свидетельствовали об отсутствии местных или системных побочных реакций.
Общепризнано, что при полиэтиологической природе преждевременных родов (ПР) именно снижение выработки прогестерона яичниками и плацентой приводит к повышению риска прерывания беременности на различных сроках ее развития. Результаты многочисленых исследований проблемы ПР [4, 71–74] нашли отражение в ряде международных практических рекомендаций и стандартов. В соответствии с указаниями комитета Американской коллегии акушеров и гинекологов (2008), всем женщинам со спонтанными ПР в анамнезе для профилактики повторного случая ПР целесообразно использовать препараты прогестерона [75].
В рекомендациях Польской гинекологической ассоциации (2012) рекомендуется применение гестагенов для профилактики преждевременных родов в одноплодных беременностях: 1) у беременных с преждевременными родами в анамнезе и шейкой матки длиной более 25 см — 17-альфа-гидроксипргестерона капроат внутримышечно в дозировке 250 мг/неделю; 2) у беременных с преждевременными родами в анамнезе и/или шейкой матки длиной менее 25 см – вагинально прогестерон 90–200 мг/сутки [14]. В соответствии с приказом № 624 МЗ Украины (2008), при лечении привычного невынашивания беременности для профилактики ПР рекомендуется лечение состояний, которые сопровождаются дефицитом эндогенного прогестерона (недостаточностью лютеиновой фазы).
Применение прогестерона при использовании вспомогательных репродуктивных технологий (ВРТ)
Даже при одноплодной беременности после экстракорпорального оплодотворения (ЭКО) частота самопроизвольных абортов составляет 20–45%, частота ПР — 18–36%, причем одной из причин этого является дефицит прогестерона [23]. В Кокрановском обзоре [76] была подтверждена целесообразность поддержки лютеиновой фазы при ЭКО с использованием агонистов ГнРГ: клинические данные об исходах ЭКО были существенно лучше при допольнительном использовании гонадотропина хорионического (ГХЧ) или прогестерона по сравнению с использованием только ГнРГ. Наименее эффективным оказался пероральный прием, результаты при в/м и вагинальном пути введения статистически не отличались [76, 77]. Одиним из механизмов протективного действия прогестерона вляется адекватная подготовка эндометрия к имплантации. Полноценное развитие пиноподий – маркера окна имплантации – было отмечено при использовании микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки, 500 мг/сут в 2 приема) [78]. Было установлено [79], что у женщин, страдающих бесплодием в сочетании с очаговым аденомиозом, применение Лютеины вагинально по 100 мг 2 раза в день (5–25 день менструального цикла, 3 мес.) с целью подготовки к программе ЭКО приводило к подавлению секреции эстрогенов и пролиферативных процессов в эндометриоидных гетеротопиях, что способствовало повышению частоты имплантаций на 12% и благоприятно сказывалось на частоте вынашивания беременности и родов. При использовании протоколов, в которых не использовались аналоги ГнРГ (без дефекта лютеиновой фазы), потребности в применении гестагенов не было [80–82].
В программах донорства ооцита женщины реципиенты нуждаются в применении прогестерона, причем для нормального развития эндометрия они нуждаются в использовании также и эстрогенов, чередующихся с прогестероном [83, 84]. При оценке различных лекарствнных форм и путей введения прогестерона в циклах донации ооцита установлено, что показатели сывороточного прогестерона после орального его применения были ниже, чем после в/м или вагинального введения (39); лекарственная форма прогестерона для сублингвального применения, в отличие от орального, имела эффективность, сопоставимую с наблюдавшейся при в/м введении [85].
В США, Европе [86] и других странах микронизированный вагинальный прогестерон одобрен для поддержки беременности в 1 триместре у пациенток после ВРТ. 408 центров в 82 странах мира (284 600 циклов ЭКО; Западная Европа, США, Канада, Африка и др.), в 77% случаев назначали своим пациенткам именно вагинальный прогестерон. Важно, что синтетические гестагены (в т. ч. дидрогестерон) не фигурируют среди назначений репродуктологов в этих странах [87, 88]. Рекомендации по продолжительности применения прогестерона при ЭКО варьируют: рекомендуются как короткие, так и более длительные курсы его применения.
Одним из широко применяемых препаратов микронизированного прогестерона является ЛЮТЕИНА (Адамед, Польша), зарегистрированный в Украине с 2006 года.
Подводя итоги проведенного анализа литературы, можно выделить несколько заслуживающих внимания отличительных особенностей этого препарата:
- Содержит натуральный прогестерон, идентичный вырабатывающемуся в организме.
- Микронизированная форма прогестерона в препарате обеспечивает хорошее проникновение через слизистые оболочки и, соответственно, высокую его биодоступность.
- Имеет 2 лекарственные формы: вагинальные таблетки 50 мг и сублингвальные таблетки 50 мг, что позволяет выбрать путь введения, более предпочитаемый пациенткой.
- Сублингвальная лекарственная форма является инновационной для прогестерона и имеется только у препарата ЛЮТЕИНА (Адамед).
- Обе лекарственные формы – сублингвальная и вагинальная – обеспечивают попадание микронизированного прогестерона в организм, минуя печень, что позволяет избежать «эффекта первого прохождения через печень», увеличить биодоступность микронизированного прогестерона, уменьшить применяемые дозировки, нагрузку на печень и, соответственно, риск проявления гепатотоксичности.
- При использовании вагинальных таблеток, благодаря всасыванию через обширную сеть венозных и лимфатических сосудов, создается «эффект первого прохождения через матку»: при невысоких концентрациях прогестерона в сыворотке создаются высокие концентрации в эндометрии, обеспечивая высокую клиническую эффективность прогестерона при использовании в небольших дозах.
- При использовании вагинальных таблеток, благодаря невысокому уровню прогестерона в сыворотке крови, препарат проявляет хорошую переносимость, практически не вызывая системных метаболических побочных эффектов, характерных для энтеральных и парентеральных лекарственных форм прогестерона (влияния на свертываемость крови, углеводный и липидный обмен, задержку жидкости и пр.).
- При использовании вагинальных таблеток редко встречаются местные побочные эффекты.
- При использовании сублингвальных таблеток сохраняются преимущества энтеральной лекарственной формы (удобство применения, соответственно, более высокое качество жизни), но нет ее главного недостатка – эффекта первого прохождения через печень, следствием чего являются снижение биодоступности прогестерона и потребность в повышении дозы.
- Дозировка 50 мг в обоих видах таблеток – сублингвальных и вагинальных – позволяет обеспечить подбор дозы препарата в зависимости от конкретной ситуации, поддержание его концентрации в организме на нужном уровне (прием сублингвальных таблеток 3–4 раза в день), а также создает возможность постепенной отмены препарата, которая нередко рекомендуется при использовании гормональных препаратов.
- Активность препарата ЛЮТЕИНА при использовании для поддержки лютеиновой фазы изучена в ряде исследований, где препарат сравнивался с референтными препаратами, и показана сходная или более высокая клиническая эфективность.
- Микронизированный прогестерон – действующее вещество препарата ЛЮТЕИНА – не обладает тератогенной и мутагенной активностью.
- Существенным преимуществом препарата ЛЮТЕИНА является его ценовая доступность, что, наряду с отмеченными выше эффективностью и хорошей переносимостью, является немаловажным критерием при выборе препарата для длительного лечения.
Режим применения препарата Лютеина (вагинальные таблетки) при привычном и угрожающем выкидышах: вводят 50–150 мг прогестерона (1–3 вагинальных таблетки 50 мг) 2 раза в день. В случае привычных выкидышей введение Лютеины нужно начать во время цикла, когда запланирована беременность, или раньше. Лечение нужно продолжать непрерывно приблизительно до 18–20 недели беременности [55].
Режим применения препарата Лютеина (сублингвальные таблетки) при привычном невынашивании и угрозе самопроизвольного аборта: применяют по 100 мг прогестерона (2 сублингвальных таблетки Лютеина 50 мг) 3–4 раза в день. В случае привычного невынашивания применение Лютеины нужно начать во время цикла, в котором запланирована беременность или раньше (прегравидарная подготовка за 3–4 месяца). Лечение нужно продолжать непрерывно приблизительно до 18–20 недели беременности [56].
Режим применения препарата Лютеина (вагинальные таблетки) в программах искусственного оплодотворения: вводят вагинально по 150–200 мг прогестерона (3–4 таблетки) 2 раза в день. Лечение продолжают непрерывно до 77-го дня после перемещения зародыша. Завершают лечение путем постепенного уменьшения дозы [55].
Режим применения препарата Лютеина (сублингвальные таблетки) в программах оплодотворения in vitro (экстракорпорального): применяют по 100–150 мг прогестерона 3–4 раза в день сублингвально [56].
Список литературы находится в редакции.
Детальніше
