Ведення вагітних зі спадковими коагулопатіями (частина 1)
Шановні колеги! Вашій увазі надаємо короткий огляд порад науковців з ведення вагітних зі спадковими коагулопатіями*. Станами, що розглядаються в даному керівництві є гемофілії А і В, хвороба фон Віллебранда (ХФВ), дефіцит XI фактора згортання, рідкісні дефіцити факторів згортання, розлади взаємодії фібриногену, синдром Бернарда–Сульє (СБС), тромбастенія Гланцманна (ТГ) та інші тромбоцитарні розлади
Детальніше
Покращення репродуктивних наслідків шляхом виконання процедури локальної екскоріації ендометрію
Шановні колеги! Надаємо вашій увазі огляд рекомендацій зі стратегії лікування після локальної травми ендометрію та поліпшення рівня імплантації. Існує багато механізмів, які прямо чи опосередковано впливають на успішне виконання курсів екстракорпорального запліднення (ЕКЗ), тому наведемо основні фактори, які будуть сприяти покращенню репродуктивних наслідків
ДетальнішеГетерогенність пуповин – фактор, що впливає на отримання мезенхімальних стовбурових клітин
Клітинна терапія вважається провідним напрямком у регенеративній медицині. За допомогою введення клітинного матеріалу можуть бути вирішені складні питання у лікуванні багатьох патологічних станів. Проте, за роки досліджень у цій галузі, стало зрозуміло, що ключовими проблемами при використанні клітинного матеріалу є підбір безпечного та багатого на клітини джерела, підтримання культур у стабільному стані при максимальному нарощенні маси, стандартизація, запобігання злоякісній трансформації клітин та швидкому старінню популяції, моделювання імунної відповіді пацієнта-реципієнта, підвищення ефективності потрапляння введеного матеріалу до ділянок, що найбільш його потребують тощо [J. Ankrum and J. M. Karp, “Mesenchymal stem cell therapy: two steps forward, one step back”, Trends in Molecular Medicine, vol. 16, no. 5, pp. 203–209, 2010].
Детальніше
Розбіжність шляхів розвитку послідів чоловічої та жіночої статі
Sexual dimorphism in the formation, function and adaptation of the placenta
Першоджерело: Review: Sexual dimorphism in the formation, function and adaptation of the placenta. Placenta June 2017 Volume 54, Pages 10–16
Автори: J. I. Kalisch-Smith, D. G. Simmons , H. Dickinson, K. M. Moritz
DOI: http://dx.doi.org/10.1016/j.placenta.2016.12.008
Переклад українською: Олексій Соловйов
Відповідь зародка чи плода на внутрішньоутробні ускладнення може призводити до внутрішньоутробної затримки росту, що є первинним чинником ризику для розвитку хвороб у дорослих. Проте, незважаючи на схожі відповіді, схильність до хвороб або їх розвитку на різних стадіях життя у хлопчиків та дівчаток часто відрізняється.
Зростання плода в значній мірі опосередковується плацентою, яка, як і плід, генетично є XX або XY. Послід та пов'язані з ним трофобласті лінії походять від трофектодерми (ТЕ) раннього зародка. Для вивчення розвитку плаценти широко використовуються моделі гризунів (щур, миша, голчаста миша), і вони показали, що траєкторія росту плаценти у плодів жіночої статі, як правило, є повільнішою, ніж у плодів чоловічої статі, і також виказує зміни адаптивних реакцій на стресові умови. Схоже, що ці плацентарні адаптації залежать від типу чинника стресу, тривалості його дії, тяжкості та вікна впливу впродовж розвитку.
Автори огляду описують розбіжність шляхів розвитку послідів чоловічої та жіночої статі, що сприяють зміненій диференціації похідних від трофоектодерми трофобластових підтипів, росту плаценти та особливостей утворення плацентарної архітектури. Увага була зосереджена, перш за все, на тих генетичних або екологічних впливах на моделі гризунів, що демонструють зміну плацентарної чутливості залежно від статі. Тож дослідники вважають, що можливі негаразди під час раннього розвитку послідів можуть мати більший вплив на життєздатність та зростання плодів жіночої статі, тоді як подібні ж впливи, що з'являються пізніше в часі перебігу вагітності, можуть переважно впливати на життєздатність та зростання плодів чоловічої статі.
Ці дані можуть мати велике значення для вагітностей у людини, які виникають внаслідок допоміжних репродуктивних технологій або при таких ускладненнях вагітностей, як прееклямпсія та діабет.
Від упорядника розділу й тлумача Олексія Соловйова:
Ці чергові тези наслідків наукових досліджень світового рівня, що присвячені статево залежним розбіжностям у розвиткові дітей впродовж перебігу вагітностей, мають суто практичне значення у роботі як науковців, так і практичних лікарів. Попри їх позірну віддаленість від щоденної роботи акушерів-гінекологів, фахівців з пренатальної діагностики та медицини плода.
Науковців така чергова стаття має схилити до потреби розглядати будь-які лабораторні, фізикальні чи клінічні дані при наукових дослідженнях перебігу вагітностей, стану плодів чи новонароджених окремо для хлопчиків та дівчаток – це, безсумнівно, призведе до точніших висновків наукових праць та їх практичних наслідків.
Для практиків прекрасним прикладом є калькулятори команди професора E. Gratacos’a (Університет Барселони, Іспанія, Каталонія), де оцінка стану плодів при затримці їх розвитку, наприклад, відбувається залежно від статі плодів – це робить точнішими прогноз та поради щодо подальшого спостереження чи планового або ургентного розродження. Доступ до цих калькуляторів у Павутинні ви легко знайдете на е-сторінці «Фонду Медицини Плода, Україна» fmfua.com/fmc/ у розділі «Корисні е-стежки для лікарів».
ПМ. І зовсім по-простому, даруйте: сказане вище слід зрозуміти й усвідомити таким чином, що іноді плід з чоловічими статевими органами, який впродовж вагітности розвивався відповідно до очікуваних термінів вагітности, але крива гравідограми якого після 35–36 тижнів почала уповільнюватись, «пласкішати», може принести більше неприємних і непередбачуваних несподіванок з неочікувано поганими перинатальними наслідками, ніж плід з жіночими статевими органами, якому вже при УЗД у 29–30 тижнів виставлявся діагноз затримки росту плода І–ІІ ступеня тяжкости!
Детальніше
Инновационные особенности НИПТ в эру молекулярных технологий
Каждая беременная женщина имеет право и должна знать, что с ней происходит, какие исследования проводятся, чтобы владея информацией, принять осознанное решение о дальнейшем развитии беременности и судьбе своего ребенка
Диагностика врожденной патологии плода во время беременности является важнейшей задачей в акушерстве и перинатологии. Раньше это было возможно только при помощи ультразвуковых методов диагностики, а также определенных показателей в биохимическом анализе крови – так называемый комбинированный пренатальный скрининг. Однако, это неспецифический и относительно эффективный метод, который позволяет диагностировать наличие только трех хромосомных заболеваний: синдромов Дауна, Эдвардса и Патау. Статистика показывает, что число рожденных детей с вышеуказанными хромосомными заболеваниями в акушерских стационарах не снижается и ежегодно растет [1].
Еще в 60-е годы прошлого века скрининг на хромосомные аномалии проводился всем женщинам старше 35 лет в виде инвазивной процедуры (амниоцентез), чтобы исследовать кариотип плода, ведь ассоциация между возрастом матери и повышенной частотой рождения детей с синдромом Дауна была замечена очень давно. Долгое время именно материнский возраст являлся показанием для проведения хромосомной цитогенетической диагностики. Но постепенно стало понятно, что такое показание нецелесообразно: доля женщин старше 35 лет среди беременных – это лишь 5–10%, и у них рождается только 20% детей с синдромом Дауна [2]...
На современном этапе традиционный подход к выявлению хромосомных патологий плода с помощью комбинированного скрининга имеет диагностические ограничения, в первую очередь, в отношении точности метода. Результаты могут свидетельствовать о наличии аномалий, которые в дальнейшем не подтверждаются. Возможна и обратная ситуация – ложноотрицательный результат, который не гарантирует отсутствия серьезной патологии. Помимо этого, диагностика ряда хромосомных и генетических заболеваний остается за рамками пренатального скрининга.
Все вышеперечисленные факты указывают на необходимость разработки и внедрения новых инновационных методик, и в этой области за последнее время достигнуты большие успехи. Расшифровка генома человека дает возможность понимания генетических механизмов нормального и патологического развития беременности. Это эпохальное достижение науки в решении проблем репродукции и пренатальной диагностики наследственных болезней [2].
Современные методы пренатальной диагностики приведены в табл. 1 [2, 3]. С помощью этих методов возможна эффективная диагностика наследственных болезней и врожденной патологии на любых стадиях антенатального развития.
Обнаружение внеклеточной ДНК плода (cell-free DNA, cfDNA), свободно циркулирующей в плазме матери, позволило получить новый метод скрининга анеуплоидий (трисомий, моносомий) плода – неинвазивный пренатальный тест (НИПТ). Это наиболее эффективный метод определения большего количества хромосомных патологий [4, 5, 12 ] с частотой выявления более чем 99%, и уровнем ложноположительных результатов около 0,1%.
Исследования показали высокую эффективность неинвазивного пренатального теста в отношении наиболее частых анеуплоидий плода (синдромов Дауна, Эдвардса, Патау, Тернера), которые составляют 95% от всех хромосомных аномалий. С помощью секвенирования нового поколения (SNP) и специальных компьютерных программ даже в минимальном количестве ДНК плода можно определить наличие не только частых хромосомных болезней, но и нарушения числа половых хромосом, многие микроделеционные синдромы и даже ряд генных заболеваний [13, 14, 15].
Методы неинвазивной пренатальной диагностики начал разрабатывать в 1997 г. китайский ученый Питер Ло, а уже в 2011 г. четыре крупные американские корпорации предложили свои тест-системы для проведения НИПТ (табл. 2).
Существуют два различных подхода к анализу cfDNA: количественный и основанный на исследовании однонуклеотидных полиморфизмов (SNP). При первом подходе, cfDNA материнской плазмы секвенируют и идентифицируют принадлежность каждой молекулы к той или иной хромосоме путем сравнения с геномом человека. При наличии трисомии у плода, количество молекул, полученных от трисомной хромосомы по сравнению с предполагаемой дисомной референсной хромосомой, является более высоким, чем при эуплоидных беременностях.
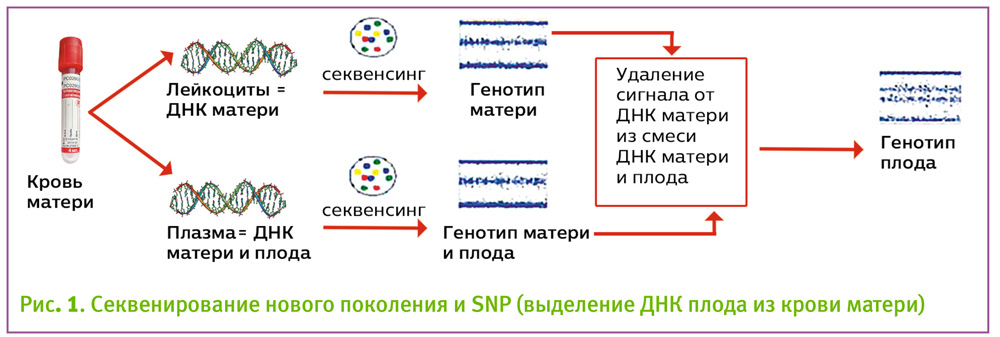
В противоположность этому, методы, основанные на исследовании SNP, определяют число копий хромосом путем поиска специфических паттернов в аллельных измерениях. Использование неинвазивного пренатального ДНК теста на основании определения SNP обеспечивает гораздо более точные результаты (рис. 1).
Поскольку внеклеточная ДНК плода преодолевает гематоплацентарный барьер и попадает в материнский кровоток уже к пятой неделе беременности, то просто взяв кровь у беременной, можно обнаружить хромосому у плода, избежав при этом риска инвазивного внутриматочного вмешательства, которое необходимо для получения клеток плода на исследование. Концентрация внеклеточной ДНК плода в сыворотке беременной с 9 недель в среднем составляет 10% от общего объема внеклеточной ДНК. Процент фетальной фракции нарастает с увеличением срока беременности.
Поэтому, начиная уже с 9 недели беременности, использование данного молекулярного анализа обеспечивает высокую точность диагностики наиболее распространенной хромосомной патологии, что позволяет рекомендовать этот тест всем категориям беременных женщин.
Существует тест, при котором специально секвенируют однонуклеотидные полиморфизмы (SNPs- таргетное секвенирование) и разделяют генотип матери и плода. Для этого теста может использоваться ДНК отца, выделенная из буккального мазка. Образец, взятый у отца, может быть полезен для ускорения получения ответа и снижения риска перезабора крови, на точность результатов отсутствие ДНК отца не влияет [16, 17, 18, 19].

Проведенные клинические исследования показали высокую эффективность НИПТ для диагностики хромосомных заболеваний, что помогло значительно снизить количество инвазивных процедур и устранить связанный с ними риск потери беременности. НИПТ также может быть полезным в качестве второго теста по результатам комбинированного скрининга, основанного на данных ультразвукового и биохимического исследований и возраста матери [20, 21].
Нами исследовано 133 образцов крови, содержащей фетальную ДНК. Образцы материнской венозной крови были получены у пациенток с одноплодной беременностью на сроке от 9 до 24 недель. 106 из 133 обследованных сдавали НИПТ в связи с высоким риском анеуплоидии плода по результатам комбинированного пренатального скрининга. В 2-х наблюдениях по результатам НИПТ получен высокий риск трисомии 21, другой хромосомой патологии не обнаружено. Для подтверждения диагноза одной беременной проведена инвазивная пренатальная диагностика. Другая пациентка с высоким риском аномалии по 21 хромосоме отказались от инвазивного вмешательства и сделала аборт. При кариотипировании трисомия 21 хромосомы была подтверждена у обеих пациенток.
Пол плода определен правильно во всех случаях. Ложноотрицательных результатов по Panorama™ тесту нами не было получено.
Таким образом, чувствительность НИПТ для синдрома Дауна в нашем исследовании достигла 100%, положительный предсказательный результат для трисомии 21 составил 99,9 при отрицательном уровне ложноположительных результатов.
Беременности, отнесенные к группе высокого риска трисомий 21, 18 и 13 хромосом на основании возраста матери, данных ультразвукового и биохимического исследований сыворотки крови матери, являются причиной, по которой родители принимают решение о инвазивном вмешательстве с целью кариотипирования плода. В нашем исследовании использование анализа фетальной ДНК помогло избежать ненужных инвазивных тестов и устранить связанный с ними риск потери беременности. НИПТ также может быть полезным в качестве второго теста по результатам комбинированного скрининга, основанного на данных ультразвукового и биохимического исследований и возраста матери.
В мартовском выпуске «Американского журнала акушерства и гинекологии» 2014 года было опубликовано масштабное исследование, доказывающее способность неинвазивного пренатального теста SNPs определять с высокой точностью большинство распространенных синдромов микроделеции. Эти микроскопические потерянные участки ДНК на субхромосомном уровне могут стать причинами серьезных проблем со здоровьем человека. Характер этих проблем зависит от местонахождения делеции.
При изучении 469 случаев, включая 111 положительных контролей, тест таргетного секвенирования SNPs продемонстрировал чувствительность, превышающую 97%, и количество ложноположительных результатов было ниже 1% при каждой из пяти тестируемых микроделеций. Основываясь на этих результатах, авторы исследования пришли к выводу, что «может быть весьма уместно предлагать скрининг микроделеций на основе НИПТ беременным женщинам общей популяции» [22, 23].
Микроделеции – это микроскопические отсутствующие участки ДНК на субхромосомном уровне, которые влекут за собой серьезные проблемы со здоровьем человека. В рамках исследования было отмечено, что «клинически значимые микроделеции и дупликации случаются в >1% беременностей, независимо от возраста матери. Эти генетические альтерации случаются значительно чаще, чем те, которые на данный момент пытаются определить во время скрининга. Такие, например, как синдром Дауна. В отличие от синдрома Дауна, риск которого возрастает с возрастом матери, микроделеции никак не зависят от возраста беременной женщины.
Ученые выявили частоту возникновения этих генетических нарушений у новорожденных. Получилось, что какая-то одна из данных микроделеций встречается у одного на тысячу новорожденных. Стало очевидно, что данный вид патологий гораздо более распространен, чем синдром Дауна. Речь идет о беременностях, при которых возраст матерей не превышает 28 лет [24, 25, 26].
НИПТ на основе таргетного секвенирования SNPs выявляет следующие микроделеции: синдром делеции 22q11.2 (также известный как синдром Ди Джорджи), делецию 1p36, синдром Ангельмана, синдром кошачьего крика и синдром Прадера–Вилли. Конкретно синдром делеции 22q11.2 выявлялся в ходе тестирования посредством SNPs чаще всех остальных микроделиций, примерно у одного ребенка из 2000. При нем нередко наблюдается внезапная смерть плода, но обычный цитогенетический анализ не позволяет выявить этот синдром.
Частота микроделеционных синдромов не зависит от возраста матери и постоянна в течение всего репродуктивного периода.
Учитывая высокую эффективность метода, 79% американских врачей считают, что неинвазивное пренатальное тестирование по крови матери (НИПТ) уже может быть использовано для скрининга синдрома Дауна, а 46% американских врачей предлагают заменить всю пренатальную диагностику на НИПТ [13]. Но, по мнению профессора Иванс [15], после получения результатов неинвазивного тестирования в ранние сроки без грамотного медико-генетического консультирования пациентки нередко отказываются даже от УЗИ. И в сегодняшних реалиях ощущается нехватка грамотных специалистов, консультирующих беременных до и после НИПТ.
Недавно проведенные исследования подтвердили экономическую целесообразность использования тестов NIPT для всех беременных женщин, независимо от их группы риска.Питер Бенн – доктор наук, профессор генетики в центре UCONN Health – инициировал всесторонний экономический анализ тестов NIPT и альтернативных методов с тем, чтобы внедрить клинические модели в систему тестирования общей когорты пациентов.
Доктор Бенн пришел к выводу, что «Повсеместное применение тестов NIPT значительно увеличивает количество выявляемых эмбриональных анеуплоидий и является при этом экономически целесообразным выбором. Замена стандартного скрининга на NIPT приводит к снижению затрат на здравоохранение за обследование каждого пациента, относящегося к общей группе». Заключение доктора Бенна о том, что NIPT может стать экономичным и эффективным вариантом тестирования для всех женщин, независимо от их возраста и группы риска, также подтверждают и дополняют мнение, высказанное в сентябре 2015 года Американской коллегией акушеров и гинекологов (ACOG) и Обществом материнской и эмбриональной медицины (SMFM) касательно скрининга внеклеточной ДНК на эмбриональные анеуплоидии: «Любой пациент, независимо от группы риска, может пройти анализ внеклеточной ДНК… Пациент должен понять ограничения и преимущества этого скринингового метода в контексте альтернативных вариантов диагностики» [27].
Высокий риск хромосомной патологии по результатам НИПТ является показанием для проведения инвазивной диагностики и кариотипирования плода. Амниоцентез имеет предпочтение, так как при биопсии хориона можно столкнуться с мозаицизмом, ограниченным плацентой.
Ложноположительные результаты НИПТ могут быть связаны [28]:
- С хромосомной аномалией у матери. Нередко женщины являются носителями мозацизма по Х-хромосоме, не подозревая об этом, что может быть причиной ложноположительных результатов НИПТ.
- С «исчезающим» близнецом. Дополнительный гаплотип SNP наблюдается еще в течение 8 недель после гибели плода. Это приводит к некорректной диагностике количественными методами.
- С плацентарным мозаицизмом. Внеклеточная ДНК в кровоток матери поступает из трофобласта, поэтому положительный результат НИПТ не может быть показанием для прерывания беременности без верификации диагноза при амниоцентезе.
Ограничения для любых НИПТ:
- Многоплодная и неразвивающаяся беременность.
- Суррогатное материнство.
- Донорская программа.
- Пересадка костного мозга или стволовых клеток в анамнезе.
Противопоказания для любых НИПТ:
- УЗ-маркеры хромосомных патологий (ТВП более 2,5 мм).
- Пороки развития плода.
- Носительство хромосомных аномалий родителями.
В этих случаях всегда показана инвазивная пренатальная диагностика.
Рекомендуемый алгоритм пренатальной диагностики
- УЗИ в 11–12 недель.
- При обнаружении УЗ-маркеров хромосомных аномалий (ТВП более 2,5 мм), риске больше, чем 1:100, рекомендуется инвазивная диагностика.
- При отсутствии УЗ-маркеров, проводится биохимический скрининг. Если риск составляет меньше 1:300, беременность ведется, как обычная.
- При риске 1:100 – 1:300 после биохимического скрининга, рекомендуется НИПТ.
- При положительном результате НИПТ проводится инвазивная диагностика.
Многие ученые считают, что в будущем НИПТ сможет заменить биохимический скрининг.
Таким образом, результаты исследований показали, что анализ свободноциркулирующей внеклеточной ДНК плода в крови матери с использованием таргетного секвенирования SNPs на хромосомах 13, 18, 21, Х и Y является точным методом обнаружения аутосомных анеуплоидий, аномалий половых хромосом и триплоидий, а также наиболее встречаемых микроделеций у плода с 9 недель беременности и может быть рекомендовано всем беременным в качестве высокоэффективного пренатального скрининга.
Перечень литературы находится в редакции.
Детальніше
Вакцинація вагітних проти грипу
«Хворобу легше попередити, ніж лікувати»
Гіппократ
Сучасний стан проблеми
Грип є одним з частих інфекційних захворювань, що виникають у вагітних. Розвиток грипу на тлі вагітності підвищує ризик виникнення таких ускладнень, як передчасні пологи, пневмонія, гострий респіраторний дистрес-синдром і збільшує показники материнської та малюкової смертності. Згідно з результатами пандемії вірусу грипу А (H1N1) у 2009 році, вагітні жінки були віднесені до групи ризику щодо виникнення грипу та його ускладнень [18, 21].
Аналіз показників смертності від грипу та його ускладнень (2009 рік) продемонстрував, що до 13% випадків припадало на вагітних пацієнтів [12, 36]. Фактори, які сприяли більш важкому перебігу грипу у вагітних, були пов'язані з фізіологічними змінами організму при вагітності: супресивними змінами імунної системи, підвищенням споживання кисню, зменшенням всіх резервних об'ємів легень, зниженням компенсаторних властивостей дихальної системи та іншими [12, 34].
Спалахи грипозної інфекції описуються і у новонароджених [28]. Клінічні та наукові дослідження, проведені у США та Гонконзі, показали високий рівень госпіталізації серед новонароджених з грипом, особливо у віці до 6 місяців життя [11, 24, 29].
Рівень смертності новонароджених від грипу та його ускладнень був вище у віці до 6 місяців життя і склав 88 випадків на 100 000 пологів [5]. Це пов'язано з тим, що всі зареєстровані протигрипозні вакцини дозволено використовувати тільки після 6 місяців життя [14].
У Сполучених Штатах Америки вакцинація вагітних жінок проти грипу проводиться протягом десятиліть, але стандартизовані підходи до даного питання були розроблені лише на початку 2000-х років [8, 16].
На початку 21-го століття відсоток вакцинованих вагітних жінок становив менше 20% від загальної кількості вагітних. Після аналізу результатів пандемії грипу H1N1, відсоток вакцинації вагітних проти грипу склав 50% від загальної кількості вагітних, дані показники не змінилися і на сьогоднішній день [10, 26].
Не дивлячись на результати десятирічних досліджень, які підтверджують безпеку вакцинації для вагітної, плода та новонародженого, основною причиною відмови від вакцинації є страх можливого негативного впливу на плід [9].
Застосування протигрипозних вакцин знижує показники захворюваності на грип в 1,4–1,7 рази, а серед захворілих пом'якшує клінічну картину, зменшує тривалість перебігу хвороби, попереджає розвиток важких ускладнень і летальних випадків [27]. Вакцинація проти грипу у вагітних жінок знижує ризик захворюваності на грип на 70% [35].
Згідно з деякими дослідженнями, вакцинацію вагітних проти грипу можливо проводити у будь-якому терміні гестації. Під час вагітності дозволено використовувати лише інактивовану протигрипозну вакцину. Жива ослаблена протигрипозна вакцина, у вигляді назального спрею, не використовується у вагітних і дозволена для використання тільки в післяпологовому періоді [7, 15, 17].
Безпечність протигрипозної вакцини для вагітної і плода
Безпечність інактивованої протигрипозної вакцини у вагітних була підтверджена багатьма багатоцентровими дослідженнями [6, 13, 23, 33, 37].
Клінічні дослідження, проведені у США, продемонстрували, що у вагітних, вакцинованих проти грипу, не було встановлено підвищення ризику розвитку акушерських ускладнень, кількості кесарських розтинів і передчасних пологів. Не було також виявлено тератогенних ефектів інактивованих протигрипозних вакцин. Продемонстровано зниження рівня захворюваності на грип та гострі вірусні респіраторні інфекції у вагітних і новонароджених у групі вакцинованих [6, 33].
Ще одне дослідження було проведено в Шотландії, в період 2009–2010 рр. і включало в себе 3754 вакцинованих проти грипу (H1N1) вагітних жінок у 2 і 3 триместрах вагітності. У результаті дослідження не було виявлено різниці в результатах вагітності, стані новонароджених і наявності вроджених вад розвитку у новонароджених в обох групах [22].
Імунізація вагітних жінок проти грипу є ефективним захистом також і новонароджених. Даний захисний ефект пов'язаний з виробленням материнських антитіл, які надходять до дитини через плаценту (IgG) і з грудним молоком (IgА). Тривалість пасивного імунного захисту новонародженого залежить від концентрації антитіл у пуповинній крові та в грудному молоці, які зберігаються до перших 6 місяців життя і більше [13, 25].
Імунізація вагітних протигрипозними вакцинами демонструє високу ефективність (92%) і в профілактиці госпіталізації з грипом новонароджених протягом перших 12 місяців після пологів [4]. Ризик госпіталізації новонароджених через грип і його ускладнення зменшується на 45–48% [30]. У випадках захворюваності на грип дітей, народжених від вакцинованих матерів, перебіг захворювання був у вигляді більш легких форм і його тривалість була значно коротшою, ніж у дітей, народжених від матерів без вакцинації [19, 31, 32].
Всі інактивовані протигрипозні вакцини відносяться до категорій ризику В і С згідно Американського управління контролю за ліками та харчовими продуктами – FDA (Food and Drug Administration) і можуть використовуватись у вагітних [3].
При вакцинації в організмі відбувається активізація клітинного та гуморального імунітету.
Основна роль в клітинному імунітеті відводиться Т-лімфоцитам (Т-хелпери (CD4), T-кілери (CD8)), Natural Killer cells, макрофагам, які забезпечують пряму нейтралізацію і елімінацію патологічних агентів.
Гуморальний імунітет представлений В-лімфоцитами, які відповідальні за синтез антитіл (імуноглобуліни A, M, G). Антитіла є специфічними факторами протигрипозного імунітету, які зв'язуються з вірусом і нейтралізують його за допомогою активації системи комплементу. Пік секреції специфічних антитіл розвивається через 14–28 днів після вакцинації. Тривалість поствакцинального імунітету становить 6–12 місяців [1, 2, 20].
Вакцинацію проводять у період найбільшого ризику виникнення вірусної епідемії, за 3–4 тижні до передбачуваного її початку. Імунізація повинна здійснюватися з урахуванням щорічних рекомендацій ВООЗ за складом протигрипозних вакцин на даний епідемічний сезон, оскільки у кожен сезон змінюється спектр циркулюючих штамів вірусу грипу. Вакцинація проводиться відповідно до інструкцій із застосування препаратів. Профілактичні щеплення проводяться після медичного огляду, при відсутності медичних протипоказів та за наявності письмової згоди пацієнтки [1, 2].
Таким чином, на сьогодні вакцинація є одним із основних методів боротьби з епідеміями грипу, який поєднує в собі безпеку, високу специфічність, ефективність і економічність.
Враховуючи результати численних досліджень, присвячених імунізації вагітних жінок проти грипу, відсутність тератогенних ефектів вакцин на плід і несприятливого впливу на вагітність, можна зробити висновок, що вакцинація є безпечним і надійним інструментом в профілактиці захворюваності на грип вагітних і новонароджених. Для імунізації повинна використовуватися лише інактивована протигрипозна вакцина.
Більшість досліджень, присвячених протигрипозній вакцинації у вагітних, містять дані пацієнток, що були вакциновані у другому та третьому триместрах вагітності.
З огляду на недостатню кількість інформації про безпечність протигрипозної вакцинації у першому триместрі вагітності, та особливості перебігу даного триместру вагітності (закладка органів і систем), питання про доцільність і безпеку вакцинації в цей період потребує подальшого вивчення.
Повний перелік літератури знаходиться у редакції.
Детальніше