Резюме:
Кріоконсервація надає можливості збереження фертильності для молодих жінок, які мусять проходити процедури, що потенційно знижують фертильність, а також використовується жінками, які бажають відкласти материнство з особистих та професійних причин на пізніше. Ще одним способом використання кріоконсервації є донорство ооцитів, яке потребує правильного законодавчого врегулювання.
Ключові слова:
Кріоконсервація, фертильність, відкладене материнство, донорство ооцитів.
DOI
https://doi.org/10.37529/ztz.2020.3/3-20-6
Вступ
Влітку 2019 року у Франції сталася гарна подія, яка відкрила новий щабель досягнень репродуктивної медицини. А саме, онкохвора жінка після успішної хіміотерапії раку грудей змогла народити дитину, незважаючи на те, що хіміотерапія значно знизила її фертильність. При цьому використовувалися не донорські яйцеклітини, а її власні, проте ті, які були заморожені в незрілому стані до початку лікування онкозахворювання.
Для розуміння цієї важливої ланки в розвитку допоміжних репродуктивних технологій треба пояснити певні деталі.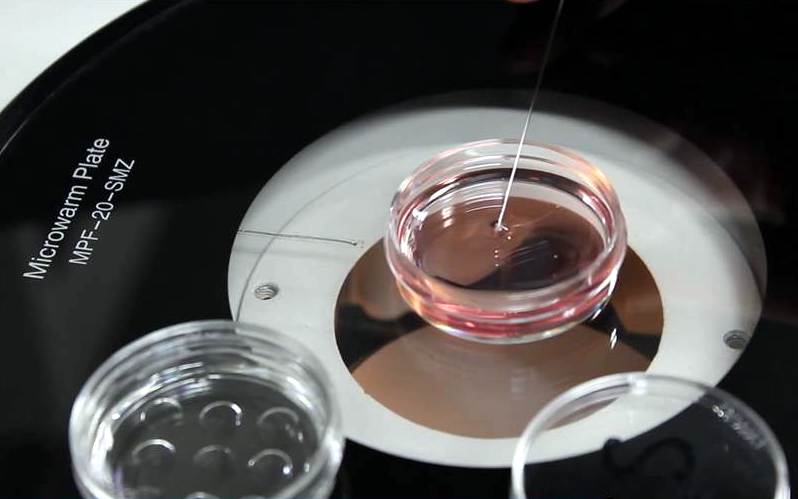
Рис. 1. Використання допоміжних репродуктивних технологій у клініці. Незважаючи на поширену фразу "діти в пробірці", ДРТ працюють з ембріонами не в пробірці, а в чашці Петрі
Зображення: UZM [CC BY-SA 4.0]
Онкохворі люди проходять хіміотерапію. Вона буває різної ступені ефективності, залежно від стадії та типу онкозахворювання та індивідуальних особливостей онкохворих, але метою її є вбити пухлинні клітини та пригнітити їхній розвиток. Частим побічним ефектом хіміотерапії є зменшення поділу інших клітин (так, пацієнти, що проходять хіміотерапію, зазвичай втрачають волосся на певний час). Тому жінки, які пройшли хіміотерапію, часто не можуть завагітніти, адже їхні яйцеклітини пошкоджуються під час цієї терапії (тут треба додати, що це проблема не виключно жіноча, — чоловіки також мають проблему зі зниженням продукції сперматозоїдів від хіміотерапії). Саме тому такі жінки потребують нових методів з арсеналу допоміжних репродуктивних технологій.

Рис. 2. Символ руху з інформування суспільства про рак молочної залози
Жінка, про яку йде мова, отримала діагноз раку молочної залози. Це друге за розповсюдженням пухлинне захворювання у жінок. Незважаючи на те, що для пацієнтів з раком молочної залози п'ятирічний показник виживаності – стандартний показник виживання людей з діагнозом злоякісних пухлин – доволі високий, і становить 80–90% в розвинених країнах (тобто після діагностики 80–90% людей живуть п'ять та більше років), все одно смертність від цієї хвороби в 2018 році в світі становила 627 тис осіб [].
Також зазначимо про всяк випадок, що, незважаючи на назву, рак молочної залози може розвитися й у чоловіків також, адже вони мають зачатки молочних залоз. Це відбувається тому що всі зародки до певного періоду розвиваються по жіночій ембріональній програмі, і лише за наявності чоловічої статевої Y-хромосоми і активності певних генів з неї програма на 6–8-й тиждень ембріонального розвитку переключається на чоловічу. Залишки цього видні у вигляді сосків у чоловіків. Хоча ймовірність раку молочної залози в чоловіків у 100 разів менша ніж у жінок, але такі випадки трапляються. Так у США у 2020 році розраховані випадки раку молочної залози лише у чоловіків становлять 2620 нових випадків, і 520 смертельних випадків, згідно з даними Національного інституту раку Національного інституту охорони здоров'я США [].
Але на допомогу людям, які мають знижену фертильність (здатність до розмноження), прийшли допоміжні репродуктивні технології (Assisted reproductive technology, АРТ). Їх поява дозволила народитися мільйонам людей, яких інакше не існувало б.
Допоміжні репродуктивні технології
Згідно з визначенням CDC (Центру з контролю та профілактики захворювань США), допоміжні репродуктивні технології (ДРТ) включають всі методики збільшення фертильності, в яких і яйцеклітини, і ембріони піддаються лабораторним процедурам []. Як правило, процедури ДРТ передбачають хірургічне вилучення яйцеклітин із яєчників жінки, поєднання їх із сперматозоїдами в лабораторії та повернення їх в тіло тої самої жінки, або іншої – сурогатної матері. Першою дитиною, народженою методом допоміжного запліднення у 1978 році, була Луїза Браун []. Процедура, що допомогла їй з'явитися на світ, має назву екстракорпоральне запліднення (IVF, in vitro запліднення, від латинського виразу "in vitro" — дослівно "у склі", у пробірці), що в народі має назву "штучне запліднення". Найбільш стандартна методика включає в себе введення до яйцеклітини сперматозоїда в лабораторних умовах, та підсадження заплідненої яйцеклітини назад до жінки. Цікаво знати, що попри певні страхи, що народжені за допомогою допоміжного запліднення діти можуть мати власні проблеми із фертильністю, адже фертильність у деяких випадках має генетичну складову, і проблеми з фертильністю можуть бути успадковані, проте Луїза Браун у 2006 році у віці 27 років завагітніла і пізніше народила дитину без допомоги репродуктивних клінік [].
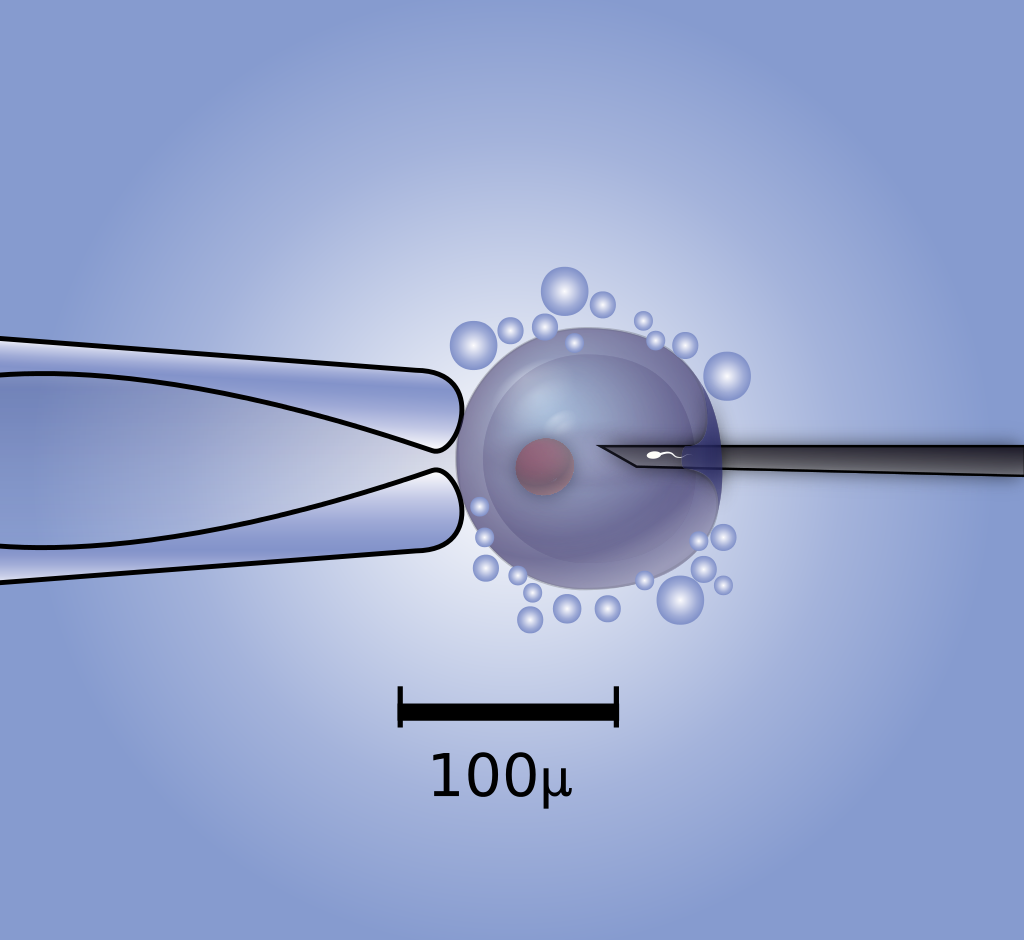
Рис. 3. Екстракорпоральне запліднення. Мікроін'єкція сперматозоїда в яйцеклітину. Мікроманіпулятор ліворуч (який виглядає дуже великим на цьому зображенні, але зверніть увагу на масштабну риску 0,1 мм) тримає яйцеклітину на місці. Тоді як мікроін'єкційною голкою вводять сперматозоїд (праворуч).
Зображення: KDS444 [CC BY-SA 3.0]
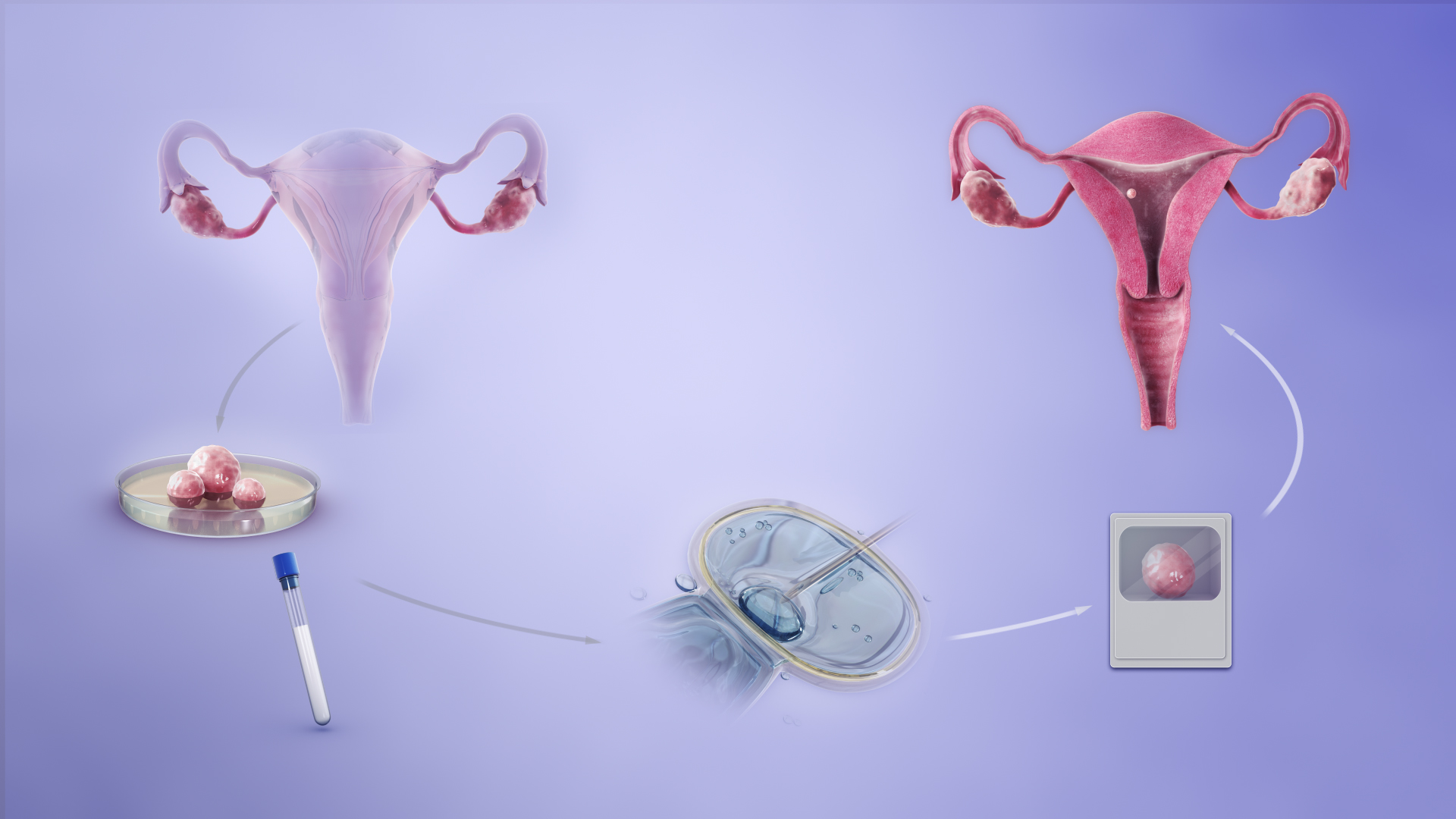
Рис. 4. Екстракорпоральне запліднення включає в себе збір яйцеклітин (лівий верхній кут), додавання сперматозоїдів до яйцеклітини шляхом ін'єкції (посередині), дозрівання та в деяких випадках додатковий аналіз отриманих ембріонів на генетичні аномалії (праворуч унизу) та підсаджування ембріона до матки (праворуч зверху)
Зображення: scientific animations [CC BY-SA 4.0]
Наразі для жінок, які хочуть завагітніти пізніше, але використовуючи свої яйцеклітини, запасені раніше, наявна методика кріоконсервації яйцеклітин – їх заморожування та зберігання в замороженому стані протягом декількох років. Після такої процедури яйцеклітини розморожуються та запліднюються. Тобто запліднення після кріоконсервації яйцеклітин дуже схоже на методику штучного запліднення, тільки між фазою отримання яйцеклітин та їх заплідненням є пауза довжиною зазвичай до десяти років, під час якої яйцеклітини перебувають у температурі значно нижче 0 °C [].
Але ефективне використання методик IVF передбачає наявність здорових ооцитів, які можна стимулювати й отримати для штучного запліднення. Деякі медичні процедури можуть пошкодити ооцити, серед них і лікування раку хіміотерапією.
У жінок, що не ввійшли в менопаузу, пошкодження репродуктивної системи внаслідок хіміотерапевтичного лікування часто призводить до недостатності яєчників, а іноді й до безпліддя та втрати ендокринної функції яєчників. Сучасна медицина розробляє певні методики для запобігання цьому, проте їхня масова імплементація поки що перебуває в майбутньому [].
Заморожування яйцеклітин
Заморожування живої тканини з метою використання її в майбутньому – популярна тема в науковій фантастиці. Але перешкодою в цьому є як сам процес заморожування — те як поводиться та розподіляється вода під час переходу в твердий стан льоду, так і процес розморожування. Переходи з рідкого стану в твердий і назад пошкоджують живу тканину. У природі є організми, які зимують при температурі нижче 0 °С, при цьому в їхніх організмах накопичується велика кількість антифризових сполук, які допомагають зберегти живі тканини від пошкоджень. В клініці поки що вдається працювати тільки з живими тканинами чи клітинами малого об'єму , щоб вони при цьому не пошкоджувалися.
Наразі є два основні підходи до кріоконсервації: повільне заморожування та вітрифікація [].
Повільне заморожування дозволяє відбуватися кріоконсервації з досить повільною швидкістю, щоб забезпечити зневоднення клітин, мінімізуючи внутрішньоклітинне утворення льоду. Перший успішний протокол, застосований у 1972 р. для кріоконсервації ембріона ссавців, вимагав швидкості охолодження від ~1°C на хв з заморожуванням до -70°C (тобто процедура йшла 70 хв) [8]. При такому підході вміст внутрішньоклітинної води перетворювався на невеликі кристали льоду або у скловидну масу. Але повернення зразка в нормальну температуру було найскладнішим процесом і потребувало дуже швидкого та рівномірного прогрівання [8].
Іншою методикою кріоконсервації є вітрифікація (від латинського "vitrum" – "скло", як у слові "вітраж" і як у вже згаданому "in vitro" тобто у склі пробірки). На відміну від повільного заморожування, вітрифікація – це методика, при якій клітина або невеликий об'єм тканини переходять у склоподібний стан без утворення льоду. Наразі більшість зразків вітрифікують за допомогою рідкого азоту (температура -195,75°C), щоб збільшити швидкість охолодження/прогрівання. Чим вища швидкість і чим рівномірніше охолодження, тим ефективність процедури вища [8]. Вітрифікація була пізнішою методикою й вона збільшила ймовірність успішності процедури кріоконсервації ооцитів [6]
Кріоконсервація надає можливості збереження фертильності для молодих жінок, які мусять проходити процедури, що потенційно знижують фертильність. Також кріоконсервація ооцитів використовується жінками, які бажають відкласти материнство з особистих та професійних причин на пізніше. Ще одним способом використання кріоконсервації є донорство ооцитів. Але кріоконсервація ооцитів для донорства викликає етичні питання, тому дуже важливим є правильне законодавче регулювання донорства ооцитів [].
Перша успішна вагітність з використанням технології кріоконсервації ооцитів відбулася в Австралії у 1986 році [6].
Незважаючи на те, що перша вагітність та народження здорової дитини за допомогою методики кріоконсервації ооцитів була зроблена шляхом повільного заморожування, більшість ранніх даних про кріоконсервацію яйцеклітин людини за допомогою цього методу показали погане виживання та низький рівень можливості завагітніти, використовуючи яйцеклітини на стадії другого мейотичного поділу (M-II ооцити) [9]. Тому використовується також консервація ооцитів на більш ранніх стадіях [9].
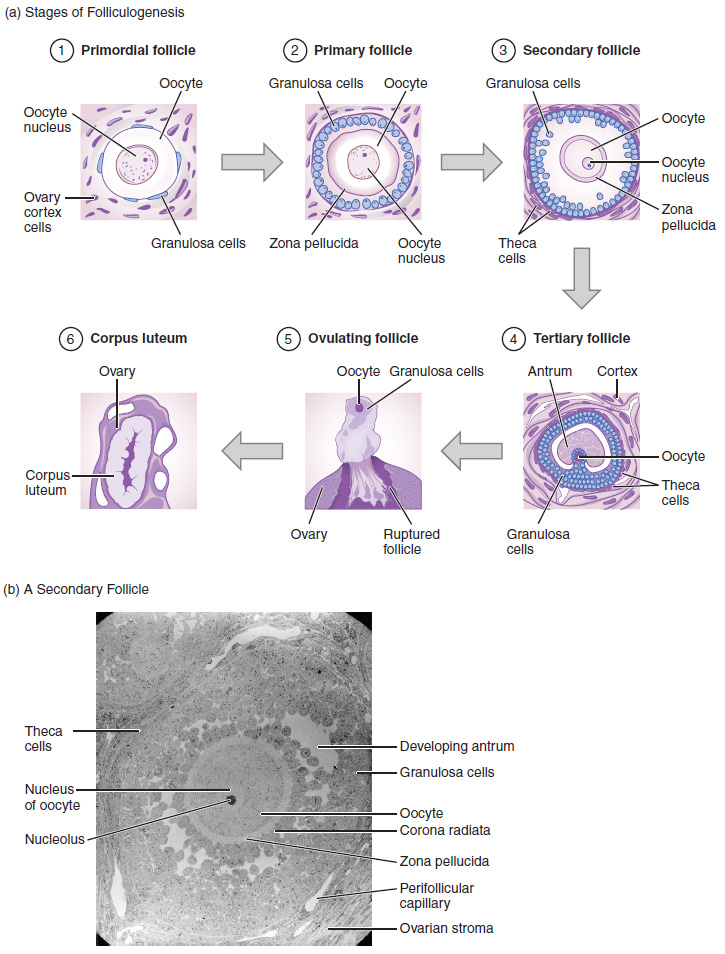
Рис. 5. Дозрівання фолікула показано за годинниковою стрілкою (діаграма). Унизу — вигляд вторинного фолікула (3 на діаграмі) під мікроскопом
Зображення: Anatomy & Physiology, OpenStax College [CC BY 3.0]
Нагадаємо, яйцеклітини ссавців починають свій розвиток ще до моменту народження дівчинки. При настанні підліткового віку раз на менструальний цикл один ооцит продовжує розвиток (хоча можливий вихід двох ооцитів, і у разі їх запліднення народжуються різнояйцеві близнюки), але лише після запліднення настає повне завершення формування яйцеклітини. Тобто в яйцеклітини лише після запліднення завершується мейотичний поділ, а саме утворення гаплоїдного або половинного набору хромосом дорослої людини, — той процес, який зберігає постійний хромосомний набір виду у 46 хромосом: зріла яйцеклітина та зрілий сперматозоїд мають лише половину тобто 23 хромосоми, що, зливаючись, формують знову повний набір хромосом в ембріона.
Заморожування ооцитів на різних етапах їх розвитку може мати різні прогностичні наслідки. Тому однією з методик є заморожування ооцитів на ранніх стадіях, і їхнє дозрівання (матурація) вже після розмороження [9].
In vitro дозрівання ооцитів
In vitro дозрівання або матурація ооцитів (IVM) являє собою процедуру культивування попередньо вилучених незрілих ооцитів у спеціальному поживному середовищі в лабораторних умовах для їх дозрівання. Ця методика відрізняється від стандартної методики штучного запліднення, де отримують вже більш зрілі ооцити після стимуляції овуляції у жінки. При IVM отримують незрілі фолікули і немає навантаження на організм жінки великою дозою гормонів гонадотропінів [].
Безпечність для дитини
Народження дитини, заплідненої за допоміжних репродуктивних технологій, може мати різноманітні наслідки для її майбутнього. Такі діти частіше народжуються недоношеними та малими для гестаційного віку — ці два показники є відомими факторами ризику для погіршеного здоров'я в подальшому житті. Проте ризики для здоров'я, пов'язані з допоміжними репродуктивними технологіями, порівняно невеликі, і більшість дітей, які зачаті за допомогою екстракорпорального запліднення, народжуються здоровими. Однак із збільшенням кількості дітей, зачатих через допоміжні репродуктивні технології, та з плином часу медицина отримує все більше інформації про цих дітей, і це може дати важливі підказки для подальшого поліпшення клінічної допомоги та консультування. Нагадаємо, найстаршій людині яка народилася за допомогою ДРТ всього лише 42 роки. Тобто немає відомостей про стан таких людей у похилому віці [].
Загалом, використання допоміжних репродуктивних технологій не пов'язане зі збільшенням частоти дитячих захворювань, госпіталізації, використанням медичної допомоги чи зниженням якості життя. ДРТ також не пов'язані з проблемною поведінкою, та не пов'язані зі зниженням когнітивних функцій, а саме у дітей народжених через ДРТ не відбувається зниженні здатності до пізнання, зниження слуху або зору [11].
Також з роками ДРТ стають все безпечнішими. Так кількість багатоплідних вагітностей знизилася з прийняттям у деяких країнах законів щодо підсаджування лише одного ембріону за один раз, також темпи недоношеності знижуються [11].
Проблема онкохворих
Для онкохворих є певні недоліки кріоконсервації ооцитів на пізній стадії дозрівання (MII ооцитів), бо для цієї процедури виникає потреба в стимуляції яєчників гормонами. Це може затримати лікування раку на кілька тижнів, а в онкотерапії важливо розпочати лікування якомога раніше. Також існує особливий ризик стимуляції яєчників для пацієнтів з гормоночутливим раком, таким як рак молочної залози [6].
Альтернативою кріоконсервації яйцеклітин є кріоконсервація тканини яєчників. Біопсія яєчників — це хірургічна процедура, яка триває впродовж доби, й отже вона не затримує лікування раку. Але й така процедура має недоліки — пацієнтка повинна бути придатною до операції. Але найбільшим недоліком є те, що тканина яєчників потім підживлюється назад до пацієнтки. У здорових жінок це не викликає негативних наслідків. Проте в онкохворих така тканина може стати джерелом повернення злоякісних клітин до організму [6].
Повернімося до випадку, який ми згадали на початку й який став черговою сходинкою історії про кріоконсервацію ооцитів. Жінка, про яку йде мова, отримала діагноз раку молочної залози в віці 29 років. Для рятування власного життя вона повинна була проходити хіміотерапію, але вона мала попередження від лікарів, що її фертильність може бути зниженою або відсутньою після лікування. Їй порекомендували зробити не кріоконсервацію тканини яєчника (адже ця процедура більш інвазійна та має ризик повторного зараження організму злоякісними пухлинами після лікування раку), а відбирання незрілих ооцитів з подальшим їх in vitro дозріванням. Вона погодилася. Після п'яти років та ремісії захворювання ця жінка змогла успішно завагітніти і народити здорову дитину в віці 34 роки. Цей безперечний успіх медицини додає надії іншим, ще бездітним людям з онкологічними захворюваннями, які треба терміново лікувати.
Почитати про це можна детально в статті "First birth achieved after fertility preservation using vitrification of in vitro matured oocytes in a woman with breast cancer" Annals of Oncology M. Grynberg [].
Успіхи методик
Треба розуміти, що штучне запліднення — це обтяжлива в фінансовому, фізіологічному та емоційному плані медична процедура, яка для значної кількості пацієнтів закінчиться невдачею []. Так, отримання яйцеклітин — процедура гормонозалежна і має певне навантаження на організм жінки, є ризик розвитку синдрому гіперстимуляції яєчників. Також рівень успіху допоміжних репродуктивних технологій все одно не досягає більше 50%. Так, згідно зі звітом Товариства допоміжної репродуктивної технології (SART) за 2016 рік, успішність народження дитини з використанням штучного запліднення від одного циклу отримання яйцеклітин становила від 47% у молодих жінок і падала до 3,9% у жінок, старших за 41 рік.
Звісно, в таких випадках, коли більше альтернатив немає, штучне запліднення варто розглядати як опцію. Наведений приклад жінки з лікуванням раку молочної залози, якій пощастило стати матір'ю, незважаючи на знижену фертильність від хіміотерапії, каже сам за себе. Але читачі повинні розуміти, що технології штучного запліднення поки, на жаль, не допомагають у всіх випадках звернень до них, і негативні можливі наслідки для здоров'я жінки, наприклад від гормональної стимуляції яєчників, варто враховувати при прийнятті рішення, чи така методика підходить саме для вас. Обов'язково консультуйтеся з лікарями й питайте про можливі побічні дії щодо вашого організму [13].
Перелік літератури
- Freddie Bray et al, ‘Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.’, CA: A Cancer Journal for Clinicians, 2018 <https://doi.org/10.3322/caac.21492
- Male Breast Cancer Treatment (PDQ®) – Health Professional Version. National Cancer Institute 2020-01-31 https://www.cancer.gov/types/breast/hp/male-breast-treatment-pdq
- What is Assisted Reproductive Technology? | Reproductive Health CDC 2019-10-08 <https://www.cdc.gov/art/whatis.html
- Callista L Mulder et al, ‘A Practical Blueprint to Systematically Study Life-Long Health Consequences of Novel Medically Assisted Reproductive Treatments’, Human Reproduction, 2018 <https://doi.org/10.1093/humrep/dey070
- Louise Brown, first test tube baby, is pregnant. the Guardian. 2006-07-10 <https://www.theguardian.com/science/2006/jul/11/medicineandhealth.lifeandhealth
- Catrin E. Argyle, Joyce C. Harper, and Melanie C. Davies, ‘Oocyte Cryopreservation: Where Are We Now?’, Human Reproduction Update, 2016 <https://doi.org/10.1093/humupd/dmw007
- Iordan Stefanov Batchvarov et al, ‘A Grafted Ovarian Fragment Rescues Host Fertility after Chemotherapy’, Molecular Human Reproduction, 2016 <https://doi.org/10.1093/molehr/gaw064
- Laura Rienzi et al, ‘Oocyte, Embryo and Blastocyst Cryopreservation in ART: Systematic Review and Meta-Analysis Comparing Slow-Freezing versus Vitrification to Produce Evidence for the Development of Global Guidance’, Human Reproduction Update, 2016 <https://doi.org/10.1093/humupd/dmw038
- Ri-Cheng Chian, Yao Wang, and Yi-Ran Li, ‘Oocyte Vitrification: Advances, Progress and Future Goals.’, Journal of Assisted Reproduction and Genetics, 2014 <https://doi.org/10.1007/s10815-014-0180-9
10, Şafak Hatırnaz et al, ‘Oocyte in Vitro Maturation: A Sytematic Review.’, Turkish Journal of Obstetrics and Gynecology, 2018 <https://doi.org/10.4274/tjod.23911
- Tessa J Roseboom, ‘Developmental Plasticity and Its Relevance to Assisted Human Reproduction’, Human Reproduction, 2018 <https://doi.org/10.1093/humrep/dey034
- M Grynberg et al, ‘First Birth Achieved after Fertility Preservation Using Vitrification of in Vitro Matured Oocytes in a Woman with Breast Cancer.’, Annals of Oncology : Official Journal of the European Society for Medical Oncology, 2020 <https://doi.org/10.1016/j.annonc.2020.01.005
- J. Wilkinson, S.A. Roberts, and A. Vail, ‘Developments in IVF Warrant the Adoption of New Performance Indicators for ART Clinics, but Do Not Justify the Abandonment of Patient-Centred Measures’, Human Reproduction, 2017 https://doi.org/10.1093/humrep/dex063
- National Summary Report. 2016. https://www.sartcorsonline.com/rptCSR_PublicMultYear.aspx?reportingYear=2016


коментарів