 С момента первого успешного применения хирургической кастрации (G. Beatson, 1886 г.) с целью лечения распространённого рака молочной железы (РМЖ) прошло более 120 лет. После этого были открыты механизмы воздействия эстрогенов на ткань молочной железы и их значение в онкогенезе РМЖ. Позже была установлена роль надпочечников и гипофиза в синтезе эстрогенов. Пациенткам с распространенными и метастатическими формами РМЖ проводили овариоэктомии и адреналэктомии, назначали андрогены, синтетические эстрогены и прогестины. Но до средины 60-х годов ХХ века гормонотерапия рака молочной железы была несовершенной и применялась несистемно, ее эффективность не превышала 30–40% при выраженных побочных эффектах. В 1962 году был синтезирован радиоактивный эстрадиол, после чего были обнаружены рецепторы эстрогенов в ткани опухоли. В 1974 году были опубликованные данные о прямой зависимости эффективности гормонотерапии от экспрессии рецепторов на опухолевых клетках. С этого момента дальнейшие успехи в гормонотерапии РГЖ связаны с применением эндокринных препаратов системного действия пациенткам с гормонозависимым РМЖ в соответствии с разработанными рекомендациями по их применению. На сегодняшний день в эндокринотерапии (ЭТ) РМЖ используют антиэстрогены, ингибиторы ароматазы, прогестины, андрогены, а также агонисты гонадотропин–рилизинг–гормона (ГнРГ).
С момента первого успешного применения хирургической кастрации (G. Beatson, 1886 г.) с целью лечения распространённого рака молочной железы (РМЖ) прошло более 120 лет. После этого были открыты механизмы воздействия эстрогенов на ткань молочной железы и их значение в онкогенезе РМЖ. Позже была установлена роль надпочечников и гипофиза в синтезе эстрогенов. Пациенткам с распространенными и метастатическими формами РМЖ проводили овариоэктомии и адреналэктомии, назначали андрогены, синтетические эстрогены и прогестины. Но до средины 60-х годов ХХ века гормонотерапия рака молочной железы была несовершенной и применялась несистемно, ее эффективность не превышала 30–40% при выраженных побочных эффектах. В 1962 году был синтезирован радиоактивный эстрадиол, после чего были обнаружены рецепторы эстрогенов в ткани опухоли. В 1974 году были опубликованные данные о прямой зависимости эффективности гормонотерапии от экспрессии рецепторов на опухолевых клетках. С этого момента дальнейшие успехи в гормонотерапии РГЖ связаны с применением эндокринных препаратов системного действия пациенткам с гормонозависимым РМЖ в соответствии с разработанными рекомендациями по их применению. На сегодняшний день в эндокринотерапии (ЭТ) РМЖ используют антиэстрогены, ингибиторы ароматазы, прогестины, андрогены, а также агонисты гонадотропин–рилизинг–гормона (ГнРГ).
Использование ЭТ в лечении РМЖ возможно в трёх вариантах [1-4]:
- в адъювантном режиме – приводит к снижению риска возникновения рецидива болезни и увеличению безрецидивного периода у больных РМЖ.
- как элемент паллиативного лечения – при метастатических формах РМЖ – приводит к уменьшению опухолевой массы в организме, а также к увеличению продолжительности ремиссии.
- в неоадъювантном режиме применяется с целью уменьшения размеров первичной опухоли у больных с местнораспространенным РМЖ и к уменьшению объема оперативного вмешательства.
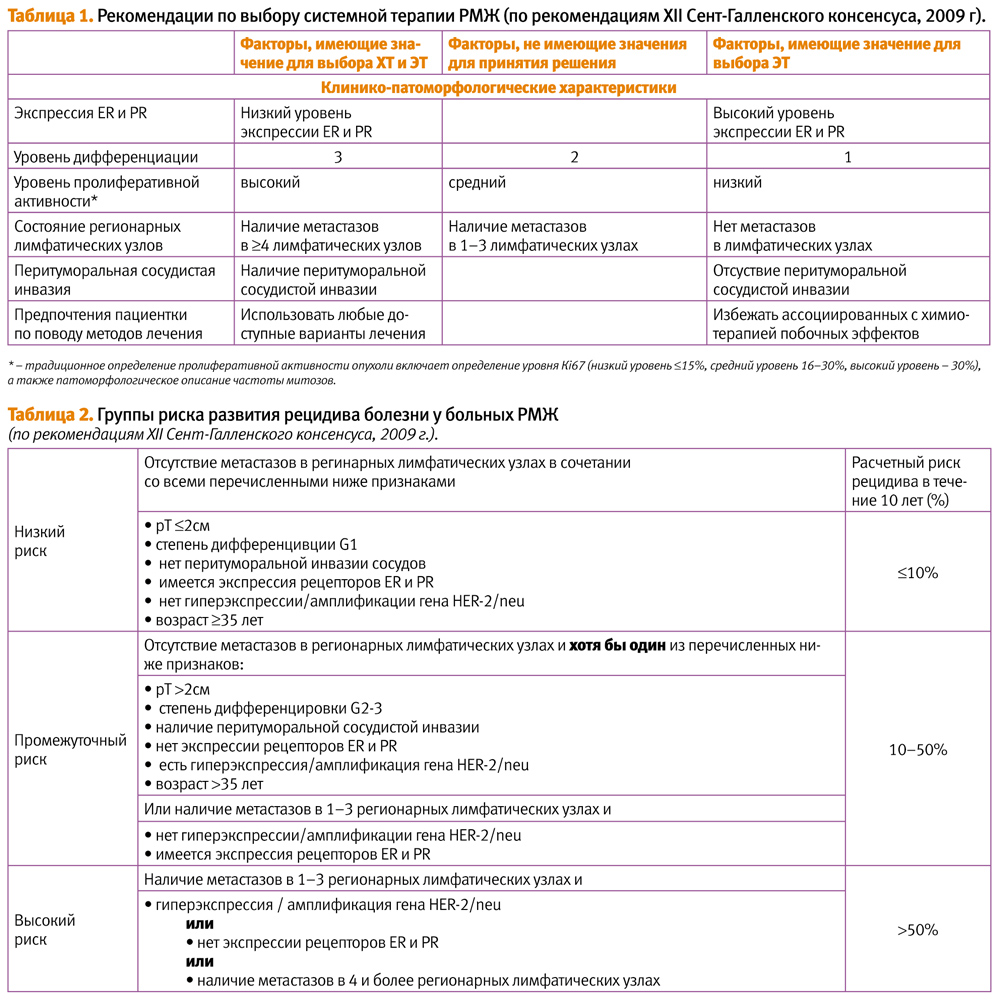
ЭТ назначается пациентам с гормонозависимыми опухолями согласно клиническим рекомендациям (Сент-Галленский консенсус [3], рекомендации ESMO [1, 2], NCCN [4], национальные стандарты по лечению РМЖ). ЭТ показана всем пациенткам с опухолями, на мембранах которых выявлена экспрессия ER ³1%. Выбор ЭТ базируется на рецепторном статусе опухоли, возрасте женщины и ее менструальной функции, группе риска развития рецидива болезни, к которой принадлежит пациентка [2] (табл. 1, 2). Также при назначении ЭТ учитываются: сопутствующая патология, предшествующая ЭТ и риск развития осложнений у каждой конкретной пациентки [3].
В марте 2013 года в городе Сент-Галлен (Швейцария) состоялось 13-е заседание рабочей группы экспертов, посвященное диагностике и выбору тактики лечения больных РМЖ [3]. В 13-м заседании принял участие 51 член рабочей группы экспертов из 21 страны мира, также присутствовали 3500 делегатов из 95 стран. Возглавляли рабочую группу экспертов Aron Goldhirsch и Eric P. Winer. После обсуждения ключевых вопросов, которые касались хирургического лечения РМЖ, длительности лучевой терапии, патоморфологической диагностики и критериев распределения опухолей по разным молекулярным подтипам, а также подходов к системному медикаментозному лечению РМЖ, группа экспертов провела голосование. Эксперты высказали свои мнения (путем голосования с использованием критериев: за, против и воздержался (не голосовал) по поводу более чем 100 вопросов, которые касались диагностики и лечения РМЖ. Только в одном вопросе – длительность таргетной анти HER-2/neu терапии – было достигнуто 100% соглашение. Окончательное решение принималось с учетом клинических характеристик опухоли и биологических особенностей организма больной, предпочтений пациентки, а также социо-экономических составных лечения. По результатам голосования были приняты рекомендации по диагностике и лечению РМЖ.
Рекомендации Сент-Галленского консенсуса по ЭТ в адъювантном режиме учреждены для двух групп больных гормонозависимым РМЖ – пациенток в пременопаузе и пациенток в менопаузе.
Стандарты ЭТ пременопаузальных больных РМЖ. Назначение тамоксифена строком на 5 лет, для некоторых пациентов с продлением приема препарата до 10 лет. Применение агонистов ГнРГ вместе с тамоксифеном остается стандартной рекомендацией для пациенток репродуктивного возраста и в пременопаузе. Пациенткам, которым противопоказан тамоксифен, возможно рекомендовать прием ИА вместе с применением агонистов ГнРГ, но окончательные выводы по эффективности такого метода лечения будут опубликованы в недалеком будущем по результатам двух больших многоцентровых клинических испытаний.
Пациенткам, которые начали ЭТ в пременопаузе и принимали тамоксифен 5 лет, достигнув за это время менопаузального периода, рекомендован переход на летрозол длительностью на 5 лет.
Стандарты ЭТ менопаузальных больных РМЖ. Пациентки из группы с низким риском развития рецидива могут получать только монотерапию тамоксифеном длительно. Пациенткам из группы высокого риска развития рецидива рекомендован прием ИА или переход на ИА после 2-х лет приема тамоксифена. Пациенткам наличием метастазов в регионарных лимфатических узлах также рекомендован прием ИА сразу после адъювантной химио-лучевой терапии сроком на 5 лет.
Также для пациентов из группы высокого риска развития рецидива рекомендовано: после 5 лет приема тамоксифена продолжить гормонотерапию ИА строком на 5 лет. Пациенткам, которые сразу принимали ингибиторы ароматазы длительно (5 лет), не рекомендовано продолжение приема ингибиторов ароматазы. Пациенткам, которые принимали тамоксифен на протяжении 2-х лет и после этого продолжили ЭТ с использованием ИА, рекомендован прием последних сроком не менее 5 лет.
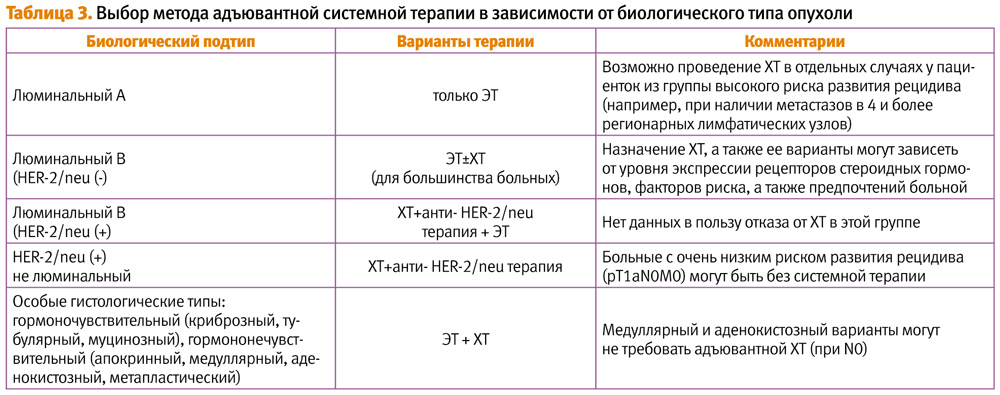
Также выбор системного лечения должен базироваться на биологических особенностях опухоли [3, 5] (табл. 3).
Рекомендации по ЭТ гормонозависимого РМЖ, разработанные Европейским обществом медицинских онкологов (ESMO), мало чем отличаются от рекомендаций Сент-Галленского консенсуса [1, 2].
Пременопаузальным больным показана гормонтерапия тамоксифеном по 20 мг в сутки в течении 5 лет в самостоятельном варианте или в сочетании с выключением функции яичников. Выключение функции яичников с использованием агонистов ГнРГ является обратимым и назначение этих препаратов рекомендовано на период не менее 2 лет. Однако оптимальная продолжительность их назначения не определена.
Комбинация агонистов ГнРГ и ИА не рекомендованы.
Для больных гормонозависимым РМЖ в менопаузе монотерапия тамоксифеном в течении 5 лет остается оптимальной опцией. Для больных из высокой группы риска рекомендован переход на ИА после 2–3 лет приема тамоксифена или изначальное назначение ИА такой категории больных на период 5 лет. Первоначальное назначение ИА является предпочтительным у больных с высоким риском развития рецидива (большие размеры опухолевого узла, наличие метастазов в регионарных лимфатических узлах, наличие экспрессии белка HER-2/neu на мембранах опухолевых клеток).
Больным с наличием метастазов в регионарных лимфатических узлах после завершения пятилетнего приема тамоксифена может быть рекомендован дополнительный курс терапии ИА в течении 2–3 лет.
Оптимальная продолжительность адъювантной ЭТ находится между 5 и 10 годами, но 5 лет приема тамоксифена остается стандартным вариантом лечения гормонозависимого РМЖ больных менопаузального возраста.
Также рекомендовано цитотоксическую терапию и ЭТ антиэстрогенами использовать не одновременно, а только в последовательном режиме. Что касается применения химиотерапии и ингибиторов ароматазы, то нет стандартного варианта назначения этих двух групп препаратов: возможен конкурентный прием (химиотерапия+ЭТ) или последовательный (химиотерапия с последующим переходом на ЭТ ингибиторами ароматазы).

Согласно рекомендациям NCCN (National Comprehensive Cancer Network), назначение ЭТ пациенткам с РМЖ также основывается на делении больных на две группы: пременопаузальные пациентки и больные в менопаузе [4]. Рекомендации полностью сопоставимы с утвержденными рекомендациями Сент Галенского консенсуса и ESMO. Кроме этого отдельно выделена одна группа пациенток с сохраненной менструальной функцией и местно распространенным РМЖ, которым в обязательном порядке рекомендовано провести овариальную абляцию (хирургическим путем) и только после этого применять ЭТ.
Важным является обсуждение некоторых вопросов, окончательно не решенных на сегодняшний день. Первым из них – достаточно ли пятилетней терапии тамоксифеном или же необходимо продлевать терапию до 10 лет? По результатам многоцентрового рандомизированого исследования ATLAS [6], в котором приняли участие 12894 пациенток, показано, что имеет место снижение риска развития рецидива болезни у пациенток, которые принимали терапию тамоксифеном в течении 5–14 лет, в сравнении с теми, кто получал аналогичное лечение на протяжении 5 лет (25,1 и 21,4% соответственно). В то же время, у этих пациенток возрастал риск развития рака эндометрия до 3,4% в сравнении с контрольной группой, где РЭ был обнаружен у 1,4%.
Вторым нерешенным окончательно вопросом является необходимость овариальной абляции у пациенток перименопаузального возраста с первичным неметастатическим гормонозависимым РМЖ [3]. Овариальную абляцию на сегодняшний день проводят двумя методами – хирургической кастрацией и назначением препаратов – агонистов ГнРГ. По результатам клинических испытаний установлено, что овариальная абляция как монотерапия не дает положительного эффекта на результаты лечения пациенток в перименопаузе и ранней менопаузе. Однако имело место небольшое улучшение отдаленных результатов лечения у больных репродуктивного периода, которым проводили монотерапию ГнРГ [3]. Группы пациенток, которые получали химиотерапию и ЭТ с тамоксифеном и агонистами ГнРГ, имели более низкий риск развития рецидива в сравнении с пациентками, которые получали только химиотерапию. Однако сравнения отдаленных результатов лечения группы пациенток, которые получали химиотерапию и ЭТ только тамоксифеном, с группой больных, которые получали лечение с вовлечением химиотерапии и ЭТ комбинацией агонистов ГнРГ и тамоксифеном, также не проводилось.
Что касается ИА, то по результатам клинических исследований установлено, что при раннем РМЖ назначение ИА как первой линии терапии или переход на ИА после 2–3 лет приема тамоксифена улучшает отдаленные результаты лечения. Отмечено, что прием ИА сопряжен с повышенным риском развития костных осложнений (остеопороза и переломов) [1–3].
Также актуальным остается вопрос о длительности медикаментозной аблятивной гормонотерапии. В рекомендациях длительность оварио-супрессивной ЭТ характеризируется термином не менее 2 лет, российских стандартах лечения РМЖ – до 5 лет [5]. Но длительность временного периода четко не определена.
Применение ЭТ в неоадъювантном режиме так же, как и применение НПХТ, позволяет уменьшить размеры первичной опухоли, объем оперативного вмешательства или перевести опухоль из неоперабельного состояния в операбельное [7]. Неоадъювантная ЭТ может быть назначена пациенткам с положительной экспрессией ER ³1%. Эффект такой терапии можно оценить не раньше чем через 4–6 недель от начала лечения. Неоадъювантная ЭТ имеет сопоставимую эффективность с НПХТ, а именно 40–60%, а также имеет ряд преимуществ перед НПХТ: меньшее количество побочных эффектов и отсутствие необходимости в госпитализации пациентки и проведении внутривенных инфузий.
Рекомендации по выбору метода неоадъювантной ЭТ аналогичны рекомендациям по выбору адъювантной ЭТ. Пациенткам в менопаузе предпочтительнее назначение ИА третьего поколения, а пациенткам с сохраненной менструальной функцией опцией выбора остается сочетание тамоксифена с агонистами ГнРГ. Длительность терапии колеблется от 3–4 месяцев до достижения желаемого эффекта (возможно более длительное применение, если эффект от терапии продолжает увеличиваться).
Критериями оценки эффективности проведенного лечения служат критерии системы RECIST. Эффективность проведенного лечения оценивают с помощью клинических методов (осмотра, пальпации), рентгенологических методов (ММГ, КТ) и ультрасонографии.
Единого стандарта при лечении метастатического РМЖ не существует [8, 9, 10]. Лечение при диссеминированной стадии болезни является паллиативным и направлено на улучшение качества жизни и увеличение ее продолжительности. Поэтому место в паллиативном лечении метастатического РМЖ ЭТ заняла давно в связи с достаточно хорошей переносимостью лечения, в значительной части случаев сопоставимой с эффективностью паллиативной ПХТ.
Показаниями к проведению ЭТ служат наличие экспрессии ER ³1% в первичной опухоли, а также учитывается ответ на предыдущую ЭТ. Рекомендовано исследовать экспрессию ER, PR и HER-2/neu и в метастатических очагах, во всех возможных случаях при прогрессировании после первичного лечения неметастатического РМЖ. К сожалению, это не нашло широкого применения в клинической практике в связи с трудностями проведения трепан-биопсий. Поэтому клиницисты при выборе метода паллиативного лечения ориентируются на ряд других критериев (табл. 5–7) [5, 8].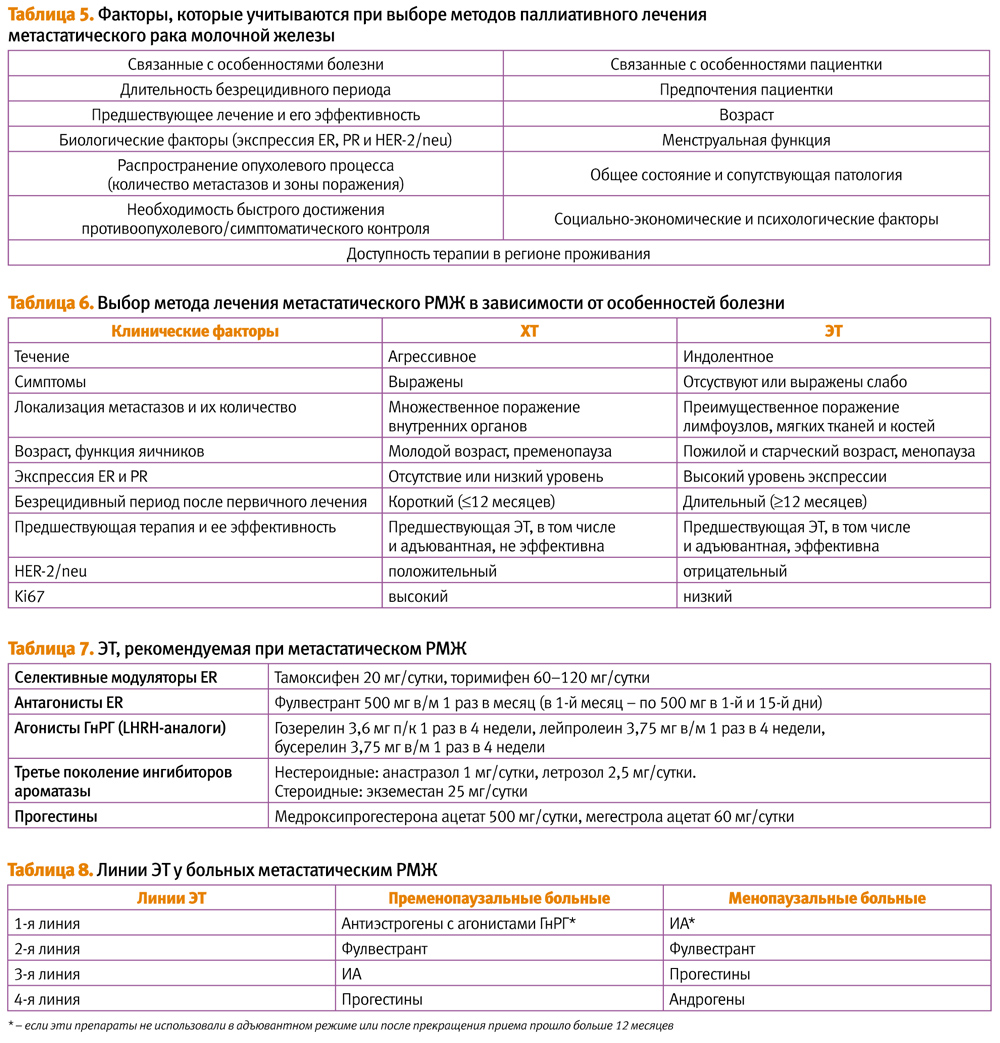
ЭТ является стандартом 1-й линии терапии метастатического гормонозависимого РМЖ. Исключением являются быстро прогрессирующие варианты болезни, при которых необходимо достижение противоопухолевого эффекта в максимально короткие строки, а также случаи с недостаточной или сомнительной гормоночувствительностью опухоли.
В рекомендациях NCCN отмечена минимальная токсичность ЭТ (в сравнении с ХТ) и ее предпочтительность при наличии соответствующего рецепторного статуса [4, 10]. Гиперэкспрессия белка HER-2/neu не является противопоказанием для ЭТ, хотя в целом свидетельствует о ее меньшей потенциальной эффективности по сравнению с HER-2/neu-отрицательными опухолями. Выбор варианта ЭТ должен быть индивидуальным и учитывать предшествующую ЭТ, если таковая проводилась, функцию яичников, профиль токсичности, сопутствующую патологию и биологические особенности опухоли. Отметим, что помимо препаратов ЭТ, которые широко используются в клинической практике (антиэстрогены, ИА, агонисты ГнРГ), в рекомендациях ESMO и NCCN упомянуты применение анаболических стероидов (нандролона деканоат), андрогенов (флуоксиместерон), высоких доз эстрогенов (ethinyl estradiol), а также хирургическая или лучевая абляция яичников [10]. Поддерживающая ЭТ, назначаемая непосредственно после ХТ, то есть в отсутствие признаков прогрессирования, не является стандартным подходом, но может рассматриваться как приемлемый вариант [9]. Одновременное назначение ХТ и ЭТ не рекомендуется.
Пременопаузальным больным рекомендован прием тамоксифена, если пациентка его не принимала в адъювантном режиме, или после его отмены прошло более 12 месяцев. Тамоксифен рекомендован в сочетании с овариальной абляцией/супрессией. Рекомендован также прием ИА третьего поколения в сочетании с овариальной абляцией.
Пациенткам в менопаузе рекомендован прием ИА, если их не использовали в адъювантном режиме. У данной категории больных ИА превосходят тамоксифен по частоте объективных ответов и длительности времени до прогрессии.
Однозначные рекомендации по поводу оптимальной последовательности назначения эндокринных препаратов после прогрессирования на фоне приема ИА отсутствуют [2, 5, 11]. Терапию диссеминированного РМЖ можно проводить только эндокринными препаратами, переходя с одной линии терапии на следующую при появлении признаков прогрессирования (табл. 8) или чередовать ЭТ с ХТ в зависимости от клинической ситуации. Об эффективности каждой последующей линии терапии можно косвенно судить по выраженности и длительности ответа на предыдущую линию лечения: вероятность ответа на последующую линию ЭТ выше у пациенток, которые имели хороший ответ на лечение эндокринными препаратами предшествующей линии.
При появлении неприемлемой токсичности следует прекратить ЭТ. Также больным метастатическим РМЖ с очевидными признаками резистентности к ЭТ следует назначить ХТ или предложить участие в клинических исследованиях [2, 9, 12]. Резистентность к ЭТ может иметь место у пациенток с ER+ статусом достаточно часто, поэтому, невзирая на амбулаторный прием препаратов, необходим постоянный динамический мониторинг ответа опухоли на лечение.
В настоящее время применяют комплексное лечение РМЖ с использованием химио-, лучевой терапии, различного вида оперативных вмешательств, таргетной и эндокринотерапии. Выбор методов лечения и их последовательность назначения базируется на молекулярных характеристиках опухоли, биологических особенностях организма и стадии опухолевого процесса. Правильно спланированная современная ЭТ РМЖ является одной из важных составных индивидуализированного противоопухолевого лечения, направленного не только на продления жизни пациентки, но и на полное выздоровление больных РМЖ.
Литература
- Aebi S., Davidson T., Gruber G. et all. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology21 (Supplement 5): v9–14, 2010.
- Минимальные клинические рекомендации европейского общества медицинской онкологии (ESMO). Редакторы русского перевода: проф. С. А. Тюляндин, к. мед. н. Д. А. Носов, проф. Н. И. Переводчикова, – М: Издательская группа РОНЦ им. Н. Н. Блохина РАМН, 2009. – 288 с.
- A. Goldhirsch, E. P. Winer, A. S. Coates Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Annals of Oncology: 1–18, 2013.
- NCCN National Comprehensive Cancer Network, USA. www.nccn.org.
- Практические рекомендации по лечению злокачественных опухолей Общества онкологов-химиотерапевтов. 2012, Ноябрь: 37–50. RosOncoWeb/RUSSCO.
- Davis Ch., Pan H., Godwin J. et all. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. The Lancet, Volume 381, Issue 9869, Pages 805 – 816.
- И. Б. Щепотин, А. С. Зотов, Н. Ф. Аникусько и др. Неоадъювантная гормонтерапия местно распространенного рака грудной железы. Клиническая онкология № 3(3); 2011.
- Cardoso F, Harbeck N, Fallowfield L, et al. Locally recurrent or metastatic breast cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl 7): vi11–vi19.
- Диагностика и лекарственная терапия при первичном и метастатическом раке молочной железы рекомендации: ESMO 2012, RUSSCO 2012, NCCN 2013. Дайжест. Онкология 15(2); 2013 – с.141-52.
- Network NCC. 2013 NCCN Clinical Practice Guidelines in Oncology: Breast Cancer Updates, Version 2.2013.
- Zhang X. F., Giuliano M., Trivedi M. et all. Metastasis Dormancy in Estrogen Receptor-Positive Breast Cancer. Clin Cancer Res December 19(23), 2013; – 6389-97
- Osborne CK, Schiff R. Mechanisms of endocrine resistance in breast cancer.Annu Rev Med 2011; 62: 233–47.


коментарів