(Часть 1)
В экспериментальных работах надо сомневаться до тех пор, пока факты не заставляют отказаться от всяких сомнений. Верить, что явление имеет место потому, что ты этого желаешь, есть величайшее безрассудство.
Луи Пастер, микробиолог и химик, основатель стереохимии, современной микробиологии и иммунологии
Вступление (обзор)
Формирование аномалий системы мюллеровых протоков является одним из самых «интригующих» расстройств, с которыми сталкивается акушер-гинеколог в своей клинической практике.
Мюллеровы протоки – это первоначальный зачаток женской репродуктивной системы. Их дифференциация обуславливает формирование маточных труб, матки, шейки и верхнего отдела (верхней трети) влагалища.
Вследствие нарушения развития этой системы возможно формирование широкого разнообразия врожденных пороков развития. Они варьируют от агенезии матки и влагалища до удвоения этих структур, либо могут формироваться малые внутриполостные маточные аномалии.
Пороки развития мюллеровых протоков часто ассоциированы с врожденными аномалиями мочевыделительной системы, осевого скелета.
На фоне большинства аномалий мюллеровых протоков наблюдается нормальное функционирование яичников и соответствующее возрасту развитие наружных половых органов.
Мюллеровы аномалии чаще выявляются после наступления половой зрелости (в пубертатном периоде нормальный внешний вид НПО и соответствующие возрасту этапы их развития часто маскируют отклонения внутренних половых органов). В постпубертатном периоде также девушки часто обращаются к гинекологу с жалобами на нарушение менструального цикла, поздние проявления включают бесплодие, привычное невынашивание, акушерские осложнения.
Из-за широкого диапазона возможных клинических проявлений аномалии мюллеровой системы могут вызывать затруднения в диагностике. После уточнения диагноза существует много вариантов терапии и они, как правило, зависят от конкретного дефекта мюллеровых протоков [1, 2].
Заболеваемость и распространенность
Ссылки на существование врожденных пороков формирования мюллеровых протоков датируются временами глубокой древности (около 300 гг. до н. э.). Первый документированный случай агенезии матки и влагалища зафиксирован в XVI веке [3]. Наши знания эпидемиологии этих пороков развивались далеко не параллельно техническим достижениям в диагностике и хирургической коррекции аномалий.
Фактическая заболеваемость и распространенность МА в общей популяции точно неизвестна. Сбору эпидемиологических данных препятствует возможность выделения точной выборки. Маточные аномалии часто бывают незамеченными при рождении и нигде не фиксируются. А вот во время детородного возраста, когда случаются репродуктивные сбои, о них сообщается гораздо чаще. Из других факторов, оказывающих влияние на неточность сбора статистических данных, следует отметить отсутствие стандартизированной классификации, неоднородность методов диагностики и популяционные различия исследуемых.
Данные заболеваемости широко варьируют и зависят от исследования. Большинство авторов дают статистику 0,1–3,5% [4, 5, 6, 7]. Grimbizis и соавт. в 2001 г. cообщили о средней частоте врожденных пороков матки – 4,3% для населения в целом и/или для женщин фертильного возраста [8]. Этот показатель базируется на анализе 5-ти исследований, которые включили около 3000 женщин c пороками развития матки. Среди женщин с нарушениями фертильности заболеваемость МА немного выше — 3–6%, а женщины с привычным невынашиванием имеют частоту 5–10%, наивысший процент выявлен у женщин, имеющих прерывание беременности в III триместре [9, 10].
Наиболее часто сообщается о таких дефектах формирования мюллеровой системы как матка с перегородкой, аркуатная (седловидная) матка, удвоение матки, однорогая или гипопластичная матка; распределение, в основном, зависит от исследования и от географического расположения [9, 11].
Распространенность МА также достаточно отличается в зависимости от исследований и варьирует от 0,16 до 10% [12, 13, 14, 15, 16, 17, 18].
При исследовании женщин с ПН, которым была проведена ГСГ, распространенность составила 8–10%. [13,15]. Хотя эти данные контрастируют с распространенностью в 2–3% у женщин с ПН на основании проведения гистероскопии (которая, в свою очередь, считается более точной по сравнению с ГСГ в диагностике МА) [16]. Интересно датское исследование 622 женщин (в возрасте от 22 до 74 лет), каждой из которых проводилась ЭХО-ГСГ (контрастирование солевым раствором), где выявили распространенность МА в 9,8%; выявляемость патологии была особо высока среди нерожавших и женщин с олигоменореей [19]. Исследования Grimbizis и соавт. сообщают о распространенности около 4,3% для населения в целом и/или для фертильных женщин, около 3,5% среди женщин, страдающих бесплодием, и около 13% для женщин с ПН [8].
С появлением возможности широкого использования высокочувствительных диагностических технологий и на фоне разработки стандартизированных классификационных схем, факторы, которые затрудняют точность исследований, будут оказывать значительно меньшее влияние.
Эмбриология
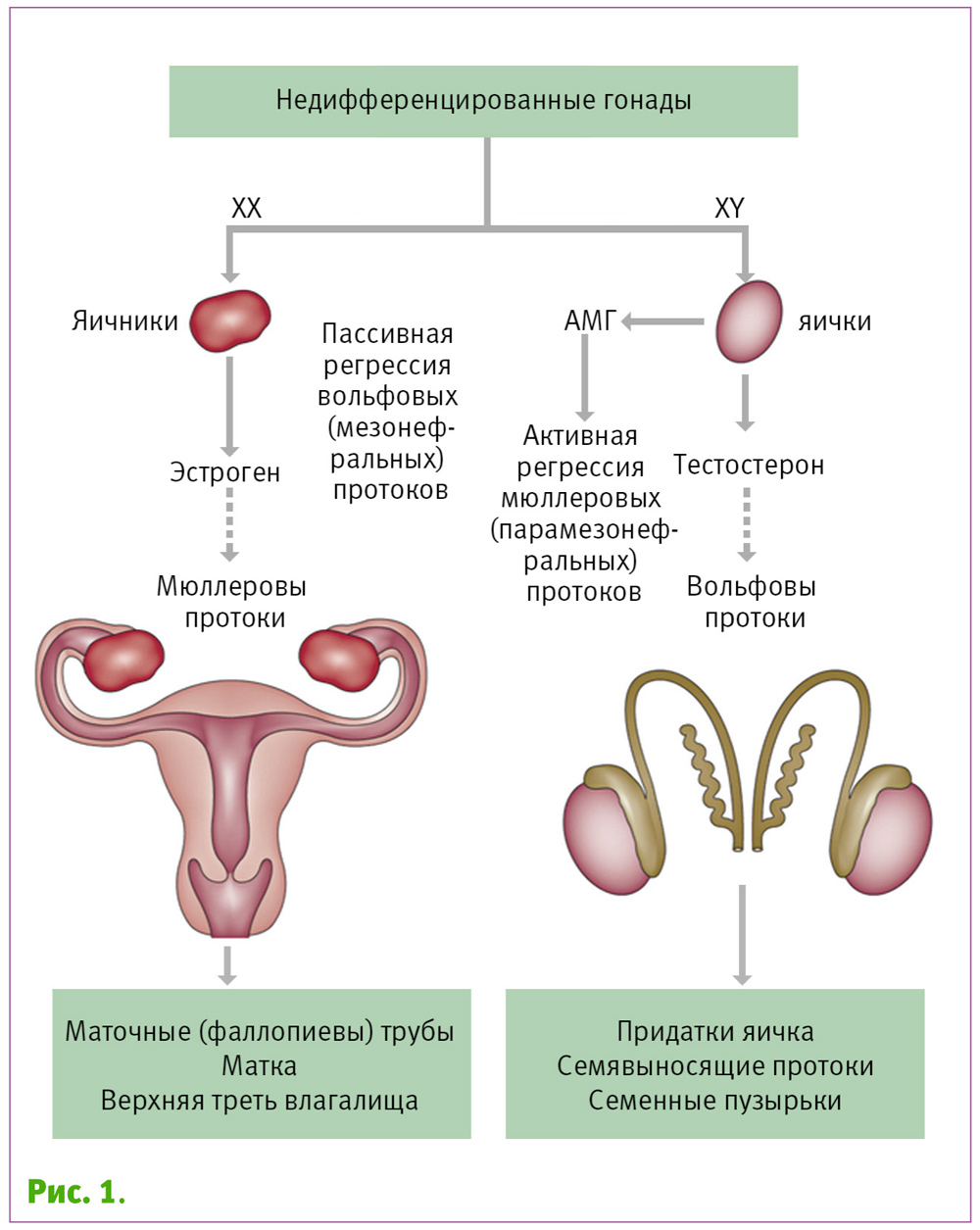
Правильное развитие женской репродуктивной сферы включает в себя ряд четко организованных взаимодействий, направленных на дифференцировку мюллеровых протоков и урогенитального синуса (УГС) для формирования внутреннего полового тракта. Несмотря на то, что мюллеровые протоки (мезодерма) и УГС (эндодерма) происходят из разных зародышевых листков, развитие их тесно взаимосвязанно. Мюллеровы протоки дают закладку внутреннему половому тракту, из них дифференцируются маточные трубы, матка, шейка матки и верхняя часть влагалища. УГС дает развитие нижней и средней трети влагалища (рис. 1).
Когда происходит прерывание или нарушение регуляции на любом этапе процесса дифференцировки, миграции, слияния и канализации, может произойти формирование широкого спектра разнообразных МА [20]. Важно, что другие врожденные пороки развития часто ассоциированы с МА. Внутриутробное развитие почек и всей мочевыделительной системы тесно связано с формированием репродуктивного тракта и это самая частая комбинация расстройств. Нарушение местного развития мезодермы и ее смежных сегментов считается взаимосвязаным с аномалиями осевого скелета. Значительно реже описываются ассоциированные пороки сердца и слуха.
Морфогенез яичников осуществляется из других зачаточных путей и абсолютно независим от дифференцировки системы мюллеровых протоков. Соответственно, у женщин с МА яичники и их эндокринная функция работают нормально.
Между 5–6 неделями развития эмбриона возникают половые протоки из парных мезонефральных (вольфовых) и парамезонефральных (мюллеровых) протоков, а гонады – из промежуточной мезодермы в мочеполовом тракте.
Они индифферентны до 7 нед. гестации и их дифференцировка зависит от наличия или отсутствия SRY (Sex-determining Region of Y-chromosome).
И при отсутствии SRY гонады развиваются в яичник с оогониями и стромальными клетками. Так как тестостерон не вырабатывается, мезонефральные протоки регрессируют.
Благодаря отсутствию MIS (Mullerian inhibiting substance – мюллеровская ингибирующая субстанция) парамезонефральные (мюллеровы) протоки сохраняются и формируют маточные трубы, матку и верхнюю треть влагалища.
Примерно с девятой недели формируются яичники, вольфов (мезонефральный) и мюллеров (парамезонефральный) протоки соединяются. В хвостовой части эти протоки сливаются, чтобы сформировать маточновлагалищный канал (из которого позже и формируется матка, шейка и верхняя треть влагалища).
Полное развитие влагалища происходит путем синтеза структур синуса и мюллерова бугорка. Краниальная часть канала, т. е. та часть, которая не «сливается», открывается в брюшную полость, что приводит к формированию маточных труб [21, 22, 23, 24, 25].
Маточные аномалии связаны с дефектами формирования (образования), слияния (объединения) и абсорбции (поглощения). Дефекты возникают в результате неполного слияния каудальной части спиралей с мюллеровыми протоками (нарушение бокового синтеза) или неполного слияния структур урогенитального синуса с мюллеровым бугорком (нарушение вертикального слияния). Неудачи в боковом слиянии могут привести к удвоению матки, формированию двурогой или аркуатной матки.
Когда дефект возникает в вертикальном слиянии, формируются такие аномалии как: неперфорированная девственная плева, поперечная или косая перегородка влагалища или отсутствие шейки матки. При каудальном слияние каналов, оставшаяся часть центральной перегородки поглощается. Нарушения абсорбции (поглощения) приводят к формированию частичной или полной перегородки. Некоторые пороки развития полости матки также могут привести к формированию гипопластичной (инфантильной) и Т-образной маток [26, 27].
Причины МА до сих пор не выяснены. Нарушения могут быть генетические (мутация HOXA 10 гена) или вторичные – в результате материнско-фетального воздействия.
Генетика МА сложна. В большинстве случаев они возникают спонтанно и большинство семейных случаев многофакторные. Существуют также и другие способы наследования, в том числе аутосомно-доминантный, аутосомно-рецессивный и Х-сцепленные нарушения. МА могут также представлять собой компонент синдрома множественных пороков развития [37, 38, 24].
Нормальный кариотип (46 XX) определяется у 92%, а аномальный (с мозаицизмом половой хромосомы) – у 8% таких женщин.
Большинство из этих аномалий развития являются нечастыми и носят спорадический характер, таким образом, связаны с полигенными и многофакторными причинами. Например, недавнее исследование предлагает отнести внутриутробное сохранение перегородки к дефициту антиапоптического белка Bcl 2, который отвечает за процесс апоптоза и абсорбции перегородки [28].
Такие состояния, как гипоксия во время беременности, использование лекарственных препаратов (например, метотрексата, диэтилстильбэстрола, талидомида), ионизирующее излучение и вирусные инфекции также могут способствовать развитию аномалий мюллеровых протоков. Диэтилстильбэстрол относится к нестероидным эстрогенам, которые широко использовались в 1950-е годы (в основном, в США) для лечения различных акушерских отклонений, в частности выкидыша и преэклампсии. Последующие аномалии, такие как аденокарциномы влагалища и деформация полости матки (Т-образная форма), выявлялись у дочерей женщин, принимавших этот препарат [6].
Классификация
Идеальная система классификации должна быть основана на патогенезе и должна помочь выбрать соответствующую терапевтическую стратегию. Развитие матки и влагалища во время внутриутробного периода занимает длительный период времени. Известные и неизвестные патогенные факторы могут повлиять на этот процесс.
МА группируют в соответствии с дефектом формирования, в результате которого развился конкретный порок. Эта классификационная форма, включающая агенезию/гипоплазию, боковые дефекты слияния, вертикальные дефекты образования и ДЭС-ассоциированные аномалии, не является взаимоисключающей. В клинической практике часто выявляются сочетанные формы МА.
Наиболее распространенными МА является патология влагалища и матки, при которых в большей степени возможна хирургическая коррекция. Агенезия влагалища является следствием поломки в развитии синовагинальной луковицы. При ее отсутствии влагалищная пластина не формируется и матка, как правило, отсутствует, т. к. именно маточно-вагинальный зачаток дает дифференциацию синовагинальной луковице [22].
Агенезия влагалища часто ассоциируется с аномалиями мочевого тракта. Частичная агенезия влагалища на фоне нормально сформированного верхнего отдела генитального тракта является редкостью и должна быть дифференцирована с атрезией влагалища [39]. Атрезия влагалища появляется при пороке развития УГС и обычно ассоциируется с нормальным развитием мюллеровых протоков [39, 40].
Агенезия шейки матки (класс Ib) – редкая патология, формирующаяся на фоне полной или частичной агенезии влагалища (41). Дополнительные аномалии включают атрезию шейки и дефекты, связанные с изменением длины, ширины и/или размера шейки [42]. Изолированные дефекты шейки матки также являются редкостью [6].
Агенезия фаллопиевых труб (класс Ib) – редкое состояние [24]. Изолированные дефекты маточных труб – также редкая аномалия, включающая: дополнительные устья, удвоение труб, отсутствие мышечного слоя, эктопическую локализацию, атрезию просвета и отсутствие ампулярного отдела со слепо оканчивающимся фимбриальным отделом [43, 44]. Большинство пороков маточных труб не поддаются хирургической коррекции, для достижения беременности в таких случаях рекомендуются вспомогательные репродуктивные технологии.
Нарушения латерального (горизонтального или продольного) слияния (объединения) проявляются широким спектром структурных аномалий. По AFS (American Fertility Society) классификации они включены в классы II–VI. Латеральные дефекты слияния делятся на симметричные и асимметричные группы и далее подразделяются на обструктивные и не обструктивные категории. Поломки развития могут происходить на разных этапах и включают неполное слияние каудальных мюллеровых протоков, дефект абсорбции перегородки, а также дефекты в развитии всего или части протока.
Асимметричные обструктивные дефекты латерального слияния часто ассоциированы с односторонним мезонефральным недоразвитием и проявляются в виде ипсилатеральной почечной агенезии и/или агенезии мочеточника [6, 45, 46]. Также включены в классификацию горизонтальные влагалищные перегородки, т. к. некоторые эксперты утверждают, что они возникают как следствие дефекта латерального образования (хотя есть гипотеза о возникновении вследствие мезодермальной гиперпролиферации или сохранения эпителия при канализации [24]).
Нарушение вертикального (поперечного) слияния – результат аномальной канализации влагалищной пластинки и в некоторых случаях – дефекта слияния маточновлагалищного зачатка и синовагинальной луковицы [22].
Эти нарушения могут привести к образованию поперечной влагалищной перегородки (ПВП), заращению девственной плевы и, в крайних случаях, – к атрезии влагалища. ПВП в зависимости от дефекта бывает полной или частичной и может сопровождаться аномалиями мочевых путей.
Внутриутробное воздействие ДЭС может влиять на развитие женской репродуктивной системы. Около половины женщин, подвергшихся влиянию ДЭС внутриутробно, имеют аномалии полости матки [47]. Воздействие ДЭС также связано с пороками развития нижнего отдела генитального тракта. Аномалии матки, схожие с внутриутробным воздействием ДЭС, зарегистрированы и у женщин без такого влияния [48].
Эта классификация МА имеет большое значение, т. к. точно коррелирует с анатомическими дефектами и поломками в морфогенезе; однако этот метод неудобен для клинического использования и вызывает путаницу при попытке стандартизировать аномалии для проведения исследований, сравнений и для планирования стратегий лечения. Были разработаны и другие схемы классификации (Toaff et al. [49]).
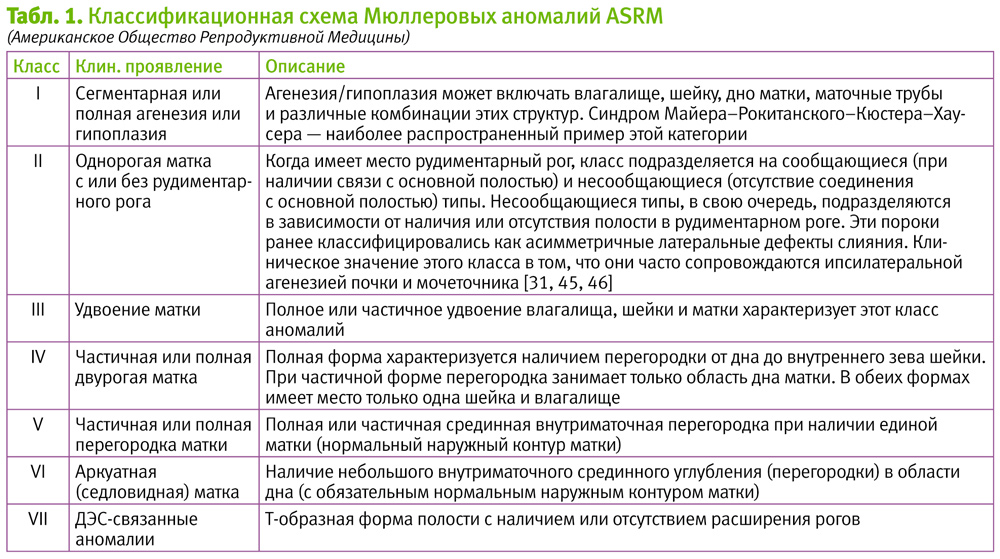
Наиболее рапространенной является классификация AFS 1988 г. Она распределяет МА в соответствии с основным анатомическим дефектом и позволяет стандартизировать методику отчетности при проведении исследований. Эта классификационная система базируется на схеме Battram&Gibbons [45], которые скомбинировали степень выраженности порока с клиническим проявлением, и включает 7 классов (табл. 1, рис. 2).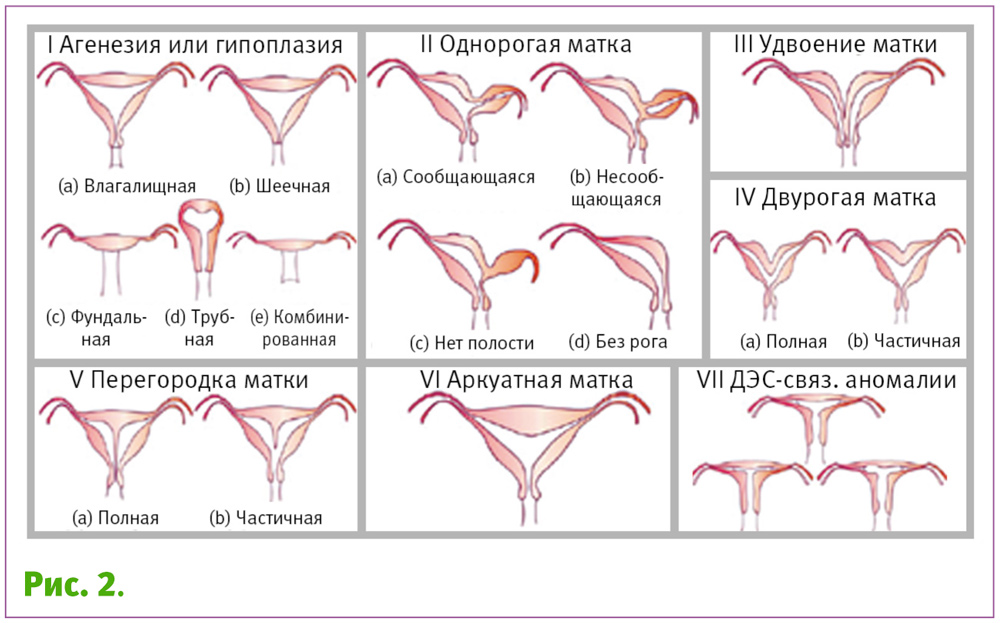
Попытки классифицировать аномалии развития матки, шейки матки и влагалища предпринимались регулярно, так W. Tarry (1986) на основе работ I. Monie and L. Sigurdson (1958) и Muller (1968) создали кодированную систему, где символом М обозначалась вся Мюллерова система [213, 214]. Код М0 говорит о хорошо развитой системе, М1 и М2 – различные варианты аномалий, М3 – тотальная аплазия матки и влагалища. Симметричные пороки могут быть закодированы как М0:М0 или М1:М1 и т. д. А асимметричные пороки – М0:М1 и т. п. [213, 214]. Вопрос в том, что вся мюллерова система поражается редко. Но как выделить в этой системе пороки развития отдельно влагалища или матки?
В 2005 г. была создана классификация VCUAM, названная по первым буквам английских названий: влагалище (Vagina), шейка матки (Cervix), матка (Uterus) и другие пороки (Associated Malformations) [215].
Классификация была разработана для того, чтобы точно описывать фенотип пороков развития женских половых органов, морфологически и анатомически. По нашему мнению, данная система очень сложная и не раскрывает патогенеза порока. В последующем трудно расшифровать код порока без использования специальной таблицы. Например, что означает ситуация ‘V0,C0,U4a,A#,M#’ в данной системе координат?
Наконец, в 2013 г. создана новая классификация Европейской ассоциации репродуктологов и Европейской ассоциации гинекологов «The ESHRE-ESGE consensus on the classification of female genital tract congenital anomalies» [216, 217]. В создании классификации приняли участие многие специалисты, которые работали по методу DELPHI, и пришли к соглашению [216]. Итоговая версия классификации ESHRE/ESGE не прошла процедуру широкого обсуждения коллег (not externally peer-reviewed), а была утверждена исполнительным комитетом ESHRE/ESGE [216].
Перечень литературыинаходится в редакции.
Продолжение в следующем номере.


коментарів