
ЧИ МОЖЛИВО ВПЛИВАТИ НА ФОРМУВАННЯ ПЛАЦЕНТИ. Неординарний досвід
 Переоцінити значення плаценти для плоду неможливо. Цей універсальний орган, який на клітинному та молекулярному рівнях забезпечує ріст та розвиток плода, змінювався в процесі еволюції, помножуючи механізми компенсації. До вашої уваги неординарний досвід фахівців з Білорусі (Дивакова Т. С. та ін.), які вивчали, чи можливо та як саме впливати на формування плаценти
Переоцінити значення плаценти для плоду неможливо. Цей універсальний орган, який на клітинному та молекулярному рівнях забезпечує ріст та розвиток плода, змінювався в процесі еволюції, помножуючи механізми компенсації. До вашої уваги неординарний досвід фахівців з Білорусі (Дивакова Т. С. та ін.), які вивчали, чи можливо та як саме впливати на формування плаценти
Одним з найважливіших завдань плаценти є захист. Базовим моментом цього захисту є запобігання реалізації тяжкої плацентарної недостатності та порушення материнської гемодинаміки. Вирізняють декілька механізмів формування плаценти, до них належать васкулогенез, ангіогенез та ремоделювання спіральних артерій. Розуміти значення цих механізмів нам допомагає досвід секцій абортного матеріалу. Доведено – у вагітності, що протікала фізіологічно, розмір судин практично вдвічі більший, ніж у вагітності, що перервалася спонтанно.
Важливим є і той факт, що швидкість кровоплину в розширених та змінених судинах не зростає одночасно зі збільшенням просвіту. Буферну функцію виконують спеціальні «греблі» – цитотрофобластичні затори, вони уповільнюють плин крові в судинах хоріону, що захищає клітини ембріону від надлишку кисню та зменшує процеси перекисного окислення ліпідів. Якщо цитотрофобластичні затори – у недостатній кількості, відбувається централізація матково-плацентарного кровообігу, що призводить до механічного пошкодження хоріону, і утворюються ретроплацентарні гематоми, клінічним проявом цього процесу є мимовільні викидні.
Васкулогенез – це утворення нових судин, і цей період триває з 18 до 35 дня від зачаття. Ангіогенез – процес розгалуження та росту судин – розпочинається з 21 дня внутрішньоутробного розвитку, триває до пологів та проходить у два принципово відмінні етапи. Спочатку судини активно розгалужуються і по досягненню гестаційного терміну 28–30 тижнів ростуть переважно у довжину. Основний вплив на ріст чинять васкулярний ендогенний фактор росту (VEGF) та плацентарний ендогенний фактор росту (PEGF), джерелом яких є цитотрофобласт. Причому вплив VEGF переважає у І триместрі вагітності, а PEGF – у ІІІ триместрі.
Такі зміни поперемінного домінування цитокінів корелюють зі змінами типів формування хоріонів – із такого, що активно розгалужується у І–ІІ триместрах, що забезпечує ріст плаценти, до такого, що не галузиться та лежить в основі формування термінальних ворсин ІІІ триместру. Певні порушення кровоплину в плаценті, як то ретроплацентарні гематоми, спричиняють надлишкову експресію рецептора VEGF-1.
Це своєрідна пастка для васкулярного ендогенного фактору росту:
- по-перше, недостатня дія васкулярного фактору росту призводить до неповноцінного розгалуження хоріону, неповноцінного формування плаценти на ранніх стадіях її розвитку.
- по-друге, ішемія епітелію хоріального дерева спонукає до подовженого утворення VEGF, це порушує баланс двох вищезгаданих VEGF та PEGF, і, як наслідок, – нестача PIGF у ІІІ триместрі призведе до неповноцінного формування термінальних ворсин та порушеної адаптації плаценти до плода.
Такий дисбаланс чинників ангіогенезу і є причиною низької ефективності лікування гестаційних ускладнень (пізнього гестозу, передчасних пологів, плацентарної дисфункції) у час їх реалізації та можливості діагностики. Таким чином, це той випадок, коли профілактика та ранні заходи – понад усе.
Задля ефективної профілактики можливого розвитку патології будь-який вплив повинен розпочатися на стадії васкуло- та ангіогенезу. Вибір за препаратами…
Застосування ацетилсаліцилової кислоти у ранні терміни вагітності з метою попередження різноманітних акушерських ускладнень було запропоновано ще у середині ХХ сторіччя, ґрунтуючись, головним чином, на антиагрегантній дії цього препарату.
На початку ХХІ сторіччя проведене мультицентрове дослідження, де ацетилсаліцилова кислота використовувалася для профілактики пізнього гестозу. Автори не виявили доказів зниження частоти пізнього гестозу взагалі, втім, переконливо свідчили про зменшення кількості випадків, коли пізній гестоз став причиною ургентного розродження. Тобто прийом низьких (75–100 мг/добу) доз аспірину не дозволяє попередити розвиток пізнього гестозу, але значно зменшує ризик ускладнень як для матері, так і для плода.
Складні молекулярні дослідження останніх десятиріч показали багатогранну дію ацетилсаліцилової кислоти на розвиток гестаційних ускладнень. Крім пригнічення синтезу тромбоксану А, що проявляється антиагрегантною дією, препарат блокує активність циклооксигенази, зменшує утворення прозапальних простагландинів, що є одним із провідних чинників скоротливої активності матки. Виходячи із концепції інфекційно-запальної теорії передчасної пологової діяльності, саме інгібітори циклооксигенази є найбільш патогенетично обґрунтованими токолітиками невідкладної дії.
Дія аспірину реалізується і на етапі розвитку плаценти – препарат пригнічує експресію VEGF на межі ІІ–ІІІ триместрів, що призводить до фізіологічного домінування PIFG та формування повноцінних термінальних ворсин.
Ще одним фізіологічним біологічним чинником для попередження патології вагітності, є прогестерон. Численні шляхи позитивного впливу гормону на процеси плацентації далеко не обмежено компенсацією його дефіциту. Потужним механізмом протективної дії є блокада синтезу інтерлейкіну 8, котрий активує коллагенази шийки матки. Отже прогестерон забезпечує захист щодо структурних змін шийки матки – вкорочення та згладжування.
Прогестерон позитивно впливає на процеси інвазії трофобласту шляхом стимуляції росту та ремоделювання спіральних артерій, а також посилення експресії VEGF, що покращує процеси ангіогенезу.
Одним із найбільш гучних наукових повідомлень сучасності стала низка досліджень під керівництвом R. Romero, присвячених ефективності профілактичного застосування препаратів прогестерону у вагітних, що не мають симптомів передчасної пологової діяльності та у терміни 20–22 тижні, а також мають коротку шийку матки, що визначено вагінальною цервікомтерією. Крім вірогідного зниження частоти передчасних пологів у разі застосування такими вагітними екзогенного прогестерону, показано зменшення рівнів перинатальної та неонатальної смертності.
Та на шляху подолання проблеми передчасних пологів виникає проблема сенсибілізації до натурального прогестерону. Саме таку нечутливість рецепторів прогестерону в усіх тканинах спостерігають у 42% пацієнток із когорти жінок із звичним невиношуванням, що, власне, і є причиною переривання вагітності, а також низької ефективності лікування препаратами прогестерону. В таких випадках допоможе дідрогестерон (Дуфастон®).
Дослідниками обстежено 96 жінок з ускладненим перебігом вагітності (основна група) і 22 пацієтки з фізіологічною вагітністю та родами здорових немовлят (контрольна група).
Критеріями віднесення пацієнток до основної групи були наступні стани:
- наявність під час попередньої вагітності гестозу з передчасним відшаруванням нормально розташованої плаценти, синдромом затримки росту або внутрішньоутробною загибеллю плоду, звичне невиношування, прогестерон-дефіцитні стани і хронічний ендометрит;
- ускладнений перебіг вагітності у I–II триместрі (загрозливий викидень, передлежання плаценти та інше);
- плацентарні порушення у I–II триместрі за даними УЗД у режимах 2D і 3D.
Половина пацієнток основної групи отримала комбінацію аспірину в дозі 75 мг/добу з 12 по 26 тиждень та дідрогестерону в дозі 20 мг на добу з 7 по 20 тиждень для профілактики гестаційних ускладнень у вагітних високого ризику, а 41 пацієнтка відмовилась від терапії.
Призначення такої комбінації виявилось ефективним з огляду на формування плацентарної гемодинаміки – за допогомою 3D-доплерометричного дослідження вже в 18 тижнів на тлі лікування відмічено не лише істотне збільшення індексу васкуляризації (Vi) плаценти (вмісту судинних елементів в одиниці площі плацентарної тканини), а й вірогідне зростання темпів збільшення цього показника. У морфологічному сенсі це свідчить про більш інтенсивний процес утворення та розгалуження нових судин, ніж у групі вагітних без лікування.
Водночас виявлено відносне зменшення індексу потоку (Fi) – медіани яскравості доплерівських кольорових сигналів, що є відображенням інтенсивності кровоплину. Дані доплерометрії підтверджено лабораторними дослідженням – у вагітних високого ризику, що не отримували лікування наприкінці відповідального ІІ триместру, виявляли підвищені концентрації VEGF та знижені – PIGF, що свідчило про збереження активності хоріону до розгалуження та порушення адаптаційного процесу утворення нерозгалужених термінальних ворсин.
Натомість аналогічна за складом група вагітних високого ризику, пацієнтки якої отримували вказану лікувальну комбінацію, мала зниження середніх показників вмісту VEGF та поступове зростання його функціонального антагоніста – PIGF, як це було притаманно і вагітним без чинників ризику гестаційних ускладнень.
При подальшому клінічному спостереженні за вагітними було показано, що:
призначення комбінації аспірину 75 мг та Дуфастону 20 мг у І–ІІ триместрах призводить до вірогідного зниження частоти спонтанного викидня, передчасних пологів, плацентарної дисфункції та пізнього гестозу.
Водночас, не було виявлено жодного негативного впливу на перебіг власне пологів та післяпологового періоду, зокрема – частоти післяпологових кровотеч. Позитивний вплив спостерігають також і на перебіг неонатального періоду – крім зменшення частки недоношених новонароджених, застосована схема зменшує ризик ішемічних та інфекційних ускладнень.
Детальніше
НАВІЩО ЖІНЦІ АНДРОГЕНИ? (ЧАСТИНА 2)
Андрогени традиційно вважають «чоловічими» гормонами, і в контексті здоров’я жінки звичайно говорять лише про їхній надлишок, який проявляється, наприклад, надмірним ростом волосся на тілі або вуграми. Однак андрогени відіграють фізіологічну роль і в жіночому організмі, де відповідають за понад 200 важливих функцій
Забагато чи замало?
Лабораторна діагностика
Дослідження рівнів загального тестостерону у крові виконують майже 50 років. Новішим показником є вільний тестостерон, який застосовується останні кільканадцять років для визначення фракції тестостерону, яка досягає тканин і яка власне і зумовлює андрогенну дію. Однак визначення рівня вільного тестостерону у жінок супроводжується кількома недоліками.
По-перше, немає чітких порогових значень (слід пам’ятати, що ці порогові значення індивідуальні для лабораторії, і саме на них варто орієнтуватися).
По-друге, при низьких концентраціях тестостерону неминуча суттєва похибка, зумовленоа лімітом точності сучасних діагностичних систем. Тому вважають, що з практичних міркувань визначення вільного тестостерону у жінок і дітей не є доцільним, натомість треба визначати індекс вільного андрогену (free androgen index – FAI), який характеризує реальну частку вільного тестостерону та який вираховують за формулою:
Індекс вільного андрогену = загальний тестостерон (нмоль/л) /SHBG (нмоль/л) x 100%.
При цьому пам’ятаємо про необхідність перерахунку рівня тестостерону, якщо він подається в нг/мл:
Нг/мл х 3,5 = нмоль/л.
Цей показник визначають у ранню фолікулярну фазу. У нормі індекс вільного андрогену не повинен перевищувати 5.
Проблема «п’яти волосків»
У повсякденній практиці часто трапляється гіпердіагностика гіперандрогенії. Найчастіше самі пацієнтки звертаються до лікаря з підозрами на наявність «гормональних розладів» та «надлишку чоловічих гормонів», підставою для яких є поява незначного надлишку волосся над верхньою губою, на ареолах чи нижній серединній лінії живота.
Тут звичайно припускаються кількох суттєвих помилок.
По-перше, надмір волосся не можна оцінювати довільно. Корисним діагностичним інструментом є шкала Феррімана-Голуея (Ferriman-Galway score), у якій характеристика росту волосся на кожній із андрогенозалежних ділянок позначена відповідною кількістю балів. Далі усі ці бали додаються. Про гірсутизм говорять лише у тому випадку, якщо загальна кількість балів перевищує 8. На практиці це означає, що не у кожної жінки із кількома волосками на підборідді, ареолах та нижній серединній лінії живота є гірсутизм. У таких випадках слід переконати жінку, що у неї варіант нормального росту волосся, який трапляється досить часто і не мусить супроводжуватися гормональними розладами.
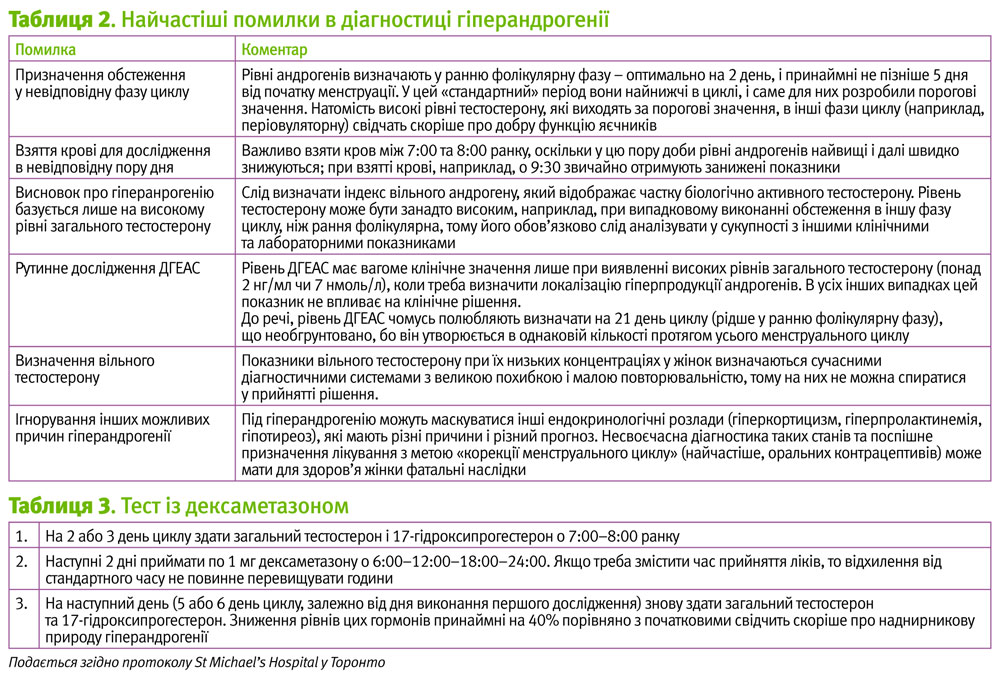
Другою типовою причиною гіпердіагностики є недотримання протоколу обстеження на наявність гіперандрогенії (табл. 2).
Треба пам’ятати, що діагноз гіперандрогенії дуже відповідальний: зазвичай жінка надзвичайно боляче сприймає факт надлишку в її організмі чоловічих гормонів, оскільки це завдає суттєвого удару по її жіночості та самоакцептації. Хаотичність у веденні таких пацієнток та недотримання рекомендацій часто призводить не тільки до необгрунтованого призначення багатьох непотрібних лабораторних обстежень та марних витрат коштів, але й до невдалої інтерпретації результатів, непотрібних хвилювань пацієнтки та її родини, а інколи й до призначення неоптимального лікування, яке ще більше розгойдує і без того хисткий метаболічний баланс.
Цікаво ілюструє це такий клінічний випадок:
Незаміжній пацієнтці віком 28 років, яка звернулася зі скаргами на довгі цикли (до 38–45 днів) та появу кількох жорстких волосків на підборідді – усього їх було п’ять – без достатніх обстежень призначили фінастерид та оральні контрацептиви. Через кілька тижнів такого лікування дівчина помітила, що у неї суттєво змінився запах тіла та поруділо волосся (природно вона русява) – зі слів дівчини, вона «перестала себе пізнавати». Налякавшись, пацієнтка припинила приймати медикаменти, після чого протягом трьох з половиною місяців менструації були цілком відсутні, однак зовнішність і запах стали знову такі, як раніше. При обстеженні в іншій установі лабораторних проявів гіперандрогенії не підтвердили, натомість виявили надмірну вагу та інсулінорезистентність. Оскільки дівчина не була зацікавлена у реалізації репродуктивних планів найближчим часом, рекомендації щодо корекції її стану полягали у налагодженні харчування та збільшенні фізичної активності, результатом чого мала бути нормалізація маси тіла. Кілька волосків на підборідді, які завдавали пацієнтці тяжких переживань щодо її зовнішності, видалили косметичним шляхом. Такі заходи дали змогу з часом відновити цикл, а дівчина була цілком задоволена лікуванням.
Алгоритм обстеження
Оскільки часто в обстеженні жінок із підозрою на гіперандрогенію покладаються не на загальноприйняті настанови, а на власну лікарську фантазію, доцільно нагадати послідовність обстеження таких пацієнток.
- Крок 1 – визначення рівня загального тестостерону та глобуліну, який зв’язує статеві гормони (SHBG) – індекс вільного андрогену в нормі не повинен перевищувати 5. Треба пам’ятати, що рівень тестостерону визначають у ранню фолікулярну фазу (не пізніше 5 дня природного циклу або після індукованої екзогенним прогестероном кровотечі; і лише при стабільній аменореї цей тест можна виконати будь-коли). При завищених названих показниках переходять до наступних кроків.
- Крок 2 – при виявленні рівня тестостерону понад 2 нг/мл (7 нмоль/л) треба запідозрити андрогенопродукуючу пухлину, яка може походити як з яєчника, так і наднирника. Для диференціації у таких випадках визначають ДГЕАС: при його рівні понад 600 мкг/дл пухлина очевидно міститься в наднирнику, при меншій величині – в яєчнику.
- Крок 2а – в усіх інших випадках – виключення іншої причини гіперандрогенії:
- Синдром Кушинга: визначення ранкового рівня кортизолу (7:00–8:00) після приймання 1 мг дексаметазону о 23:00 попереднього дня. У нормі цей показник не повинен перевищувати 1,8 мкг/дл (50 нмоль/л). При вищих показниках треба запідозрити синдром Кушинга і виконати докладніше обстеження. Можливі й інші варіанти такого обстеження (вони описані в багатьох джерелах), які однак менш зручні.
- Вроджена гіперплазія наднирників, некласична форма: при перевищенні верхнього порогового рівня 17-гідроксипрогестерону (він індивідуальний для лабораторії) виконують тест з АКТГ. Названий стан вважається підтвердженим, якщо рівень 17-ОНР при цьому зростає вище характерного для лабораторії порогового значення. Треба пам’ятати, що це обстеження виконують в ранню фолікулярну фазу. Така диференціація дуже важлива, оскільки лікування гіперандрогенії при вродженій гіперплазії наднирників суттєво відрізняється від лікування яєчникової гіперандрогенії, характерної для СПКЯ. На жаль, через недоступність препаратів АКТГ в Україні досконало виконати цей крок диференціальної діагностики неможливо. Якоюсь мірі його можна замінити тестом з дексаметазоном, один із варіантів якого представлений у таблиці 3.
- Визначення рівнів ТТГ та пролактину: надто високі рівні цих гормонів можуть спричинити прояви гіперандрогенії, головним чином за рахунок зниження утворення яєчникових естрогенів та зумовленого цим зниження продукції SHBG. Слід зауважити, що подібний механізм спостерігається при характерній для СПКЯ інсулінорезистентності, коли синтез названого білка в печінці суттєво гальмується високим рівнем інсуліну.
Кінцевою точкою цього протоколу є підтвердження або заперечення яєчникової гіперандрогенії, яка є одним із діагностичних критеріїв СПКЯ. Особливості діагностики та лікування цього стану докладно описані в інших джерелах і в цій статті не висвітлюються. Можна хіба що додати, що гіперандрогенія при СПКЯ є радше наслідком, а не причиною патологічних симптомів, а добре відомі хворобливі прояви спричинені інсулінорезистентністю.

Таємничий ДГЕА
Дегідроепіандростерон та дегідроепіандростерону сульфат (ДГЕА та ДГЕАС) – це прогормони із практично відсутньою андрогенною чи естрогенною активністю, які у великій кількості утворюються в наднирниках і можуть перетворюватися як у андрогени, так і в естрогени. Така конверсія відбувається у жировій тканині, волосяних фолікулах, сальних залозах і печінці. Їх рівні в обох статей найвищі у 30-річному віці, а далі поступово зменшуються.
Завдяки приблизно у 300 разів вищій концентрації у клінічній практиці переважно визначають рівень сірчаного ефіру ДГЕА – ДГЕАС. Рівень цього стероїду практично однаковий упродовж усього менструального циклу, оскільки регулюється винятково АКТГ і не реагує на гонадотропні гормони гіпофізу.
Цікаво, що ДГЕАС або рідше ДГЕА часто включають у рутинне обстеження пацієнток з підозрою на гіперандрогенію, що цілком безпідставно. Визначення ДГЕАС дає корисну інформацію лише в небагатьох ситуаціях, зокрема, при суттєво підвищеному рівні загального тестостерону, коли треба диференціювати місце утворення надлишку андрогенів.
Можна ще згадати, що рівень ДГЕАС може бути трохи підвищеним при СПКЯ (що не свідчить про наднирникову патологію), а заниженим при дефіциті андрогенів або синдромі втоми наднирників (adrenal fatigue), однак у цих випадках визначення конкретної величини загалом не впливає на клінічне рішення.
Дефіцит андрогенів у жінок
Перша публікація про зв’язок дефіциту андрогенів та зниження лібідо у жінок з’явилася у 1959 році, однак прогресування досліджень у цьому напрямку відбувається повільно.
Про дефіцит андрогенів загалом стали говорити, починаючи з початку 2000-х років. Мабуть, однією з причин такої затримки була потреба в розробці адекватних лабораторних методик визначення рівнів цих гормонів в організмі жінки.
Можливі причини дефіциту анрогенів представлені в табл. 4. Симптоматика цього стану невиразна і проявляється головним чином зниженням статевого потягу, погіршенням настрою (часто це вважають проявом депресії), зниженням життєвого тонусу, безсиллям тощо (таблиця 5). Звичайно гіпоандрогенія залишається недіагностованою, а названі прояви приписують іншим соматичним або психологічним станам, ефекту стресу тощо.
Низькими вважають рівні загального тестостерону менше 25 нг/дл у жінок до 50 років і нижче 20 нг/дл у жінок понад 50 років. Для ДГЕАС заниженим вважають показник менше 150 нг/дл та 100 нг/дл відповідно. При показниках, які трохи перевищують названі, рівень тестостерону вважають пограничним. Однак треба пам’ятати, що основою діагнозу гіпоандрогенії завжди є клінічні прояви цього стану.
Чи потрібна замісна терапія?
Замісна терапія естрогенами в менопаузі та при інших станах (наприклад, первинній недостатності яєчників), сприяє згасанню вазомоторної симптоматики, поліпшенню стану слизових статевих органів, полегшує статевий акт, поліпшує самопочуття, проте мало впливає на зацікавленість співжиттям. Натомість додавання невеликих доз тестостерону у таких пацієнток суттєво поліпшує статеву функцію.
При цьому ставлення до замісної терапії тестостероном у цій ситуації неоднозначне.
Наприклад, у країнах Північної Америки андрогени у жінок загалом не застосовують, проте до такого лікування схвально ставляться в Австралії та Європі. Слід зауважити, що обізнаність жінок у цьому аспекті і вимоги до якості життя за останнє десятиліття суттєво зросли, що вимагає відповідного ставлення з боку лікарів.
Ідея замісної терапії андрогенами полягала перш за все у поліпшенні статевої функції у жінок у постменопаузі. Зараз вважають, що єдиною ситуацією, коли потрібно призначати ЗГА андрогенами, є розлад гіпоактивного статевого бажання (Hypoactive Sexual Desire Disorder, HSDD). Це стан, коли у жінки нема інтересу до статевої функції і ця відсутність інтересу спричинює у неї дистрес. У таких випадках призначають андрогени на 3–6 місяців, щоб перевірити, чи їх додавання призведе до поліпшення. Загалом, стандартної дози тестостерону немає: його титрують до досягнення терапевтичної відповіді і орієнтуються на клінічний ефект, а не на лабораторні показники.
Щодо безпеки, то варто пам’ятати, що надзвичайно важливо давати тестостерон у такий спосіб, щоб користь від нього не перевищувала потенційнох шкоди, яку може завдати цей препарат. Хоча є певні докази того, що замісна терапія андрогенами у менопаузі поліпшує статеву функцію, залишається багато нез’ясованих питань.
По-перше, чи доцільно призначати ці гормони жінками, які в усіх інших аспектах здорові?
Відомо, що побічними ефектами застосування тестостерону є некорисні зміни ліпідного профілю, а також поява вугрів та ріст волосся, зокрема, на обличчі, спині та грудній клітці. Зумовлений андрогенами серцевий ризик достатньо не вивчений, тому до такої терапії слід ставитися дуже обережно.
Загалом, Ендокринологічне товариство не рекомендує застосовувати андрогени у жінок з метою замісної терапії, за винятком пацієнток з HSDD.
Щодо препаратів ДГЕА, немає достатніх доказів їх ефективності у жінок з андрогенною недостатністю, і через це експерти не можуть рекомендувати їх для застосування. І все ж таки ДГЕА викликає великий інтерес як засіб для корекції проявів, що супроводжують старіння. Цікаво, що у більшості країн ДГЕА зареєстрований як харчовий додаток, а інтернет рясніє не цілком професійними повідомленнями про буквально універсальні властивості цього продукту. Однак є публікації й набагато серйозніші, зокрема, про успішне застосування ДГЕА у жінок з проявами дефіциту андрогенів: таке лікування давало змогу зменшити прояви депресії, сприяло енергійності та загалом ліпшому самопочуттю. Повідомляють про успішне застосування цього стероїду у репродуктивній медицині: застосування ДГЕА в дозі 25–75 мг/день підвищувало шанси на природну вагітність у жінок із первинною недостатністю яєчників та іншими станами, які супроводжуються гіпоандрогенією. Загалом, вважають, що застосування ДГЕА набагато безпечніше, ніж застосування тестостерону, і крім того, може бути можливим варіантом терапії у тих випадках, коли є протипоказання для застосування естрогенів.
Селективні модулятори андрогенних рецепторів (SARM) – це новий клас речовин, які зв’язуються з андрогенними рецепторами та відтворюють корисні ефекти андрогенів, однак не спричинюють інших ефектів андрогенів. В ідеалі таки препарати для жінок повинні підтримувати міцність кісткової тканини та статеву функцію, наприклад, посилювати лібідо, але без вірилізації, змін ліпідного профілю, дисфункції печінки тощо. Поки що вони є об’єктом наукових досліджень.
На закінчення
Розуміння позитивного впливу нормальних концентрацій андрогенів на фізіологічні процес в організмі жінки дає змогу подивитися на ці гормони у новому ракурсі. На відміну від звичного уявлення про те, що андрогени шкідливі для жінки і з ними треба «воювати» усіма можливими засобами, таке бачення спонукає до ретельної діагностики та «дружнього» ставлення до андрогенного статусу, який не менш важливий для жіночого здоров’я, ніж інші ланки метаболізму.
Перелік літератури знаходиться у редакції.
Детальніше
Пробиотики в гинекологии. Очередная мода или осознанная необходимость (аналитический обзор, часть 3)
Кто есть кто в мире пробиотиков или как правильно выбрать оптимальный вариант пробиотической защиты.
Детальніше«Зернинка до зернинки – от і ціла мірка!» спільний проект з «ФОНДОМ МЕДИЦИНИ ПЛОДА, УКРАЇНА»
Приховані знахідки
Плацентарні знахідки після пізніх проявів маленьких для свого віку вагітності плодів без допплерівських ознак плацентарної недостатності.
Детальніше
Моніторинг як інструмент покращення якості перинатальної допомоги
Як показує досвід європейських держав, постійне покращення якості медичної допомоги – найкращий спосіб скоротити загальні витрати та вдосконалити клінічні практики. Відповідно до міжнародних підходів, покращення якості медичної допомоги – безперервний процес, важливою складовою якого є моніторинг роботи медичного закладу. Моніторинг може здійснюватися різними методами, але одна з його основних задач – виявити наявні проблеми для того, щоб знайти шляхи їх вирішення.
Детальніше
Два в одному. Питання та відповіді
ІІІ об’єднаний всесвітній конгрес Міжнародної асоціації дослідження двоєн та фонду «Багатоплодова вагітність: глобальна перспектива». Угорщина, Будапешт. 16–19 листопада 2014 року.
Детальніше