 Очередная мода или осознанная необходимость
Очередная мода или осознанная необходимость
(аналитический обзор, часть 2)
Классификация пробиотиков
Современная классификация пробиотиков основана на различиях препаратов по составу и комбинациям живых микробных клеток со стимуляторами их роста и метаболитами. В зарубежных и отечественных литературных источниках [9, 10, 13, 17, 22, 24]используются следующие определения препаратов:
Пробиотики и эубиотики – два названия одних и тех же лекарственных средств, иными словами синонимы, и по своей сути не имеют никаких отличий. Относятся к числу бактерийных препаратов и представляют собой определенные штаммы микроорганизмов, которые являются представителями микрофлоры здорового человека.
Кроме термина «пробиотики», достаточно часто употребляются «пребиотики», «синбиотики» и «симбиотики».
Пребиотики – это субстанции или продукты функционального питания, в составе которых есть вещества, не перевариваемые в верхних отделах ЖКТ. Проходя через кишечник, они являются питательной базой для определенной группы микроорганизмов, преимущественно для бифидо- и лактобактерий, заселяющих толстый кишечник человека и положительно влияющих, в свою очередь, на состав микробиоценоза. Наиболее известные пребиотики — олигофруктоза, инулин, галакто-олигосахариды, лактулоза (препараты «Дюфалак», «Нормазе» и др.), олигосахариды грудного молока и др.
Растет количество фактов, что прием в качестве пробиотиков таких веществ как инулин и фрукто-олигосахариды, может стимулировать рост некоторых штаммов лактобацилл и бифидобактерий в кишечнике, потенциально изменяя их защитную антиинфекционную функцию. Однако, последующий эффект этих добавок на биоценоз влагалища и течение урогенитальных инфекций остается неизученным.
Синбиотики (от слова «синергизм» — «взаимное усиление эффекта действия») — препараты, полученные в результате рациональной комбинации пробиотиков и пребиотиков, что улучшает выживаемость и приживаемость пробиотиков в месте введения, а также избирательно стимулирует рост и жизнедеятельность индигенных лакто- и бифидобактерий.
Симбиотик (от слова «симбиоз» –сосуществование) – это сочетание в фармацевтических препаратах, БАД или пищевых продуктах двух и более пробиотиков, что усиливает их действие.
Пробиотики могут быть лекарствами, пищевыми добавками и пищевыми продуктами. В данном сообщении представлены сведения только о фармакологических пробиотических препаратах, рекомендованных для использования у гинекологических больных.
Современные пробиотики можно разделить на две группы — жидкие и сухие.
Жидкие пробиотики — это первоначальная форма бактерий в физиологически активном состоянии; специальная питательная среда, которая служит источником питания бактерий, находящихся в контейнере (флаконе); дополнительно введенные ингредиенты, усиливающие эффективность препарата (водорастворимые витамины, микро- и макроэлементы, аминокислоты и т. д.); метаболиты (продукты жизнедеятельности бактерий, находящихся во флаконе).
Физиологическое действие жидких пробиотиков может начаться сразу после введения в организм.
Несмотря на то, что жидкие пробиотики зарегистрированы как биологические добавки, все штаммы, на основе которых они разработаны, используются в фармацевтической промышленности, а технологии получения жидких концентратов бифидо- и лактобактерий наукоемки и требуют жесткого соблюдения стерильности и условий хранения (при 4–6ОС). Примером жидких пробиотиков гинекологического назначения является группа препаратов Симбитер.
Клиническая эффективность жидких пробиотиков для перорального введения зависит от прохождения самих культур живыми через агрессивные среды желудка и верхних отделов кишечника и их выживаемости в кишечнике. «Незащищенные» пробиотики подвергаются бактерицидному действию соляной кислоты, желчи и других ферментов ЖКТ и могут не достигать кишечника.
Сухие пробиотики – это лиофилизированные (высушенные) живые микроорганизмы, которые могут находиться в порошке, капсулах, таблетках. После употребления сухого пробиотика требуется от 1 до 4 часов для выхода бактерий из анабиоза (спящего состояния), после чего препарат начинает проявлять свое действие (адгезию, антагонизм и т. д.). Эти формы имеют длительные сроки годности (до 1 года) и не требовательны к непродолжительным изменениям температуры хранения.
Одним из недостатков сухих форм пробиотиков некоторые авторы считают частичную потерю при сушке активности пробиотических штаммов (из-за перевода их в анабиоз), а также потерю специфических рецепторов, которые помогают им закрепляться на поверхностях эпителиальных клеток, поэтому время их пребывания в кишечнике или влагалище сильно сокращается.
Есть также подозрение, что введение лиофилизированного пробиотика во влагалище, насыщенное большим количеством активных клеток вагинальной микрофлоры и ее антимикробных метаболитов, будет сопровождаться интенсивной гибелью вводимых бактерий и резким снижением их концентрации еще до начала восстановления жизнеспособности пробиотических штаммов, которая для некоторых лиофилизированных пробиотических штамов может составлять во влагалищной среде более 8 ч. в зависимости от условий реактивации [20].
В зависимости от способа введения пробиотиков в организм их делят на местные (влагалищные или ректальные) и оральные формы.
Вагинальные пробиотики чаще всего представлены в виде свечей местного действия для влагалища и состоят преимущественно из лактобактерий.
Местные пробиотики в силу известных причин получили наибольшее распространение в гинекологии, поскольку в большей степени соответствовали выработанным ранее принципам лечения инфекционных и дисбиотических заболеваний нижних половых органов с использованием антибактериальных средств: преимущественно местное применение, минимальное системное воздействие на организм, безопасность и удобство применения.
Вместе с тем, многие местные пробиотики на основе бифидобактерий и лактобацилл обладают недостаточной эффективностью, что привело к распространению полипрагмазии в пробиотикотерапии, назначению пациентам одновременно несколько препаратов различного состава. Это, прежде всего, касается пробиотиков, созданных на основе монокультуры одного из штаммов лактофлоры, а также лишенных пробиотической поддержки, особенно в тех случаях, когда пробиотики используются в схемах лечения вагинальных инфекций, при которых часто наблюдается слущивание кератоцитов и преобладание в пограничных зонах промежуточных клеток слизистой оболочки влагалища с низким содержанием гликогена [22, 24].
Следует отметить, что пробиотики на основе сахаролитических бактерий, рекомендуемых для акушерско-гинекологических целей, при их местном применении иногда активизируют рост дрожжеподобных грибов и вызывают риск развития или осложнения вульвовагинальных микозов, получивших в последние годы широкое распространение. Это требует особой осторожности при выборе препарата для пробиотической терапии гинекологических больных, особенно в период беременности.
Вопрос эффективности использования оральных форм пробиотиков для коррекции вагинальной микрофлоры обсуждается в научных и практических медицинских кругах до сих пор. Предполагается, что колонизация влагалища непосредственно связана с микрофлорой кишечника женщины. Пероральное применение «интравагинальных» штаммов Lactobacillus с целью достижения колонизации полостей прямой кишки и влагалища, представляет собой подход, моделирующий природные принципы. Пробиотики проходят через пищеварительную систему с колонизацией прямой кишки и миграцией пробиотиков из ануса во влагалище, а впоследствии колонизируют влагалище и и дистальные отделы уретры.
Анатомическая особенность близости расположения влагалища и ануса обеспечивает высокую частоту обмена микроорганизмами между кишечником и урогенитальным трактом. Установлено, что при вагинальных дисбиозах всегда резко возрастает в урогенитальном тракте концентрация кишечных микроорганизмов, чаще всего из родов Bacteroides, Fusobacterium, Peptostreptococcus, Clostridium, Eubacterium, Veillonella, Escherichia, Enterococcus и др. При этом в кишечном и в вагинальном биотопах заметно снижается популяционный уровень индигенных сахаролитических бактерий родов Lactobacillus, Bifidobacterium и Propionibacterium [22].
Хорошо известно, что вагинальные дисбиозы очень редко протекают изолированно от других микробных экосистем и, в первую очередь, сочетаются с дисбиозом пищеварительного тракта, который является основным резервуаром микрофлоры организма. Следовательно, уместно использовать не только вагинальные, но и пероральные пробиотики. В этом отношении пероральные формы пробиотиков для коррекции влагалищного дисбиоза имеют свои плюсы за счет параллельной коррекции состава кишечного биоценоза и блокирования путей транслокации возбудителей из кишечного ареала [9, 22, 24].
В последние годы получены новые данные, раскрывающие механизм эффективности оральных пробиотиков при вагинальном дисбиозе. Так, стало известно, что пробиотические штаммы лактобактерий успешно мигрируют из толстого кишечника во влагалище в составе микробной биопленки. Биопленка является одним из эффективных механизмов пространственной конкуренции лактобактерий с возбудителями кишечных и урогенитальных инфекций за прикрепление к поверхностным рецепторам клеток вагинального эпителия. Прикрепившиеся формы образуют диффузный монослой клеток, которые имеют ряд преимуществ над планктонным существованием микроорганизмов. В результате роста микроколоний лактобацил происходит формирование зрелой структуры биопленки с образованием полимерной матрицы, окружающей биопленку, которая обладает адгезивными свойствами и помогает концентрировать углерод, азот, фосфор и другие питательные компоненты, а сложная система каналов биопленки обеспечивает обитателей постоянным притоком питательных компонентов. Биопленки, помимо лактобацилл и бифидофлоры, почти всегда содержат и другие различные виды условно-патогенных микроорганизмов [24].
Зрелая биопленка представляет собой динамическую структуру, которая распространяется по всему объему на новые поверхности, в том числе и на поверхности промежности и слизистой оболочки влагалища из дистальных отделов кишечного тракта. Распространение колоний идет путем фрагментации группы микроорганизмов, которые открепляются от биопленки, но остаются заключенными в полисахаридную матрицу, что защищает их от внешних воздействий и позволяет продолжить рост, не нарушая структуры биопленки, которая охватывает практически все поверхности и слизистые оболочки человеческого организма.
Биопленки представляют собой вершину организации прокариотических сообществ. Как и в любом сообществе, взаимодействие между отдельными его членами жизненно необходимо для успешного существования всей популяции. Прокариоты взаимодействуют друг с другом, секретируя сигнальные молекулы, называемые аутоиндукторами, обеспечивают скоординированную экспрессию генов в группе микроорганизмов.
Состояние колонизационной резистентности влагалища связывают именно с резидентной микрофлорой, которая у женщин репродуктивного возраста представлена обширной группой лактобацилл. Благодаря специфической адгезии с помощью адгезинов (особых внешних структур бактерий), на эпителиальных клетках образуется биопленка, которая состоит из микроколоний лактобацилл, окруженных продуктами их метаболизма – гликокаликсом.
Неудачи, связанные с местным применением пробиотиков, некоторые авторы связывают именно с феноменом отсутствия пассажа лактофлоры по желудочно-кишечному тракту, в процессе которого большинство лактобактерий включается в состав пристеночной кишечной и влагалищной биопленки, а также в единую сигнальную систему опознания микробным сообществом, входящим в состав физиологических биопленок.
С позиций теории биопленки, экзогенной пробиотической флоре не всегда удается найти вакансии на сайтах связывания с эпителиоцитами влагалища, вследствие чего колонизация транзиторной лактофлоры проходит не всегда так успешно, как на селективных питательных средах in vitro.
Преодолеть этот барьер позволяет использование пробиотических штаммов с высокими адгезивными свойствами и их способностью разрушать патогенные микробные биопленки, что было не раз продемонстрировано в отношении ряда штаммов лактобациллы (штаммы L. rhamnosus GR-1, L. rhamnosus 35, L. reuteri RC-14). При этом, указанные штаммы в составе некоторых пробиотиков нередко обладают природной антибиотикорезистентностью, что позволяет использовать пробиотики, содержащие указанные штаммы микрофлоры, параллельно с антибактериальной терапией [4, 6, 13, 14].
Известно несколько поколений пробиотических препаратов. Если первой генерацией являются монокомпонентные про- и пребиотики, то последнее поколение — это комплексные препараты, которые в своем составе одновременно содержат несколько симбионтных штаммов и пребиотические компоненты.
В 1996 году была принята классификация препаратов-пробиотиков, нормализующих кишечную микрофлору, которая отражает эволюцию пробиотиков [9, 17, 20]. Эта классификация постоянно модифицируется в связи с появлением новых классов пробиотиков. В зависимости от компонентов и их комбинаций, в составе современных пробиотиков различают пять видов препаратов (табл. 2).
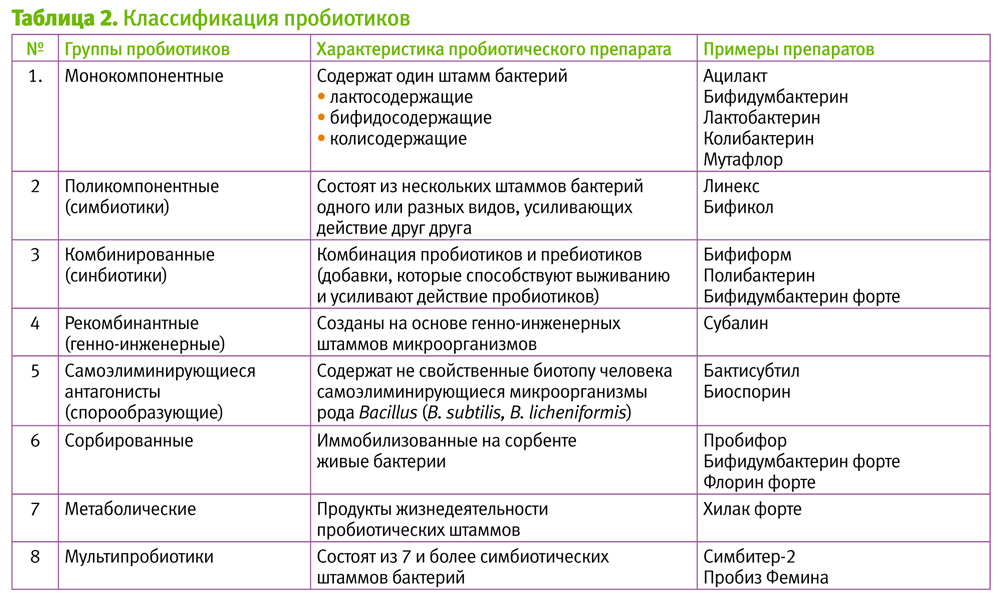
Монокомпонентные пробиотики считаются классическими. В их состав входит один конкретный штамм микроорганизма, обычно представители облигатной микрофлоры кишечника, в завимости от вида которого они классифицируются как бифидосодержащие, лактосодержащие или колисодержащие.
Согласно современным тенденциям в медицине, монокомпонентные пробиотики (бифидумбактерин и лактобактерин) применяются преимущественно для профилактики заболеваний или для коррекции микрофлоры в случае кишечного дисбактериоза I степени. При острой кишечной инфекции данные пробиотики рациональнее применять либо в комплексной терапии с другими биопрепаратами и сорбентами, либо (в случае необходимости) в реабилитационных курсах. Что касается колибактерина, то он используется, преимущественно, при колитах торпидного течения.
В гинекологической практике монокомпонентные классические пробиотики постепенно уступили свое место поликомпонентным и комбинированным пробиотикам или синбиотикам, которые содержат штаммы лактобактерий, полученных из биотопа влагалища здоровых женщин (например, штамм L. rhamnosus 35 в вагинальной форме пробиотика Лактожиналь, или штаммы L. rhamnosus GR-1, L. reuteri RC-14 в оральной форме пробиотика Вагисан).
К комбинированным пробиотикам относятся поликомпонентные пробиотики, состоящие из нескольких симбиотических штаммов бактерий одного (ацилакт, аципол) или разных (линекс, бифиформ) видов, усиливающих антагонистическое действие друг друга по отношению к патогенным возбудителям. В качестве дополнительных компонентов комбинированные пробиотики содержат пребиотики или вещества, оказывающие иммуномодулирующее действие (например, лизоцин, комплексный иммуноглобулин поливалентный).
При производстве рекомбинантных пробиотиков, бактериям вживляются полезные гены, приносящие новые свойства колонии. Например, препарат «Субалин» содержит микробы, способные синтезировать интерферон.
Самоэлиминирующиеся антагонисты – это препараты конкурентного действия, состоящие из споровых бацилл и дрожжеподобных грибов, которые, несмотря на то, что не являются частью нормальной микрофлоры кишечника, оказавшись во внутрикишечной среде, выполняют функцию подавления патогенных и многих условно патогенных микроорганизмов. Споровые препараты содержат бациллы bacillus subtilis (бактисубтил, флонивин) или сенную палочку в виде одного штамма (бактиспорин и споробактерин) или в сочетании с лихиениформными бациллами (биоспорин). Примером препарата из дрожжеподобных грибов saccharomyces boulardii является Энтерол.
Самоэлиминирующиеся антагонисты обычно назначаются при легких и средне-тяжелых формах острой кишечной инфекции, субкомпенсированных дисбактериозах, обычно коротким курсом 5–7 дней, с последующим долечиванием пробиотиками других групп. В гинекологической практике использование спорообразующих пробиотиков ограничено.
Сорбированные пробиотики содержат бактерии, иммобилизованные на частицах твердого сорбента. За счет химических и электростатических сил взаимодействие таких форм со стенкой кишечника выше. Сорбент ускоряет дезинтоксикацию и репаративный процесс. Наиболее часто использующиеся природные сорбенты — угли, цеолиты и кремнеземы. Они обладают относительно хорошей сорбционной и ионообменной способностью, имеют сильно развитый поверхностный каркас, с порами разного диаметра, способными взаимодействовать с различными веществами и клетками пробиотика. Биологическая активность таких препаратов связана с тем, что микробная масса живых пробиотических бактерий иммобилизована на сорбенте, благодаря чему они лучше выживают и быстрее заселяют кишечник. Иммобилизованная форма пробиотического препарата позволяет существенно повысить защиту бифидо- и лактобактерий при прохождении через желудок, где обычные препараты, содержащие лиофильно высушенные клетки пробиотиков, теряют нередко более 90% активности. Сорбированные пробиотики хорошо зарекомендовали себя при кишечных дисбактекриозах (Бифидумбактерин-форте, Пробифор).
Группа метаболических пробиотиков содержит в своем составе продукты метаболизма нормальных микроорганизмов и компонентов, которые поддерживают физиологические способности слизистой оболочки кишечника и состав его пробиоты. Хорошо известным препаратом из этой группы является Хилак форте, но эффективность его при влагалищных дисбиозах не доказана.
Наиболее выраженным пробиотическим и иммунотропным действием обладают многокомпонентные симбионты — мультипробиотики, которые содержат большое количество разных штаммов пробиотических культур (обычно от 6 до 14 штаммов), обычно предствленных физиологическими представителями нормофлоры человека.
Преимущества мультипробиотиков в вопросе коррекции нарушеного влагалищного биотопа очевидны, так как пробиотик с широким спектром пробиотических активностей невозможно получить при использовании в его составе 1–4 штаммов микроорганизмов (как у многих известных пробиотиков). Мультипробиотики функционируют как единый многоклеточный организм, жизнеспособность и стабильность которого поддерживается взаимовыгодными метаболическими и энергетическими механизмами регуляции. Представителями пробиотиков этой группы на аптечном рынке являются Симбитер, Биокап Феми, Пробиз Фемина (табл. 2).
Независимо от формы пробиотика, положительный эффект его обусловлен, прежде всего, специфическими механизмами действия, присущими входящим в состав пробиотическим штаммам микроорганизмов. Пробиотики, так же, как и естественная микрофлора влагалища:
- способствуют восстановлению барьерной функции влагалищной стенки;
- обладают антагонистической активностью в отношении многих патогенных и условно-патогенных микроорганизмов;
- продуцируют бактериоцины и биосурфактанты, препятствующие адгезии патогенных микроорганизмов;
- стимулируют продукцию лизоцина и ряда пептидов с антимикробной активностью;
- создают кислую среду влагалища благоприятную для оптимизации естественного нормального биоценоза влагалища.
Компоненты пробиотических бактерий: липополисахариды, флагелины, липотейхоевая кислота – являются агонистами Toll-подобных рецепторов, участвующих в восстановления слизистой оболочки, а синтез пробиотической микрофлорой полиаминов способствует модуляции клеточной пролиферации и дифференцировки.
Кроме того, ими стимулируется продукция цитокинов через внутриклеточные сигнальные пути с активацией факторов транскрипции, в т. ч. нуклеарного фактора NF-каппа B. Тем самым подавляются провоспалительные механизмы и осуществляется регуляция влагалищного воспаления, повышается продукция противовоспалительного интерлейкина-10.
Продолжение читайте
в следующем номере.
Полный список литературы
находится в редакции.


коментариев