Введение
Аномалии мочевой системы относятся к наиболее распространенным и составляют около 40% врожденных пороков развития. В детских урологических клиниках больные с аномалиями мочеполовой системы (МПС) составляют 37%, 14% детей рождаются с пороками мочеполовой системы. Врожденные аномалии МПС очень разнообразны и могут быть единичными и множественными, легкими (без клинических проявлений) и тяжелыми, а также сочетанными. Чаще всего наблюдаются аномалии почек и верхних мочевых путей. Одним из основных резервов снижения перинатальной заболеваемости, смертности и детской инвалидности от врожденной и наследственной патологии является своевременная дородовая диагностика. Среди заболеваний у детей всех возрастных групп, распространенность которых значительно возросла в Украине за последние 10 лет, генетически обусловленные аномалии имеют значительный удельный вес. Наиболее существенные изменения претерпел показатель частоты патологии органов мочевой системы (уд. вес 25–27%), который увеличился в 3,6 раза (Р. А. Моисеенко, 2002). По данным клинико-эпидемиологических исследований, эти пороки развития встречаются у 12–17,5 среди 1000 новорожденных (Ю. И. Гаврилюк, 1995; И. П. Минков, 1997).
Наряду с яркой манифестацией почечной патологии у младенцев возможно и скрытое ее течение, которое позднее может проявить себя как первично-хроническое заболевание почек или хроническая почечная недостаточность (Г. А. Маковецкая, 1996). Поэтому средний возраст диагностики врожденных пороков развития органов мочевой системы у детей составляет 5 лет, что отражается на эффективности лечения и ухудшает прогноз (Н. А. Лопаткин, 1998; В. З. Москаленко и соавт., 2002).
Наиболее эффективно эта патология может быть диагностирована в антенатальный период. Общепризнанным считается, что пороки МВС относятся к легко выявляемой патологии (точность пренатальной УЗ-диагностики составляет 89%). Врожденные пороки развития органов мочевой системы плода составляют наиболее многочисленную группу пренатального диспансерного наблюдения (И. Ю. Гордиенко, 1992, 2001). Среди них подавляющее большинство (50–87%) представлено обструктивными уропатиями (J.M. Gloor, MD, 1995; A. A. Shokeir, R. J. M. Nijman, 2000; C. V. Isaksen et al., 2000; L. V. Rodriguez et al., 2001). Но в их диагностике и лечении есть еще много проблемных вопросов. Так, степень расширения собирательной системы почки не всегда соответствует клинически значимой обструкции, а 56–70% пренатально диагностированных пиелоэктазий имеют преходящий характер (М. В. Медведев, Н. П. Веропотвелян, 1996; M. Woodward, D. Frank, 2002).
Классификация
Анатомо-морфологическое разнообразие аномалий, частота сочетанных пороков развития, вариации функциональных нарушений при сходной морфологической структуре, многообразие клинических проявлений объясняют множество классификаций аномалий почек и верхних мочевых путей. Большая часть классификаций пороков почек и мочеточников основана на патолого-анатомических проявлениях с учетом функциональных особенностей, эмбриогенеза почек и мочеточников.
Врожденные аномалии мочевыводящих путей (МВП) можно разделить на три основные группы: 1 — связанные с аномальной закладкой эмбриональных систем (аномалии положения, количества, величины, формы); 2 — связанные с нарушением продукции мочи (аномалии структуры); 3 — связанные с нарушением пассажа мочи (обструктивные уропатии). Наиболее полной была классификация Э. И. Гимпельсона (1949). Ею долгое время пользовались в нашей и ряде зарубежных стран. Он различал 4 вида пороков развития почек: аномалии количества, положения, взаимоотношения и структуры почек. К аномалиям количества относятся аплазия, гипоплазия, третья добавочная и удвоенная почки. Удвоенная почка делится на два подвида в зависимости от состояния мочеточника: полное удвоение мочеточника и расщепленный мочеточник. Среди аномалий положения почек различают дистопию гомолатеральную (тазовую, подвздошную, поясничную) и гетеролатеральную (со сращением, без сращения). Аномалии взаимоотношения двух почек бывают симметричные (подковообразная, галетообразная почки) и асимметричные (L- и S-образные почки). К аномалии структуры почек относятся поликистозные почки, солитарные кисты почек (серозные, кровяные, дермоидные).
Аномалии мочевой системы составляют около 40% врожденных пороков развития
За рубежом широко распространена классификация R. Marton.
- Аномалии количества:
а) двустороннее отсутствие почек, полная аплазия, агенезия;
б) одностороннее отсутствие почки, агенезия;
в) добавочные почки.
- Аномалии величины: гиперплазия, гипоплазия.
- Аномалии положения и формы почек:
а) дистопия (грудная, поясничная, брюшная, пояснично-крестцовая, крестцовая);
б) перекрестная дистопия;
в) сращения почек — двустороннее симметричное и асимметричное (подковообразная почка);
г) одностороннее поперечное или асимметричное сращение (удлиненная, L-образная, S-образная почки);
д) щитовидная, ногтевидная, бесформенные почки.
- Аномалии лоханки и мочеточника: удвоенная лоханка, удвоенный или расщепленный мочеточник, уретероцеле.
- Врожденные аномалии почечных сосудов: ненормальное отхождение, добавочные сосуды или неправильное их разветвление.
- Врожденные аномалии в почечной паренхиме или непосредственно по соседству с ней:
а) небольшие кисты в корковом слое;
б) кисты (дермоиды) в окружности почки;
в) солитарные кисты почки;
г) поликистозные почки.
Аномалии МВП, сопровождающиеся полным нарушением продукции и выделения мочи (агенезия/аплазия почек, гипоплазия с дисплазией, поликистозная болезнь инфантильного типа, окклюзия уретры и др.) приводят к формированию аномалада Поттера. (Аномалад или комплекс вторичных врожденных дефектов — секвенция Поттер (Potter sequence) — симптомокомплекс аномалий плода в виде необычного лица (лицо плода), множественных характерных контрактур и деформаций конечностей, вызванный каскадным эффектом абсолютного маловодия, компрессии плода с нарушением развития и созревания легких).
Ультразвуковая диагностика органов мочевыводящих путей
При ультразвуковом обследовании длина почек измеряется в продольной проекции плода при изображении аорты на сканограмме. Толщина, ширина и длина окружности почек определяются при поперечном сканировании органа на уровне почечной лоханки, если она визуализируется, или в месте наибольшей толщины почечной паренхимы. Аналогично измеряются и соответствующие размеры почечных лоханок.
При измерении толщины почечной паренхимы определяется максимальное ее значение при поперечном сканировании органа на уровне лоханки.
Измерение поперечного размера мочеточника осуществляется при расширении, когда его диаметр достигает 0,5 см и более (В. М. Демидов, 1990).
Биометрия мочевого пузыря плода включает в себя определение продольного и поперечного его размеров и, при гипертрофии, толщины стенок. Объем мочевого пузыря в 32 недели составляет в среднем 10 мл, в 40 недель — около 40 мл.
В целях совершенствования критериев оценки пренатального течения обструктивных уропатий (Л. Л. Фащук, 2003) разработана методика оценки ее наличия и степени тяжести, суть которой заключается в определении лоханочно-почечного индекса, то есть соотношения длины окружности чашечно-лоханочного комплекса к длине окружности почки.
Второй почечный индекс («почка-живот») определяется как процентное соотношение длины окружности почки к длине окружности живота плода. Оба почечных индекса исчисляются путем измерения длины каждого круга и определения их соотношения.
Пренатальная диагностика аномалий мочевой системы плода в подавляющем большинстве представлена изолированной патологией, также аномалии мочевой системы встречаются в составе множественных врожденных пороков развития, в том числе при сопутствующей хромосомной патологии и в составе нехромосомных синдромов. Врожденные пороки развития мочевой системы плода преимущественно являются нелетальными, многие из них успешно корректируются хирургически, а часть вообще требует лишь наблюдения. При врожденных пороках развития мочевой системы, несовместимых с жизнью, проводится прерывание беременности по медицинским показаниям в сроке до 22 недель. Верификация пренатального диагноза в таких случаях осуществляется патолого-анатомическим исследованием абортных плодов.
Наличие хронической патологии органов мочевой системы (прежде пиелонефрита) у беременных ограничивает их репродуктивную функцию и ведет к рождению детей, предрасположенных к заболеваниям почек, в основе которых лежит дизэмбриогенез мочевой системы (М. М. Шехтман, 2000).
Угроза прерывания беременности является одним из ранних проявлений аномального развития плода (А. Я. Гречанина, 1990). Кроме того, применение прогестерона как составной части терапии, направленной на сохранение беременности, приводит к снижению кинетических возможностей и дилатации мочевых путей как у беременной, так и плода (М. В. Медведев, Н. П. Веропотвелян, 1996; М. М. Шехтман, 2000).
При распределении обструктивных уропатий верхних мочевых путей по степени тяжести используется несколько вариантов классификаций фетального гидронефроза.
Лоханочно-почечный индекс наиболее точно отражает соотношение изменений, происходящих в почке плода при разной степени тяжести обструктивных уропатий верхних мочевых путей, потому что, во-первых, при исчислении лоханочно-почечного индекса определяется длина окружности чашечно-лоханочного комплекса, которая учитывает как дилатацию почечной лоханки, так и расширение чашечек. Во-вторых, измерение индекса позволяет диагностировать обструктивные уропатии с учетом фактора роста плода, в частности органов мочевой системы в динамике внутриутробного развития. При начальном гидронефрозе — лоханочно-почечный индекс равен (37,1±1,17)%, при умеренно выраженном — (57,4±0, 97)%, при выраженном — (80,8±3,05)%. Снижение лоханочно-почечного индекса с (43,9±1,73)% в 19 недель до (31,3±2,0)% после 36 недель вследствие уменьшения пиелоэктазии, несмотря на увеличение передне-заднего диаметра лоханки, свидетельствует о доброкачественном течении начального гидронефроза, который составляет 65,8% от всех обструктивных уропатий.
Изменения соотношения длины окружности почки к длине окружности живота плода происходит прямо пропорционально степени тяжести обструкции — минимальное при первоначальном гидронефрозе и значительное при выраженном гидронефрозе (среднее значение индекса «почка-живот» в норме — (23,6±0,44)%).
Показатели толщины паренхимы отражают те процессы, которые имеют место в почках при обструктивных уропатиях. Так, при начальном гидронефрозе отмечается компенсаторная гипертрофия почечной ткани. При умеренно выраженном гидронефрозе толщина почечной паренхимы не меньше нормативных значений, а при выраженной гидронефротичной трансформации наблюдается значительное ее истончение.
Оценка биометрических параметров мочеточников и мочевого пузыря плода является важным этапом в определении уровня возникновения обструктивного процесса.
Факторами риска возникновения обструктивных уропатий верхних мочевых путей у плода являются возраст беременной от 35 лет и старше, хроническая патология органов мочевой системы, угроза прерывания беременности и инфекционно-воспалительные заболевания.
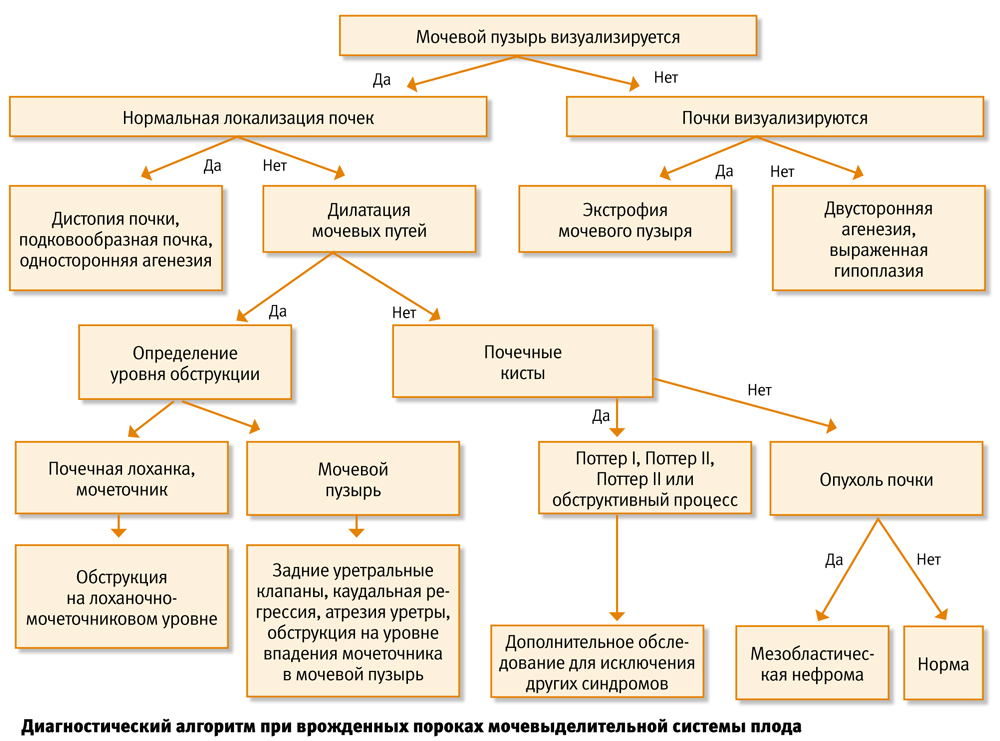
При определении эхографических признаков дилатации чашечно-лоханочного комплекса проводится тщательный осмотр всех органов и систем плода для выявления других ультразвуковых маркеров хромосомной патологии. Для диагностики обструктивных уропатий верхних мочевых путей плода необходимо определить три размера каждой почки, передне-задний диаметр лоханок, индексы: лоханочно-почечный и «почка-живот», толщину паренхимы и два размера мочевого пузыря.
Ультразвуковыми критериями пренатально диагностированных транзиторных (физиологических) пиелоэктазий являются: лоханочно-почечный индекс меньше 50% с тенденцией к снижению в динамике беременности; передне-задний диаметр лоханки до 19 недель беременности <5 мм, в сроке 20–30 недель — в пределах 5–7 мм, с 31 недели — <9 мм; размеры почки и ее паренхимы, мочевого пузыря, а также индекс «почка-живот» существенно не отличаются от нормативных значений.
Оценка биометрических параметров мочеточников и мочевого пузыря плода является важным этапом в определении уровня возникновения обструктивного процесса
Термин «обструктивные уропатии» определяет комплекс морфофункциональных изменений верхних мочевыводящих путей, которые развиваются вследствие нарушения пассажа мочи функционального или органического генеза. В патогенезе обструктивных уропатий у плода, помимо окклюзионных процессов мочевого тракта, важная роль принадлежит анатомо-функциональным нарушениям уродинамики в процессе внутриутробного развития. В связи с этим различают:
- Пороки развития пиелоуретрального сегмента (возникают при образовании ампуловидного расширения на краниальном конце протока метанефроса).
1) Врожденное сужение пиелоуретрального сегмента (стеноз, стриктура или клапан в зоне соустья).
2) Высокое отхождение мочеточника от почечной лоханки.
3) Сдавление пиелоуретрального сегмента добавочным сосудом.
4) Сегментарная нейромышечная дисплазия пиелоуретрального сегмента.
- Пороки развития лоханочно-чашечной системы.
1) Внепочечное деление лоханки на чашечки.
2) Пороки развития мышечного слоя лоханки и чашечек.
3) Врожденная атония лоханочно-чашечной системы.
Синдром задних уретральных клапанов (СЗУК) характеризуется нарушением проходимости уретры, что приводит к ретроградным изменениям мочевыделительной системы (38% всех обструктивных уропатий на низком уровне, и чаще у плодов мужского пола.
При исследовании мочевого пузыря могут быть оценены выбросы мочи из мочеточников в их просвет. Изменение скорости выброса и направления струи являются косвенными признаками обструктивных уропатий.
Многовариантность изменений в почках при различных видах врожденных обструктивных уропатий обусловлена совокупностью факторов, действующих как в период формирования органов мочевой системы, так и в постнатальной жизни, основными из которых являются такие цитокины и факторы роста/рецепторы, как TGFpi, VEGF, TNAa, C-met, и обструкция мочевых путей. В основе изменений почек при врожденных уропатиях лежит дисплазия почечной ткани разной степени выраженности — от гипопластической дисплазии до тяжелой кортико-медуллярной дисплазии и гипоплазии. Показателем участия VEGF, TNAa, C-met, и в наибольшей степени TGF01 и его рецепторов, в нарушении нефрогенеза является экспрессия этих цитокинов и факторов роста на диспластичных структурах почек. Повышенный уровень мочевого TGFP является показателем как диспластических, так и нефросклеротических изменений почек, что позволяет использовать определение уровня мочевого TGFP в качестве диагностического показателя морфологического статуса органов мочевой системы и прогностического критерия прогрессирования поражения почек. Положительная динамика снижения уровня мочевого TGFP после операционного устранения обструкции мочевых путей указывает на высокую степень резервных возможностей почек и благоприятный исход хирургического лечения.
Продолжение статьи читайте в следующем номере.


коментарів