Тарас Верещак,
портал «Моя наука» my.science.ua
Ідея написання цієї статті з’явилась після того, як в Україну з доповіддю приїздив Джордж Б. Міхаліска – відомий вчений, який займається розробкою і дослідженням штучної плаценти і екстракорпоральних методів оксигенації.
Штучна плацента (ШП) – це словосполучення, яке радше викликає ассоціації з фантастичним романом Олдоса Хакслі «Який чудесний новий світ», або фільмами братів Вачовскі «Матриця», де людей вирощували повністю в штучних умовах. Плацента – складний, еволюційно молодий орган більшості ссавців, які власне за ознакою її наявності й називаються плацентарними (на відміну від сумчастих та однопрохідних). Плацента дозволяє ефективно підтримувати життєдіяльність і розвиток плода досить довгий час. Як би це фантастично не здавалося, але пристрій (комбінація методів), що імітує діяльність цього органу – цілком реальний. Його розробка почалася досить давно – з середини XX століття.
Недоношеність лишається однією з основних причин смертності новонароджених. Сучасні підходи до підтримки плода дозволили зменшити смертність і посунути «кордон виживання» (коли існує 50% шанс виживання) до гестаційного віку 24 тижнів. Але за ним у віці 23 і 22 тижнів рівень смертності різко зростає – 85% і приблизно 95%, відповідно. Такий стан речей лишається незмінним протягом останніх 12–15 років. Тому саме штучна плацента може розширити можливості лікування недоношених дітей і вийти за сучасні рамки.
У віці 22–24 тижнів після зачаття організм дитини просто не готовий до самостійного функціонування, а особливо – дихальна система, яка ще перебуває на каналікулярній стадії розвитку (перехід від каналікулярної до саккулярної фази проходить в середньому на 24 тижні) і не придатна до ефективного газообміну. За таких умов стандартні методи інтенсивної терапії і механічної вентиляції малоефективні, і часто завдають значних ушкоджень. Респіраторний дистрес-синдром і бронхоальвеолярна дисплазія – основні причини смертності у такому віці.
Тому дослідники штучної плаценти пропонують зовсім інший підхід – розглядати новонародженого 22–24 тижнів, не як дитину, а як плід. Раз так, то варто спробувати створити штучні внутрішньоутробні умови для передчасно народженого. Для цього потрібно підтримувати конфігурацію фетального кровообігу, газообмін без участі легень, живлення і особливі умови зовнішнього середовища. Власне, штучна плацента і розробляється у відповідності до цих потреб. Принципово вона побудована так: функцію легень виконує зовнішій мембранний оксигенатор, в який кров потрапляє після виведення через пупкову артерію/каротидну артерію або югулярну вену, фетальний кровообіг підтримується вливанням оксигенованої крові у пупкову вену, легені заповнені амніотичною рідиною і підтримується спеціальний температурний і світловий режим.
Дослідження штучної плаценти почалися з дослідів лабораторії Джона Каллагана (Dr. John Callaghan) у клініці канадського Університету Альберти у 1960-х роках. Кардіохірург Каллаган був відомий тим, що розробив методики та вперше в Канаді провів операції на відкритому серці. Для цього він застосував серцево-легеневий насос для заміни циркуляції крові у малому колі кровообігу. Той же самий насос його група застосувала для роботи штучної плаценти.
Тоді мова йшла про пластикову посудину, в якій у рідині, що за складом солей та вуглеводів нагадувала амніотичну, знаходилося ягня, що імітувало недоношену дитину. Надалі система була посилена апаратом циркуляції за принципом «штучної нирки». Дослідники з групи Каллагана могли підтримувати життєдіяльність новонародженого ягняти до 165 хв.
З того часу різними колективами науковців велися дослідження методів забору крові і застосування нових апаратів оксигенації впродовж приблизно 15 років, аж до початку 1980-х, коли дослідження штучної плаценти втратили актуальність і були майже припинені, через значний прогрес у лікуванні недоношених немовлят з використанням нових методів штучної вентиляції легень і неонатальної інтенсивної терапії, застосування глюкокортикоїдів і сурфактанту.
Але в 1987 році розпочався новий етап вивчення і розробки ШП, група Кувабари (Kuwabara) змогла підтримувати життєдіяльність козлят протягом 165 годин за допомогою ШП, а в 1993 р. Унно (Unno) і співавтори заявили, що досягли результату в 3 тижні.
На сучасному етапі дослідження ведуться на вівцях, гестаційний вік яких легко скоригувати до людського. Газообмін здійснюється за допомогою зовнішнього мембранного оксигенатора в різних його модифікаціях і з різними мембанними системами.

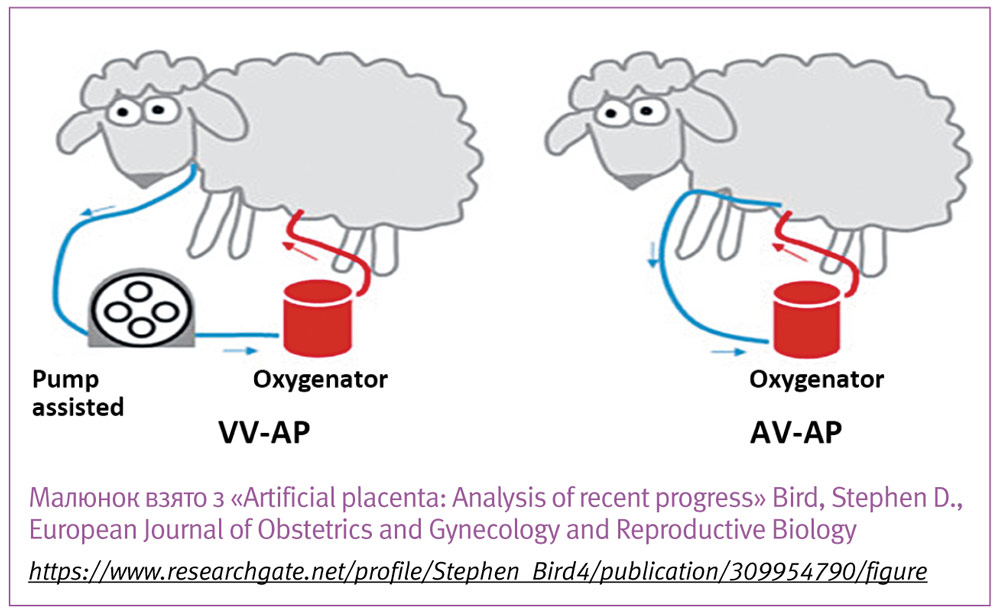
Відведення крові проводиться за двома методиками, або з пупкової/каротидної артерії (Артеріо-Венозна, АВ), або з югулярної вени (Вено-Венозна, ВВ) і після оксигенації вводиться через пупкову вену, що дозволяє зберегти фетальний кровообіг (відкриту артеріальну протоку, венозну протоку і овальне вікно).
Як АВ, так і ВВ підхід мають низку переваг і недоліків, які виявляються при різних схемах проведення досліджень. У науковій літературі є дані на користь чи противагу кожного з методів, наукова дискусія триває і остаточної відповіді, що краще, ще немає:
- при використанні АВ-підходу збільшується післянавантаження на серце, тому що велике коло кровообігу продовжується зовнішнім контуром, і серцю потрібно долати більший опір стінок власних і штучних судин, що часто призводило до серцевої недостатності, гіпотензії і гіпоперфузії органів тварини. Хоча останні дослідження показують, що з використанням сучасних оксигенаторів з майже нульовим опором, цих ускладнень не спостерігається.
- технічна складність, адже катетеризація пупкової артерії у ягняти дуже складна, а також спричиняє її спазмування, яке важко контролювати. А в людського немовляти катетеризувати пупкову артерії ще складніше.
- при ВВ-методі можна використовувати додатковий насос для забору крові, що також має недоліки – відбувається насос-індукований гемоліз і збільшення переднавантаження на серце, відсутність авторегуляції кровотоку, що також призводить до серцевої недостатності. Можна також катетеризувати праве передсердя для пасивного току крові, але при цьому важко контролювати гемодинамічні показники.
Всередині штучної плаценти тварина знаходиться в амніотичній рідині або з заповненими амніотичною рідиною дихальними шляхами в інкубаторі. Це допомагає підтримувати «внутрішньоутробне дихання». За першого варіанту існує високий ризик сепсису через інфікування рідини, тому він потребує використання закритих, стерильних циркулюючих систем.
Недоліками штучної плаценти, універсальними для всіх модифікацій, є:
- контакт крові із синтетичними поверхнями катетерів, мембрани оксигенатора спричиняє розвиток системного запалення, викликає тромбоцитопенію, продукцію активних форм кисню, запускає масивну коагуляцію, що призводить до ДВЗ-синдрому;
- довготривале використання ШП потребує використання гепарину, високі дози якого призводять до появи кровотеч, з цим пов’язують високу частоту внутрішньочерепних кровотеч при використанні екстракорпоральної оксигенації. Хоча цей зв’зок не повністтю доведений;
- травматичність процедури катетеризації і високий ризик порушення цілісності контакту;
- важкість оцінки довготривалих і пізніх неврологічних порушень;
- у ягнят спостерігається раннє дозрівання гермінативного матрикса, що унеможливлює дослідження внутрішньочерепних кровотеч, характерних для екстремально недоношених дітей.
Вирішенню проблеми з гепаринізацією і біосумісністю може сприяти розробка біосумісних матеріалів і речовин, які не викликають тромбоутворення. Також пропонується використання матеріалів, що виділяють оксид азоту, якими можна покривати контактуючі поверхні та які нівелюватимуть ці недоліки, гальмуючи активацію системи зсідання крові.
У нашумілому дослідженні в Дитячій лікарні Філадельфії (Children’s Hospital of Philadelphia), яке було опубліковане в квітні 2017 року в журналі Nature Communications, дослідники використовували АВ-метод з оксигенатором із нульовим опором та закритою системою циркуляції амніотичної рідини. В експерименті з 8 тваринами гестаційного віку, еквівалентного 23–24 тижням людського, вони змогли підтримувати нормальну гемодинаміку, фетальну конфігурацію кровообігу, газовий і електролітний склад крові, рівень лактату, перфузію мозку у ягнят протягом 4 тижнів з подальшим переведенням на штучну вентиляцію.
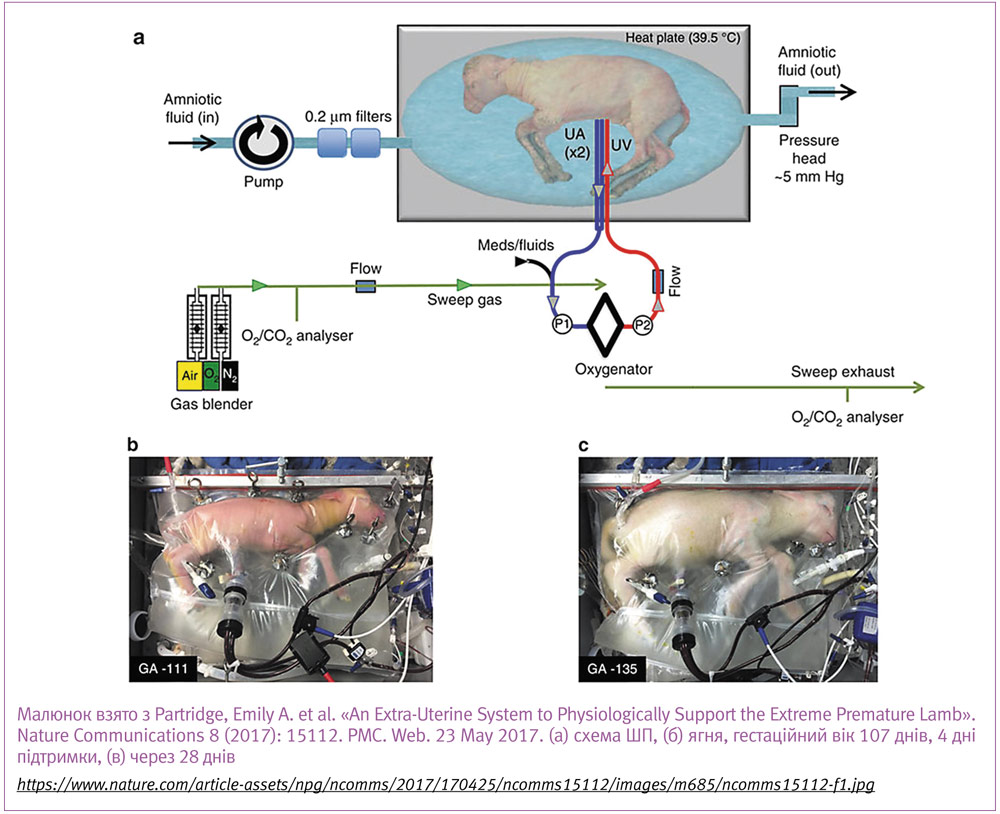
Дозрівання легень, стан мозку, що перевірялися функціонально і морфологічно (ступінь розвитку бронхоальвеолярних комплексів, ступінь мієлінізації нервових волокон, стан білої речовини мозку) не показали суттєвих відмінностей після 4 тижнів у порівнянні з ягнятами такого ж віку, народженими пізніше. Стан мозку також перевірявся на випадок ішемічних уражень за допомогою МРТ, яке не виявило у сірій та білій речовині жодних відхилень від норми. В інших органах та системах не було знайдено суттєвих змін порівняно з контролем. Втім суттєвим обмеженням цього дослідження є те, що, як і в попередніх наукових статтях, неможливо оцінити ризик внутрішньочерепної кровотечі і пізні неврологічні наслідки. Все ж ця робота показала результати, що переважають будь-які інші, проведені до цього, і додає оптимізму в процесі подальшого вивчення та розвитку штучної плаценти і штучних внутрішньоутробних умов.
Хоча всі дослідження на сьогодні знаходяться на доклінічній стадії, за прогнозами деяких авторів (зокрема вищезгаданого Джорджа Міхаліска), клінічні дослідження можуть початися в наступні 5 років за умови стандартизації та доопрацювання методів оцінки ступеня дозрівання різних органів і систем і розробки клінічних методів відбору пацієнтів. Технологія штучної плаценти може в майбутньому покращити результати лікування екстремально недоношених дітей віком 22–25 тижнів. Також вона може бути використана після невдалої штучної вентиляції легень, реанімації, плацентарної недостатності. За допомогою штучної плаценти можливо буде проводити хірургічні втручання вроджених дефектів серця, легень, діафрагми перед переведенням на апарат штучного дихання. Окрім вирішення суто медичних проблем з високою соціальною важливістю, штучна плацента є також чисто науковим інструментом, наближеною до реальної вагітності моделлю для дослідження розвитку плода, ролі плаценти і матері у цьому важливому процесі.
Перелік літератури знаходиться у редакції.

коментарів