За последние 20 лет произошла существенная трансформация представлений о целиакии. Если еще недавно считалось, что целиакия — это довольно редко встречающаяся энтеропатия с явными клиническими признаками, то сегодня очевидно, что это заболевание может поражать не только кишечник, но и другие органы. При этом степень выраженности проявлений целиакии сильно варьирует — от ярко манифестных форм до бессимптомного течения, а распространенность ее в десятки раз выше, чем это представлялось ранее.
Как показывают различные экспертные оценки, распространенность целиакии составляет 1 случай на 100–200 человек. У большинства пациентов это заболевание протекает малосимптомно или бессимптомно, что препятствует его своевременному выявлению, а значит — и лечению. Сегодня установлено, что смертность среди больных целиакией, не придерживающихся безглютеновой диеты (в том числе из-за того, что диагноз не установлен), в 6 раз превышает средние показатели в популяции. Смертность в наибольшей мере связана с развитием злокачественных опухолей в ЖКТ. Кроме того, у пациентов с нелеченой целиакией существенно выше риск развития остеопении и остеопороза, низкорослости, анемии, задержки полового созревания и бесплодия (у женщин).
В январе 2012 года были опубликованы новые рекомендации ESPGHAN (Европейское общество педиатрической гастроэнтерологии, гепатологии и питания) по диагностике целиакии у детей. Отличием данного руководства от сравнительно недавних американских (NASPGHAN, 2004) и британских (NICE, 2008) рекомендаций является выделение условий, при которых биопсия тонкой кишки для диагностики целиакии не является обязательной. Такое упрощение диагностической процедуры, безусловно, — весьма важный шаг (учитывая стоимость, доступность и степень инвазивности тонкокишечной биопсии) и, на наш взгляд, должно способствовать улучшению диагностики целиакии в нашей стране.
Общепринятое название заболевания — «целиакия» — скорее историческое (от греч. koeliakos — «страдание кишечника»), нежели отражающее суть болезни. В разные времена это заболевание называли «идиопатической стеатореей», «нетропической спру», «европейской спру», а также «глютеновой энтеропатией». В последнее время все чаще употребляется термин «глютенчувствительная энтеропатия», и именно это название внесено в МКБ-10. Но в настоящей статье мы все же будем употреблять термин «целиакия» как более привычный, а также созвучный с англоязычным названием — сeliac (соeliac) disease.
Патогенез целиакии довольно сложен и до конца не изучен. В настоящее время известно, что:
- Целиакия развивается только у генетически предрасположенных лиц, имеющих HLA-DQ2 и HLA-DQ8 гетеродимеры, расположенные на поверхности антигенпрезентирующих клеток слизистой оболочки (главным образом дендритных клеток). HLA-DQ2 и HLA-DQ8 представляют собой мембранные рецепторы, способные связываться с пептидами глютена. Среди больных целиакией у 90% обнаруживают HLA-DQ2-гетеродимер, у приблизительно 7% — HLA-DQ8-гетеродимер, у остальных 3% — половину HLA-DQ2-гетеродимера. Наследование указанных гетеродимеров связано с наличием антигенов HLA II класса DR3, DR5/DR7 или HLA DR4 (как известно, эти антигены обуславливают предрасположенность и к другим аутоиммунным болезням, например сахарному диабету типа 1, аутоиммунному тиреоидиту, диффузному токсическому зобу и другим).
- В основе заболевания — повышенная чувствительность к глютену. Глютен — основной белок злаковых. Глютен состоит из глютенина и проламина. Именно проламин обуславливает токсичность глютена. Злаки отличаются друг от друга по содержанию проламина и по его структуре. Например, пшеница и рожь содержит 33–37% проламина, просо — 55%, ячмень и овес — до 10%, кукуруза — 6%, гречиха — 1%. Токсичность проламина зависит от содержания в нем пролина и глутамина. Высокое содержание этих аминокислот препятствует расщеплению проламинов кишечными пептидазами и характерно для проламина пшеницы (глиадина), ржи (секалина), овса (авенина) и ячменя (гордеина). А вот проламин гречихи и кукурузы практически не содержит пролина (употребление в пищу этих злаков, как известно, не приводит к развитию целиакии).
- По электрофоретической подвижности различают альфа, бета, гамма и омега-фракции глиадина. Среди α-глиадинов выделен пептид, состоящий из 33 аминокислотных остатков (13 из них — пролиновые), так называемый α2-глиадин-33-мер. Этот пептид не расщепляется кишечными пептидазами, а в неповрежденном виде проникает в субэпителиальный слой, где происходит его дезаминирование тканевой трансглутаминазой. В результате дезаминирования молекула α2-глиадин-33-мера приобретает отрицательный заряд, что облегчает ее взаимодействие с HLA-DQ2- или HLA-DQ8-гетеродимерами, расположенными на поверхности дендритных клеток или макрофагов. Комплексы «DQ2-пептид» или «DQ8-пептид» активируют CD4+ лимфоциты-хелперы, что приводит к запуску иммунопатологического процесса.
- Воспалительный процесс при целиакии затрагивает, главным образом, проксимальные отделы тонкой кишки. Характерными изменениями слизистой оболочки кишечника при целиакии являются: увеличение количества межэпителиальных лимфоцитов, гиперплазия крипт и атрофия ворсин. Эти изменения могут быть неоднородными, выраженными в разной степени в разных отделах тонкой кишки. Кроме того, было показано, что луковица двенадцатиперстной кишки может быть единственным местом, где обнаруживаются изменения слизистой оболочки.
- Гуморальный иммунный ответ при целиакии направлен не только против экзогенных антигенов (глиадина, дезаминированного пептида глиадина), но и против эндогенных — тканевой трансглутаминазы, эндомизия, ретикулина и других, что дает все основания считать целиакию аутоиммунным заболеванием.
- Целиакия может развиться в любом возрасте, а может и не развиться вовсе. Известно, что HLA-DQ2-положительными являются 15–20% населения и HLA-DQ8 обнаруживают у 20% людей. При этом распространенность целиакии составляет всего 0,5–1%. Для реализации генетической предрасположенности необходимо воздействие внешних факторов. Так, на сегодняшний день доказано, что развитию целиакии способствует раннее введение в рацион глютенсодержащих продуктов (особенно ранее 3 месяцев жизни) и перенесенные вирусные кишечные инфекции (ротавирусные и, возможно, аденовирусные). Доказанным протективным эффектом в отношении развития целиакии у предрасположенных лиц обладает грудное молоко. Было показано, что при увеличении длительности грудного вскармливания снижается частота развития целиакии, а также, что целиакия не развивается, если глютенсодержащие продукты вводятся на фоне грудного вскармливания.
Резюмируя современные представления о механизмах развития и клинических проявлениях целиакии, рабочая группа ESPGHAN (2012) сформулировала новое определение заболевания. Целиакия — это иммуно-опосредованное системное заболевание, индуцируемое глютеном и связанными с ним проламинами у генетически предрасположенных лиц, которое характеризуется наличием вариабельных комбинаций глютензависимых клинических проявлений, специфических антител, гаплотипов HLA-DQ2 и HLA-DQ8 и энтеропатии.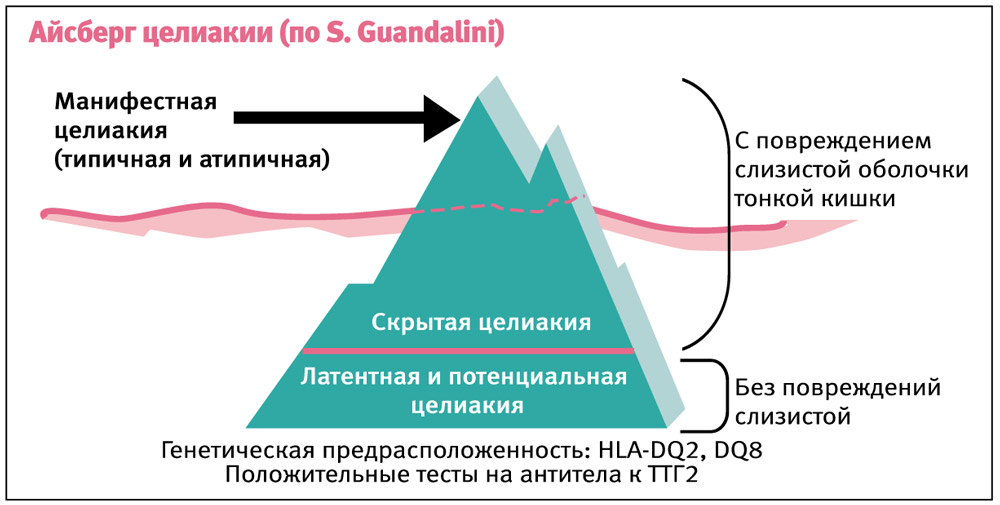
Различают несколько клинических форм целиакии:
- Типичная — характеризуется наличием выраженных гастроинтестинальных симптомов, характерных морфологических изменений в тонкой кишке и специфических для целиакии антител и HLA-гаплотипов.
- Атипичная — гастроинтестинальные симптомы выражены слабо или отсутствуют, а в клинике доминирует внекишечная симптоматика; при этом выявляются специфические антитела, HLA-гаплотипы и энтеропатия.
- Скрытая («тихая») — клинические симптомы отсутствуют, но обнаруживаются характерные для целиакии изменения слизистой оболочки тонкой кишки, специфические антитела и HLA-гаплотипы.
- Латентная — гистологических и серологических маркеров не определяется, но у пациента была глютенчувствительная энтеропатия когда-либо ранее; клинические симптомы могут присутствовать или отсутствовать.
- Потенциальная — морфология слизистой тонкого кишечника не изменена, выявляются специфические антитела и HLA-гаплотипы; симптомы могут присутствовать или отсутствовать; в будущем энтеропатия может развиться или нет.
У детей старшего возраста и взрослых наиболее часто выявляются малосимптомные и бессимптомные формы (см. рисунок).
Клиника
Типичная форма целиакии хорошо описана. Симптомы появляются в раннем возрасте, обычно через 4–8 недель (или позже) после введения в рацион глютенсодержащих продуктов. Наиболее характерными проявлениями в этом возрасте являются хроническая диарея, анорексия, вздутие живота, боль в животе, снижение темпов прибавки массы тела и снижение массы тела, а также рвота.
Самый частый симптом — патологический характер стула. У некоторых детей стул оформленный, но очень обильный. У некоторых детей отмечается «неустойчивый» стул, который характеризуется чередованием кашицеобразного, жидкого и оформленного стула с различной временной протяженностью.
Как правило, имеет место замедление темпов прибавки массы тела, реже — и роста. При поздней диагностике ребенок может дойти до серьезной степени истощения. Увеличенный в размере, вздутый живот в сочетании с исхуданием конечностей придают ребенку характерный «вид паука».
Изменения в поведении ребенка включают раздражительность, капризность, потерю интереса к окружающему, сосредоточенность на себе.
Иногда, при тяжелом течении заболевания, могут возникать кризы, характеризующиеся обильной водянистой диареей, выраженным вздутием живота, обезвоживанием, гипотензией, летаргией, часто с серьезными электролитными нарушениями, включая выраженную гипокалиемию.
У детей старшего возраста желудочно-кишечные проявления целиакии могут обнаружиться в любое время. Вариабельность возраста начала манифестации заболевания, возможно, зависит от количества глютена в рационе и других экологических факторов (продолжительность грудного вскармливания, перенесенные кишечные инфекции). Обычно у старших детей желудочно-кишечные симптомы не такие яркие, как у младенцев, и включают тошноту, рецидивирующую боль в животе, вздутие, запор или неустойчивый стул. Вообще отмечено, что чем в более раннем возрасте развивается целиакия, тем более выражены ее гастроинтестинальные проявления.
Атипичная целиакия чаще наблюдается у детей старшего возраста и взрослых. Основные внекишечные проявления целиакии следующие:
Герпетиформный дерматит — буллезная сыпь, локализующаяся в области локтей, коленей и ягодиц, ассоциированная с кожными гранулярными IgА-депозитами. Высыпания уменьшаются и проходят на фоне безглютеновой диеты.
Гипоплазия зубной эмали постоянных зубов.
Железодефицитная анемия, резистентная к пероральной ферротерапии — наиболее частое внекишечное проявление целиакии. В детском возрасте железодефицит редко бывает единственным проявлением заболевания.
Низкий рост и задержка полового созревания. У приблизительно 10% детей с идиопатической низкорослостью может быть диагностирована целиакия. При этом обнаруживаемая у части этих пациентов сниженная стимулированная продукция гормона роста нормализуется после перехода на безглютеновую диету.
Хронический гепатит и гипертрансаминаземия. У пациентов с нелеченой целиакией часто отмечается повышение уровней АлАТ и АсАТ. Среди пациентов с гипертрансаминаземиями невыясненной этиологии около 9% могут иметь целиакию. При биопсии печени у этих пациентов определяются признаки неспецифического реактивного гепатита. На безглютеновой диете в большинстве случаев уровень ферментов печени в крови нормализуется.
Артрит и артралгии. Среди детей с ювенильным хроническим артритом не менее 3% могут иметь целиакию.
Oстеопения и остеопoроз. К моменту установления диагноза у 50% детей и 75% взрослых с целиакией отмечается снижение минеральной плотности костей, иногда вплоть до остеопороза. На фоне диеты без глютена минерализация костей постепенно восстанавливается: у детей — примерно через год.
Неврологические проблемы более характерны для взрослых. Целиакия может вызвать тяжелую эпилепсию с затылочными кальцификатами. Такие пациенты обычно плохо отвечают на противосудорожные препараты, а при назначении безглютеновой диеты отмечается улучшение (если она начата вскоре после первых приступов). Также хорошо описана связь между целиакией и мозжечковой атаксией у взрослых.
Психиатрические расстройства. Хотя возможная связь с целиакией рассматривалась при множестве поведенческих расстройств (например, при аутизме, синдроме гиперактивности с дефицитом внимания), доказательств ее наличия получено не было. Однако при целиакии могут отмечаться депрессия и тревожность. Эти состояния могут быть серьезными и обычно уменьшаются на фоне безглютеновой диеты.
Заболевания, ассоциированные с целиакией
Сегодня известно, что риск развития целиакии значительно выше при некоторых генетических синдромах, а также у лиц, страдающих аутоиммунными заболеваниями.
Синдром Дауна. Как показывают скрининговые исследования, частота развития целиакии у пациентов с синдромом Дауна составляет 8–12%. В большинстве случаев при целиакии у лиц с синдромом Дауна отмечается некоторая гастроэнтерологическая симптоматика (вздутие живота, неустойчивый стул, анорексия, недостаточная прибавка массы тела), но приблизительно у одной трети пациентов симптомов поражения ЖКТ нет.
Повышенная частота развития целиакии отмечена также у лиц с синдромами Шерешевского-Тернера и Вильямса.
Связь целиакии с другими аутоиммунными заболеваниями хорошо известна. Чем в более раннем возрасте был установлен диагноз целиакии, тем выше риск развития таких заболеваний, как сахарный диабет (СД) типа 1, аутоиммунный тиреоидит, алопеция и другие.
Сахарный диабет типа 1. У приблизительно 10% пациентов с СД типа 1 выявляют типичные для целиакии изменения морфологии слизистой оболочки тонкого кишечника. С возрастом среди больных СД типа 1 увеличивается число лиц с высокими уровнями специфических для целиакии антител в крови.
Как правило, сахарный диабет манифестирует раньше, чем целиакия. Гастроинтестинальные симптомы у таких пациентов обычно выражены слабо или отсутствуют. Поскольку некоторые из этих симптомов присущи и диабету (например, вздутие живота, диарея), то диагноз целиакии может быть пропущен, если не выполняется скрининг.
Хотя нет никаких убедительных доказательств позитивного влияния безглютеновой диеты на течение сахарного диабета, соблюдение ее у пациентов с СД и целиакией показано с целью предотвращения долгосрочных осложнений целиакии.
Рекомендации ESPGHAN (2012) по диагностике целиакии
Серологические тесты
Наиболее чувствительные и специфичные серологические тесты — определение уровней антител к тканевой трансглутаминазе 2 (АТ-ТТГ2) и эндомизию (АТ-ЭМ), а также антител к дезаминированному пептиду глиадина (АТ-ДПГ). У пациентов с нормальным уровнем IgA предпочтительно определение указанных антител, относящихся к классу IgA. При снижении уровня общего IgA в сыворотке крови (менее 0,2 г/л) определяют специфические антитела класса IgG, хотя они и менее специфичны. Важным условием является определение уровней специфических антител ДО назначения безглютеновой диеты, так как на фоне ее титры антител снижаются. Определение уровня антител к глиадину в крови в настоящее время не рекомендуется использовать при диагностике целиакии в связи с недостаточной чувствительностью и специфичностью метода.
Гистологическое исследование биоптатов тонкой кишки
Приоритет этого метода в диагностике целиакии был подвергнут сомнению, так как оказалось, что выявляемые изменения слизистой оболочки не являются специфичными для целиакии, а могут наблюдаться и при некоторых других заболеваниях (например, при аллергии на белок коровьего молока, лямблиозе, избыточном бактериальном росте и других). Кроме того, эти изменения неоднородны, могут локализоваться только в луковице двенадцатиперстной кишки, а выявление их зависит как от соблюдения процедуры подготовки образцов, так и от опыта исследователя.
Биопсия проводится во время ФЭГДС; по крайней мере 1 образец должен быть взят из луковицы дуоденум, и не менее 4 — из нижележащих отделов двенадцатиперстной кишки. Степень изменений слизистой оболочки тонкой кишки определяется в соответствии с классификацией Marsh-Oberhuber:
- Marsh 0 — преинфильтративная стадия (норма).
- Marsh I — инфильтративные изменения — структура слизистой оболочки нормальная, повышено количество межэпителиальных лимфоцитов (более 25 на 100 энтероцитов).
- Marsh II — гиперпластические изменения — то же + гиперплазия крипт; снижение соотношения «высота ворсин / глубина крипт» (в норме — 3–5 : 1).
- Marsh III — деструктивные изменения — изменения Marsh II + атрофия ворсин:
Marsh III A — парциальная атрофия ворсин: соотношение «высота ворсин / глубина крипт» меньше 1;
Marsh III B — субтотальная атрофия ворсин: отдельные ворсины еще распознаваемы;
Marsh III C — тотальная атрофия ворсин: слизистая без пальцевидных возвышений, напоминает слизистую оболочку толстой кишки.
HLA-типирование
Отсутствие HLA-DQ2- и HLA-DQ8-гаплотипов позволяет полностью исключить целиакию, равно как и возможность ее развития в будущем. HLA-типирование может быть полезным в сомнительных случаях — например, если гистологически определяется умеренная энтеропатия, а специфические антитела не выявляются.
Обследованию на целиакию подлежат:
Первая группа — пациенты с симптомами, подозрительными в отношении целиакии: дети и подростки с иначе не объясненными хронической или рецидивирующей диареей, задержкой физического развития, потерей массы тела, низкорослостью, задержкой полового созревания, аменореей, железодефицитной анемией, тошнотой и рвотой, хроническими болями в животе, вздутием живота, запорами, хронической усталостью, рецидивирующим афтозным стоматитом, герпетиформным дерматитом, отклонениями в печеночных биохимических пробах, переломами костей, неадекватными травмам, или остеопенией, остеопорозом.
Вторая группа — бессимптомные пациенты с повышенным риском развития целиакии: дети и подростки с сахарным диабетом типа 1, синдромом Дауна, аутоиммунными заболеваниями щитовидной железы, синдромом Шерешевского-Тернера, синдромом Вильямса, селективным дефицитом IgA, аутоиммунным гепатитом, а также родственники больных целиакией первой степени родства.
Алгоритм диагностики у пациентов с симптомами, подозрительными в отношении целиакии
Первый шаг — определение уровня АТ-ТТГ2 IgA (если уровень общего IgA в норме) или уровня АТ-ТТГ2 IgG (при дефиците общего IgA). В случае отрицательного результата диагноз целиакии маловероятен, кроме нескольких особых ситуаций (возраст младше 2 лет, соблюдение безглютеновой диеты на момент обследования, тяжелое течение заболевания, наследственная предрасположенность или наличие заболеваний, предрасполагающих к целиакии, иммуносупрессивная терапия).
У детей младше 2 лет в случае отрицательного теста на АТ-ТТГ2 рекомендуют определять уровень АТ-ДПГ.
В серонегативных случаях у пациентов с тяжелым течением заболевания и характерными для целиакии симптомами необходимо проведение тонкокишечной биопсии и HLA-типирования.
Возможна ситуация, когда в ходе обследования по поводу каких-либо гастроэнтерологических симптомов была проведена дуоденальная биопсия, и при морфологическом исследовании биоптатов обнаружены характерные для целиакии изменения слизистой оболочки тонкой кишки (Marsh I-III). В таких случаях для подтверждения диагноза следует определить уровень АТ-ТТГ2, а для детей младше 2 лет — АТ-ДПГ и провести HLA-типирование.
Как поступать в случае позитивных результатов серологических тестов?
Такие пациенты должны быть направлены к детскому гастроэнтерологу для дальнейшего обследования с целью подтверждения или исключения целиакии. Согласно руководству ESPGHAN, безглютеновая диета не должна назначаться до завершения диагностического процесса и получения убедительных данных в пользу целиакии.
Исследования показывают, что у детей и подростков, имеющих клинические признаки, характерные для целиакии, и значительное повышение уровня АТ-ТТГ2 (в 10 и более раз по сравнению с нормой), вероятность выявления атрофии ворсин слизистой оболочки тонкой кишки очень высока. В связи с этим у пациентов с высокими титрами АТ-ТТГ2 для подтверждения диагноза целиакии достаточно определить уровень антител к эндомизию (используя при этом другой образец крови), а от проведения биопсии можно воздержаться. Если уровень АТ-ЭМ также оказывается повышенным, то диагноз целиакии можно считать установленным и назначать безглютеновую диету. В случаях когда биопсия не проводится, желательно выполнить HLA-типирование.
Если у пациентов, имеющих характерные для целиакии симптомы, уровень специфических антител (АТ-ТТГ2 или АТ-ДПГ) при первичном обследовании повышен, но не более чем в 10 раз, показано проведение дуоденальной биопсии. Выявление изменений слизистой оболочки, соответствующих Marsh II-III, позволяет установить диагноз целиакии и назначить безглютеновую диету. Если слизистая оболочка не изменена (Marsh 0) или изменена незначительно (Marsh 1), то следует продолжить обследование (АТ-ЭМ, HLA-типирование).
Алгоритм диагностики у бессимптомных пациентов с повышенным риском развития целиакии
В этой группе в качестве первичного скрининга рекомендуется проведение HLA-типирования. При отсутствии у ребенка HLA-DQ2 и HLA-DQ8 не имеет смысла обследовать его на целиакию ни теперь, ни когда-либо в будущем. В случае выявления HLA-DQ2- или HLA-DQ8-гаплотипа у пациентов второй группы, рекомендуется периодически определять титры специфических для целиакии антител (АТ-ТТГ2) в крови (но не ранее, чем ребенку исполнится 2 года).
Поскольку известно, что у лиц с повышенным генетическим риском развития целиакии титры антител могут колебаться, а классических клинических симптомов заболевания может и не быть, то без гистологического подтверждения диагноз целиакии невозможен.
Если при первичном серологическом обследовании бессимптомных пациентов уровень специфических антител (АТ-ТТГ2 или АТ-ДПГ) повышен незначительно (менее 3 норм), следует определить уровень АТ-ЭМ в крови. В случае позитивного теста на АТ-ЭМ показана дуоденальная биопсия. Если тест на АТ-ЭМ отрицателен, рекомендуется повторное серологическое тестирование через 3–6 месяцев при условии, что рацион пациента будет содержать достаточное, адекватное возрасту, количество глютена.
Дальнейшее ведение
В рекомендациях ESPGHAN (2012) указывается, что при установленном в соответствии с вышеизложенными критериями диагнозе целиакии пациентам назначается безглютеновая диета. Дальнейшее наблюдение включает контроль симптомов и контроль уровня антител. Нормализация уровня антител должна произойти в течение 12 месяцев с момента перехода на безглютеновую диету.
Если сомнений в диагнозе не было и пациент ответил на диету без глютена, то нет необходимости в проведении контрольной биопсии тонкой кишки. Аналогично не считается необходимым и проведение провокационной пробы с глютеном (кроме случаев, когда изначально имелись сомнения относительно диагноза). В любом случае провокационная проба не должна проводиться у детей младше 5 лет, в период пубертатного скачка роста, и ей должны предшествовать HLA-типирование и тонкокишечная биопсия.
Если после назначения безглютеновой диеты не отмечается редукции патологической симптоматики или она недостаточна, следует выяснить, нет ли нарушений диеты, и, если таковые отсутствуют, продолжить обследование (которое может включать и проведение биопсии тонкой кишки).
В настоящее время в нашей стране имеется возможность проведения всех диагностических процедур, указанных в новых европейских рекомендациях (включая определение всего спектра антител и HLA-типирование), и есть надежда, что внедрение в практику данных рекомендаций позволит существенно улучшить диагностику целиакии.
Список литературы находится в редакции


коментариев