Резюме:
Хорошо известно, что миометриальные кисты небольших размеров (2–9 мм) признаны высокоспецифичным критерием диффузного аденомиоза. Однако речь пойдет не об этом. На примерах серии клинических наблюдений рассматривается ультразвуковая дифференциальная диагностика крупных кистозных полостей в миометрии, представляющих диагностические проблемы в силу редкой встречаемости в практике рутинных ультразвуковых гинекологических исследований.
Ключевые слова:
Кистозные полости в миометрии, ультразвуковая диагностика, кистозный аденомиоз, миома с дегенерацией, перфорация матки, артериовенозная мальформация
DOI:
https://doi.org/10.37529/obgyn.2020.2/2-20.01-3
Крупные кистозные полости в миометрии – достаточно редкая находка в гинекологической практике. В зависимости от этиологического фактора их можно разделить на врожденные и приобретенные. Врожденные кистозные полости в подавляющем числе случаев являются проявлением аномалий развития матки, сопровождающихся нарушением оттока крови. Спектр приобретенной патологии, сопровождающейся интрамиометриальными кистами, значительно шире. На примерах клинических наблюдений представляем дифференциальный ряд патологии матки, проявляющейся кистозными полостями в миометрии.
Кистозный аденомиоз
В серии публикаций в последние годы приведены данные о редких вариантах патологии, являющейся причиной тяжелой прогрессирующей дисменореи у подростков и молодых женщин. Речь идет о ювенильном кистозном аденомиозе (юношеская кистозная аденомиома) (ЮКА) и добавочных полостных маточных образованиях (англ. аббревиатура ACUM) [1,2]. Поражения морфологически очень похожи друг на друга и характеризуются наличием внутренней эндометриальной эпителиальной выстилки стенки кисты, окруженной гипертрофированным миометрием без признаков пролиферативной активности. Этиология этих состояний плохо изучена. Одна из теорий заключается в том, что ACUM является редкой мюллеровой аномалией, не классифицированной в современной классификации ESHRE/ESGE. В литературе ACUM описывается как добавочное полостное маточное образование, не сообщающееся с полостью матки, с характерным расположением вблизи места прикрепления круглой связки матки, чаще справа. Критерии, используемые для диагностики случая как ACUM, следующие: (1) изолированное добавочное полостное образование; (2) нормальная матка (нормальная форма полости матки), маточные трубы и яичники; (3) добавочная полость, выстланная эндометриоподобными железами и стромой при морфологическом исследовании; (4) полость, заполненная жидким содержимым шоколадно-коричневого цвета; (5) отсутствие признаков аденомиоза/эндометриоза, хотя в миометрии, прилегающем к добавочной полости, могут быть небольшие очаги аденомиоза. До настоящего в доступной литературе времени описано 43 случая [2–5]. Клиническими особенностями описанных случаев были молодой возраст пациенток, тяжелая дисменорея и хроническая тазовая боль, наличие кистозного образования в стенке матки и отсутствие других видимых структурных изменений внутренних гениталий при УЗИ. Предполагается, что дисфункция губернакулума может быть ответственна за дупликацию или персистирование парамезонефальной ткани вблизи корня круглой связки матки, с последующим формированием добавочных маточных образований [6]. Альтернативное мнение заключается в том, что у молодых женщин без факторов риска и признаков аденомиоза в анамнезе обнаруженные кистозные полости в миометрии следует расценивать как ювенильный кистозный аденомиоз [7, 8]. В 2010 году Takeuchi et al. [1] предложили следующие диагностические критерии ЮКА: 1) возраст ≤30 лет; 2) кистозная полость диаметром ≥1 см, не сообщающаяся с полостью матки и окруженная гипертрофированным миометрием на диагностических изображениях (УЗИ, МРТ); и 3) связь с тяжелой дисменореей. Этими же авторами во всех представленных 9-ти случаях ЮКА были обнаружены морфологические признаки аденомиоза в виде частичной инфильтрации прилежащего миометрия эндометриальными железами и стромой. Последние данные свидетельствуют о том, что многие из публикаций о случаях ЮКА, на самом деле могут быть случаями ACUM [3].
Приводим собственное наблюдение
Пациентка 25 лет (Б-0, хирургических вмешательств на органах малого таза не было) с жалобами на прогрессирующую дисменорею на протяжении последнего года, направлена с предварительным диагнозом аномалии развития матки. Выполненная 3Д-реконструкция полости матки позволила однозначно исключить аномалию развития (рис. 1). На серии эхограмм представлено полостное маточное образование правильной округлой формы, расположенное в левой боковой стенке матки вблизи трубного угла, размерами 33х27 мм, деформирующее наружный контур матки, не сообщающееся с полостью матки (рис. 2). Образование заполнено гипоэхогенным неоднородным содержимым (рис. 3а). В режимах ЦДК – перинодулярный умеренный кровоток (рис. 3б).
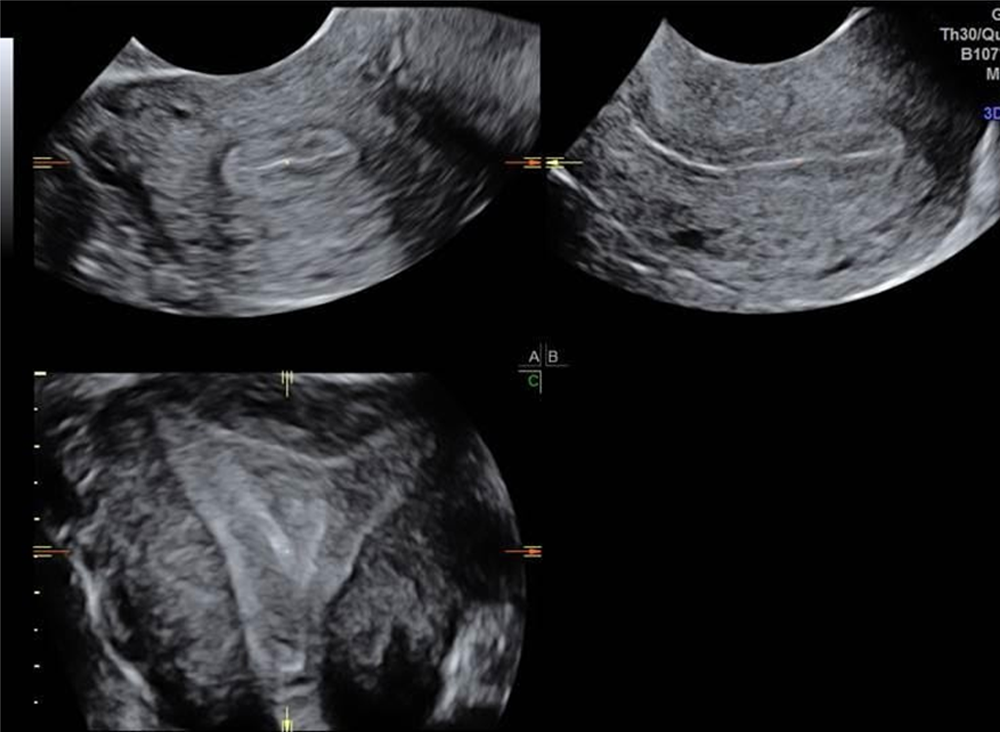
Рис. 1. 3Д-реконструкция неизмененной полости матки
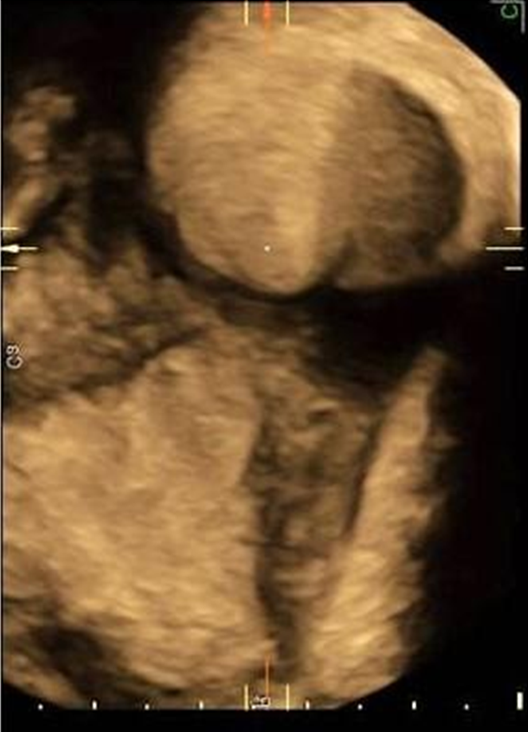
Рис. 2. ЗД-реконструкция, уточняющая локализацию полостного образования и отсутствие сообщения с полостью матки
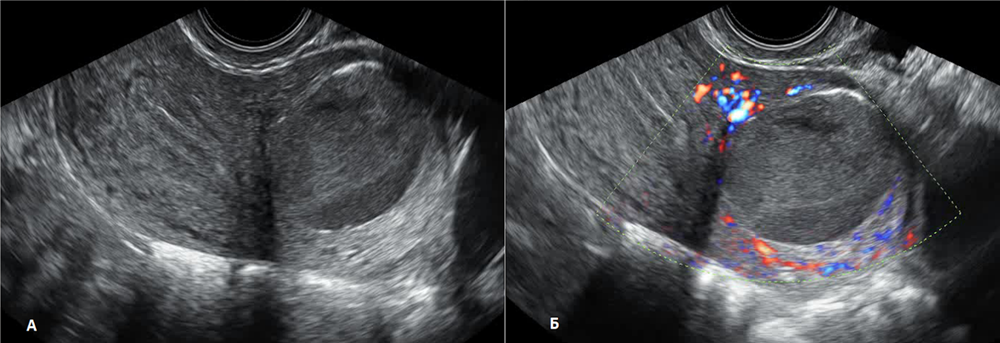
Рис. 3. Полостное маточное образование в В-режиме (а) и режиме ЦДК (б)
Во время лапароскопии образование имело вид узла, расположенного вблизи круглой связки матки, при вскрытии эвакуировано типичное для эндометриоидных кист содержимое (рис. 4).
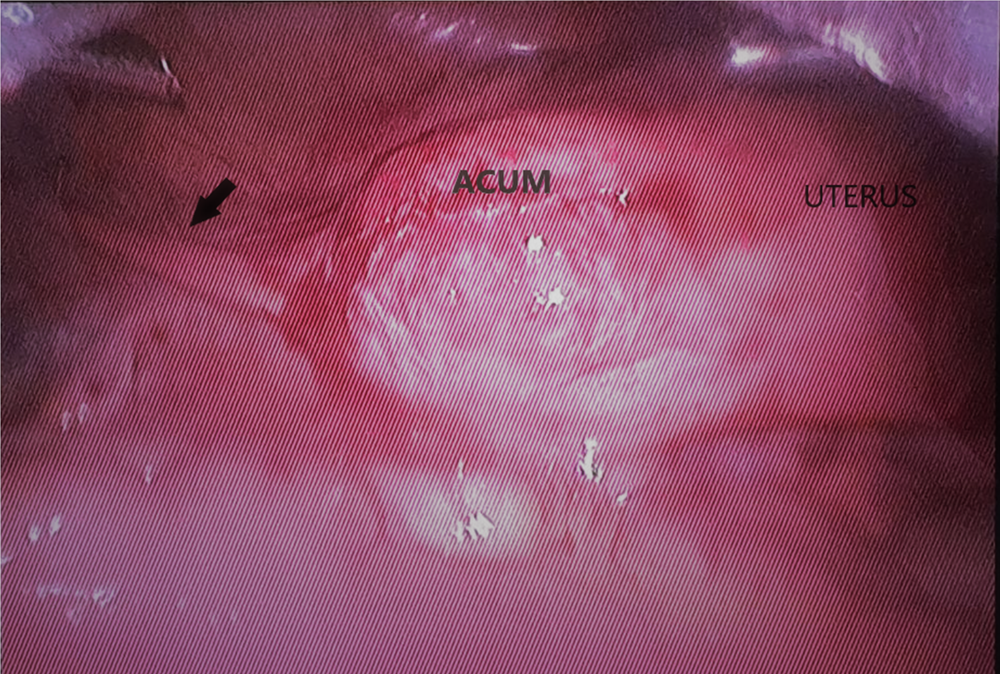
Рис. 4. Лапароскопия: uterus-матка, ACUM-полостное маточное образование, стрелка-круглая связка матки
(хирург Жегулович Ю.В., гинекологический центр Надия, г. Киев)
Гистологическое заключение: зрелая гладкомышечная ткань, эндометриальные железы в стенке кисты. С учетом анамнеза, клинической картины, эхографических, интраоперационных характеристик и гистологического заключения данную патологию следует расценивать как ЮКА или ACUM. Вопрос можно ли дифференцировать ACUM и ЮКА – патологию со сходной клинической, морфологической и эхографической картиной, но предполагаемой различной этиологией остается предметом научных дискуссий.
Дифференциальная диагностика с обструктивными аномалиями матки, как более частой причины прогрессирующей дисменореи в юном возрасте, не представляет затруднений при внимательной оценке формы полости матки в серии аксиальных срезов при 2Д УЗ-исследовании. Достоверная диагностика характерной «сигарообразной» полости матки в случаях однорогой матки с рудиментарным функционирующим рогом возможна при использовании 3Д технологий реконструкции фронтального среза матки (рис. 5).
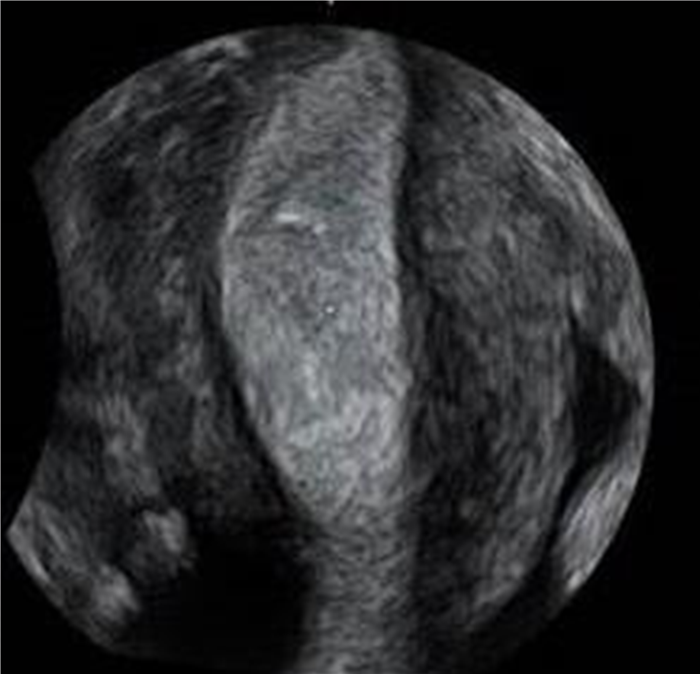
Рис. 5. 3Д реконструкция полости однорогой матки, независимо от вариантов строения рудиментарного рога
Взрослый тип кистозного аденомиоза представляет собой редкий вариант аденомиоза у женщин старше 30 лет с наличием в анамнезе беременностей, родов, инструментальных вмешательств на матке и клиникой дисменореи, хронических тазовых болей. По данным [9] частота кистозного аденомиоза среди выделяемых авторами типов аденомиоза составляет 4,5%. Приводим клинический случай. Пациентка 33 лет с жалобами на хронические тазовые боли. В анамнезе 1 роды и выскабливание полости матки в связи с замершей беременностью. В задней стенке матки обнаружена большая кистозная полость неправильной формы размерами 67х55х55мм, заполненная однородным мелкодисперстным содержимым, не сообщающаяся с полостью матки (рис. 6). Полость матки правильной формы отклонена кпереди. Из сопутствующих находок – фокус тазового инфильтративного эндометриоза в ректосигмоидном отделе кишечника, эндометриоидная киста правого яичника (рис. 7).
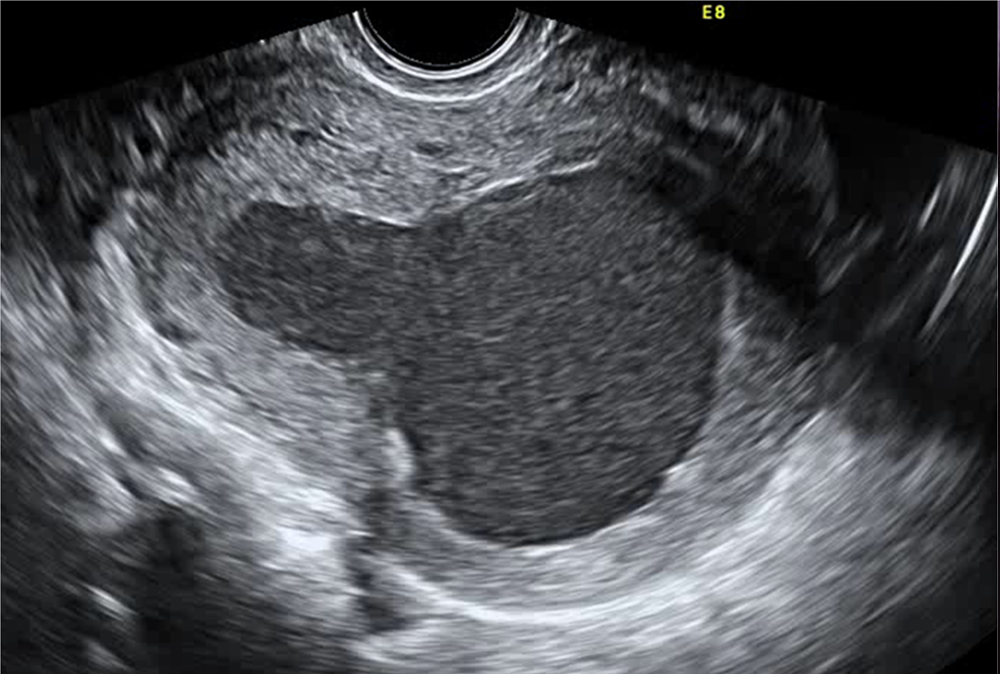
Рис. 6. Крупная кистозная полость в задней стенке матки, заполненная мелкодисперстным содержимым.
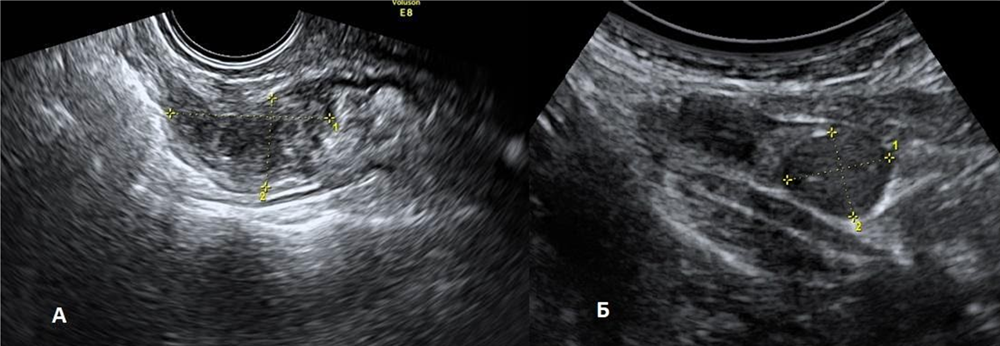
Рис. 7. Фокус тазового инфильтративного эндометриоза (А) и эндометриоидная киста правого яичника (Б)
Миома матки
Ультразвуковая диагностика миом матки в типичных случаях несложна. Клиническая картина миомы матки зависит от локализации, размеров и направления роста узлов, симптомы миомы матки могут быть изолированными или в различных сочетаниях, включая маточные кровотечения, боль, нарушения функции смежных органов, бесплодие, гиперплазию эндометрия, мелкокистозные изменения яичников, дисгормональные заболевания молочных желез. Диагностические дилеммы встречаются при нетипичной УЗ-картине миоматозного узла, что чаще всего обусловлено наличием дегенеративных изменений в них. До 65% лейомиом матки со временем претерпевают так называемые вторичные или дегенеративные изменения, что делает эту группу доброкачественных опухолей чрезвычайно разнородной с точки зрения морфологии и, соответственно, ультразвуковой семиотики. К таким изменениям относится гиалиновая дегенерация, составляющая до 63% вторичных изменений лейомиом, мукоидная или миксоматозная дегенерация (19%), кальциноз (8%), кистозная дегенерация с предшествующей фазой отека стромы опухоли (4%), красная или геморрагическая дегенерация (3%), а также жировое перерождение (3%) [10]. Развитие кистозной дегенерации связано с нарушением питания миомы, которое осуществляется обычно одним или несколькими сосудами, расположенными по периферии узла. Питание чаще нарушается в узлах, размеры которых достигли значительной величины и/или при их субсерозной локализации. Это приводит к образованию кистозных полостей, обычно неправильной и весьма разнообразной формы, с четкими контурами как правило небольших размеров. Одним из наиболее редких вариантов дегенеративных изменений является массивная кистозная дегенерация узла. и проявляется формированием полости, содержащей жидкое или желеобразное содержимое.
Приводим описание собственного клинического наблюдения большой интрамиометриальной кисты вследствие быстрой массивной гидропической дегенерации интрамуральной миомы. При плановом УЗИ органов малого таза 19-ти летней пациентки (virgo), выполненном в связи с диагностированной 8 месяцев назад интрамуральной миомой в задней стенке матки диаметром 2 см (4-й тип узла по FIGO) обнаружено многокамерное кистозное образование, расположенное за маткой размерами 140х100 мм. С предварительным диагнозом опухоли левого яичника пациентка направлена для уточняющей диагностики и выработки тактики лечения. На серии эхограмм представлена многокамерная кистозная полость размерами 140х85х110 мм, с наличием изоэхогенной миометрию стенки, занимающая заднюю стенку матки (рис. 8). В режимах ЦДК определялся огибающий тип кровотока и сосудистые сигналы вдоль одной септы (рис. 9). Яичники интактны. МРТ подтвердила наличие большой кисты задней стенки матки. Выполнена органосохраняющая операция, интраоперационно из полости эвакуирована прозрачная жидкость соломенно-желтого цвета, определялись множественные септы, внутренняя поверхность кистозной полости гладкая. При гистологическом исследовании в материале обнаружены участки лейомиоматозного узла, выстланного железистым реснитчатым эпителием без признаков атипизма клеток.
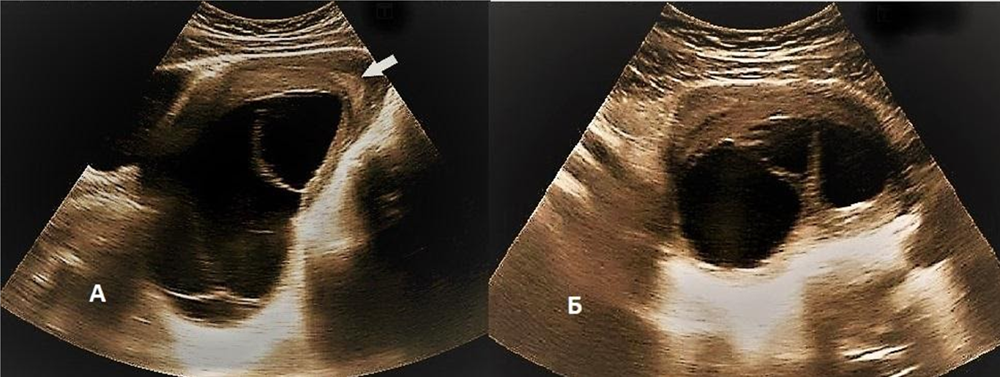
Рис. 8. Эхограммы кистозной полости стенки матки в продольном (А) и поперечном (Б) сканах с множественными септами. Стрелка – эндометрий
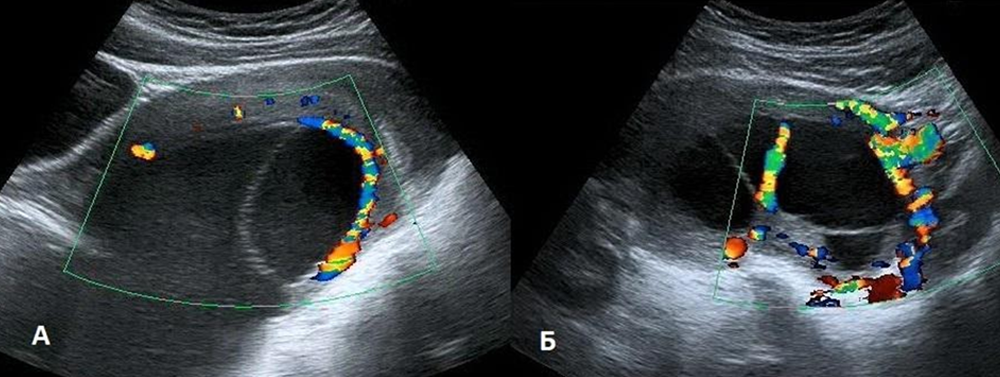
Рис. 9. Кистозная полость стенки матки.
Режим ЦДК: огибающий тип кровотока (А), сосудистый сигнал вдоль септы (Б)
Диффузные гидропические изменения – это очень редкая форма дегенерации, представляющая собой диагностическую проблему для специалистов лучевой диагностики, поскольку может имитировать злокачественные новообразования матки и яичников [11, 12]. Уверенная визуализация яичников позволяет надежно исключить их первичное поражение в таких случаях, однако существующие критерии визуализации саркомы не позволяют надежно дифференцировать ее от атипичных форм доброкачественной патологии матки, поэтому диагноз является исключительно гистопатологическим. Манифестация патологии у молодой женщины, быстрая массивная гидропическая дегенерация с отсутствием каких-либо клинических проявлений обусловили сложности диагностики в данном случае.
Перфорации матки
Перфорация матки может быть результатом ятрогенных вмешательств или, что реже спонтанной. Ятрогенная этиология включает перфорации, возникающие при дилатации и выскабливании полости матки, введении внутриматочных контрацептивов или тандемов брахитерапии, оперативной гистероскопии. Спонтанные перфорации описаны как следствие пиометры, гестационной трофобластической болезни, аномальной инвазии плаценты [13]. Количество публикаций, описывающих эхосемиотику последствий инструментальной перфорации матки, очень ограниченно. Подавляющее большинство публикаций касаются случаев, осложнившихся повреждениями сальника, кишечника, мочевого пузыря и требующих неизбежного хирургического лечения [14-18]. Истинную частоту перфораций оценить невозможно, поскольку во многих случаях они остаются незамеченными или успешно ведутся консервативно без сообщения о факте (ни коллегам, ни тем более пациенту).
У пациентки 39 лет (в анамнезе 1 роды и 1 медаборт) без жалоб при плановом ультразвуковом исследовании обнаружена тонкостенная кистозная полость, занимающая верхнюю треть тела и дно матки, размерами 80х70 мм, заполненная однородным анэхогенным содержимым. Вокруг полости определялась тонкая прослойка миометрия. Полость интимно прилегала к полости матки (рис. 10). В дифференциальном ряду рассматривались кистозный аденомиоз, кистозная дегенерация миомы, однако отсутствие клинических симптомов, эхографических признаков аденомиоза/эндомериоза, указаний на миому в анамнезе, тонкие стенки выявленного кистозного образования с отсутствием визуально определяемой мышечной стенки поставило под сомнение предварительные предположения. С учетом особенностей эхографической картины и указания в анамнезе на инструментальное вмешательство в полость матки было высказано заключение о наличии псевдокисты стенки матки вероятно ятрогенного характера (эволюция гематомы миометрия как последствия пропущенной неполной перфорации). Интраоперационно определялась кистозная полость, заполненная прозрачной жидкостью соломенного цвета, произведена клиновидная резекция и ушивание стенки матки. По результатам гистологического заключения капсула кисты представлена фиброзной тканью без эпителиальной выстилки.
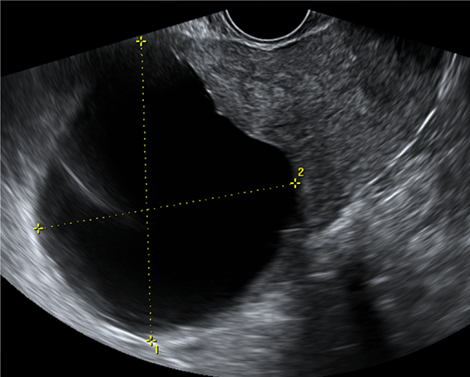
Рис. 10. Тонкостенная анэхогенная полость,
занимающая верхнюю треть тела и дно матки
Основополагающими для нашего заключения стали публикации [13, 19, 20] и осведомленность о закономерностях временной эволюции постравматических гематом других органов в виде трансформации в кистозную полость (псевдокиста) [21, 22]. Этот случай иллюстрирует важность сохранения высокого индекса настороженности ятрогенного повреждения матки после прерывания беременности и неоценимый вклад сонографии в диагностику отдаленных последствий перфорации матки. Еще один урок этого случая состоит в важности применения интраоперационного ультразвукового контроля, особенно в случаях с прогнозируемым риском перфорации (матка в ретрофлексио, множественная миома), что может помочь избежать (или, по крайней мере, снизить частоту) перфорации матки и ее последствий.
Обсуждение следующей патологии мы начнем с описания клинического случая. Пациентка 33 лет поступила в гинекологическое отделение с повторными эпизодами маточного кровотечения. В анамнезе – выскабливание полости матки в связи с неразвивающейся беременностью несколько лет назад. Справа от матки определялось полостное образование, расцениваемое ранее как субсерозная миома с дегенеративными изменениями, размерами 38х30 мм, заполненное неоднородным гипоэхогенным содержимым. В режимах ЦДК данное образование представляло собой «пульсирующий сосудистый мешок» с типичным мозаичным цветокартированием (рис. 11). Определяемая связь сосудистого образования с маточной артерий позволило сделать вывод об артериовенозной мальформации и псевдоаневризме правой маточной артерии (рис. 12).
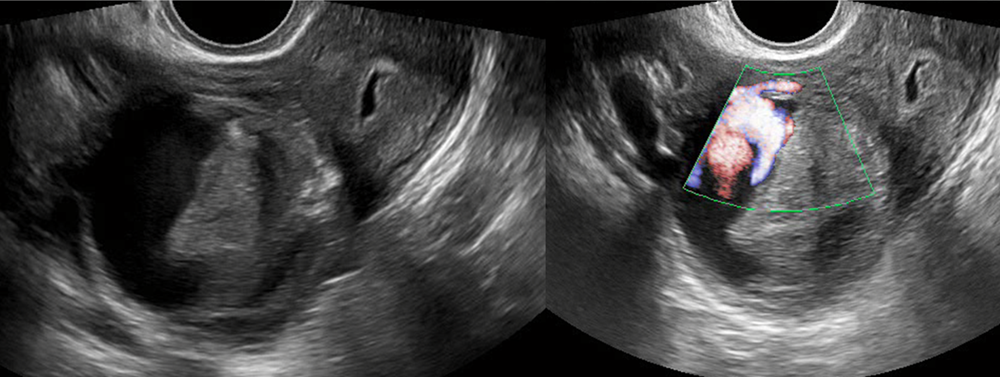
Рис. 11. Поперечное сканирование: по правой боковой стенке матки кистозная полость, заполненная гетерогенным содержимым в В-режиме и режиме ЦДК
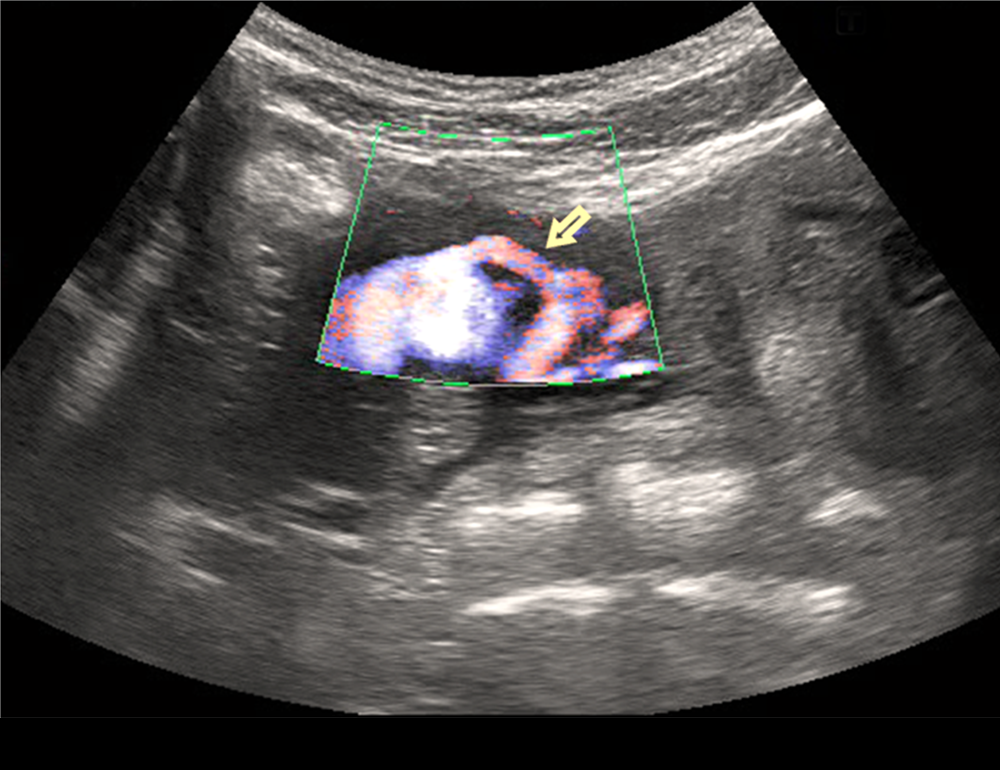
Рис. 12. Трансабдоминальное сканирование, стрелкой указана правая маточная артерия, дренирующаяся в полостное образование
Пациентке выполнена селективная ангиография и артериальная эмболизация, в ходе которой установлено, что артериовенозная мальформация питалась обеими маточными артериями и правой яичниковой артерией (рис. 13). Выполненное в динамике УЗИ показало полностью тромбированную псевдоаневризму с отсутствием кровотока.
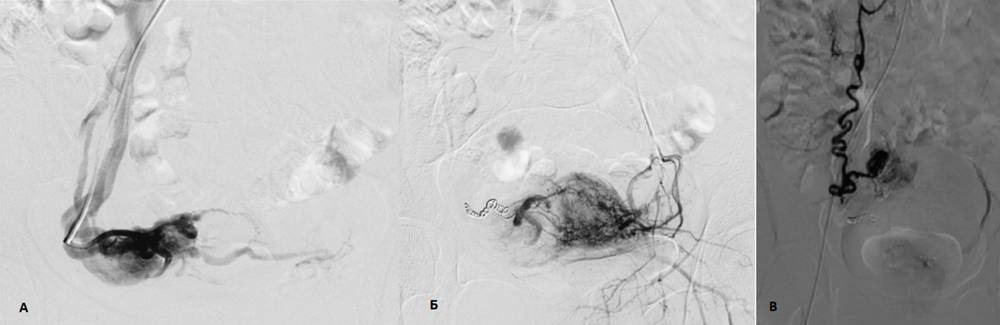
Рис. 13. Серия ангиограмм
А – селективная ангиография расширенной правой маточной артерии, через которую заполняется гиперваскулярное образование в проекции матки справа, определяется ускоренный сброс контрастного вещества во внутреннюю подвздошную вену.
Б – селективная ангиография левой маточной артерии: микрофистулезные соустья, анастомозирующие с дистальной частью правой маточной артерии. В – суперселективная ангиография правой яичниковой артерии, заполняющей гиперваскулярное образование в области матки справа (исследования выполнены Власенко Е.А., хирургом отдела эндоваскулярной хирургии НИХТ имени А. А. Шалимова)
Травматическое повреждение стенки маточной артерии вследствие хирургических вмешательств на матке остается основной причиной формирования приобретенных артериовенозных мальформаций и псевдоаневризм [23-27]. Это редкие, но потенциально опасные для жизни поражения в связи с риском неконтролируемого маточного кровотечения. Истекающая из поврежденной артерии кровь расслаивает прилежащие ткани вокруг сосуда и образует перфузированный мешок, сообщающийся с просветом артерии [25, 26]. Клинически могут протекать бессимптомно, обычно проявляются тазовыми болями и метрорагией. Псевдоаневризмы имеют характерную эхографическую картину в виде пульсирующей анэхогенной или гипоэхогенной структуры, соединенной с питающей артерией тонкой сосудистой шейкой. Ультразвуковое дуплексное допплеровское картирование показывает мозаичное цветокартирование в связи с разнонаправленным артериальным потоком с разными скоростями [27, 28]. Ангиография считается золотым стандартом для подтверждения сосудистых поражений матки. Селективная артериальная эмболизация является эффективным и безопасным методом выбора в лечении артериовенозных мальформаций и псевдоаневризм маточной артерии.
Большинство публикаций в литературе и представленные нами наблюдения свидетельствуют в пользу доброкачественной природы разнообразной патологии проявляющейся кистозными полостями в миометрии в диагностических изображениях. Однако в отдельных публикациях представлены случаи злокачественной природы кист миометрия. Они включают светлоклеточную аденокарционому развившуюся на фоне кистозного аденомиоза [29], кистозные изменения в саркомах [30] и эндометриальных карциномах [31]. Наиболее часто внутримиометриальные кистозные полости являются проявлением кистозного аденомиоза. Следует различать ювенильную и взрослую формы кистозного аденомиоза. ЮКА до конца неясная патология, может рассматриваться как редкий вариант мюллеровой аномалии. ЮКА в первую очередь следует дифференцировать с обструктивными аномалиями развития матки. Миомы с кистозной дегенерацией могут имитировать опухоли яичников. Дифференциальный диагноз несложен при уверенной визуализации интактного яичника. Посттравматические кистозные полости могут быть следствием инструментальных повреждений стенки матки, применение ЦДК позволяет успешно диагностировать последствия сосудистых повреждений – потенциально опасной для жизни патологии. Дифференциальная диагностика основана на учете возраста обнаружения, маркерных клинических проявлениях и визуальных характеристиках, и безусловно, осведомленности о спектре возможной патологии.
Автор выражает искреннюю благодарность коллегам, любезно предоставившим интраоперационные и ангиографические изображения.
Список литературы
- Takeuchi H, Kitade M, Kikuchi I, Kumakiri J, Kuroda K, et al. Diagnosis, laparoscopic management, and histopathologic findings of juvenile cystic adenomyoma: a review of nine cases. Fertil Steril 2010; 94: 862-868.
- Acien P, Acien M, Fernandez F, Jose Mayol M, Aranda I. The cavitated accessory uterine mass: a Mullerian anomaly in women with an otherwise normal uterus. Obstet Gynecol 2010; 116: 1101-1109.
- Garofalo A, Alemanno MG, Sochirca O, Pilloni E, Garofalo G, et al. Accessory and cavitated uterine mass in an adolescent with severe dysmenorrhoea: From the ultrasound diagnosis to surgical treatment. J Obstet Gynaecol 2017; 37: 259-261.
- Bedaiwy MA, Henry DN, Elguero S, Pickett S, Greenfield M. Accessory and cavitated uterine mass with functional endometrium in an adolescent: diagnosis and laparoscopic excision technique. J Pediatr Adolesc Gynecol 2013; 26: e89-e91.
- Jain N, Verma R. Imaging diagnosis of accessory and cavitated uterine mass, a rare mullerian anomaly. Indian J Radiol Imaging 2014; 24: 178-181.
- Acien P, Sanchez del Campo F, Mayol MJ, Acien M. The female gubernaculum: role in the embryology and development of the genital tract and in the possible genesis of malformations. Eur J Obstet Gynecol Reprod Biol 2011; 159: 426-432.
- Chun SS, Hong DG, Seong WJ, Choi MH, Lee TH. Juvenile cystic adenomyoma in a 19-year-old woman: a case report with a proposal for new diagnostic criteria. J Laparoendosc Adv Surg Tech A 2011; 21: 771-774.
- Brosens I, Gordts S, Habiba M, Benagiano G. Uterine cystic adenomyosis: A disease of younger women. J Pediatr Adolesc Gynecol 2015; 28: 420-426.
- Pistofidis G, Makrakis E, Koukoura O, Bardis N, Balinakos P, Anaf V. Distinct types of uterine adenomyosis based on laparoscopic and histopathologic criteria. Clin Exp Obstet Gynecol 2014; 41(2): 113-8.
- Мurase E, Siegelman ES, Outwater EK, et al. Uterine leiomyomas: histopathologic features, MR imaging findings, differential diagnosis, and treatment. Radiographics 1999; 19:1179–97.
- Horta M, Cunha TM, Oliveira R, Magro P. Hydropic leiomyoma of the uterus presenting as a giant abdominal mass. BMJ Case Reports, 08 Sep 2015, 2015 doi:10.1136/bcr-2015-211929.
- Gülmez S , Baştuğ N , Senger AS , Aday U , Uzun O , Bozdağ E , Çetin DA. A giant pedunculated uterine leiomyoma with cystic and mucinous degeneration presenting as an ovarian malignancy Arch Med Sci Civil Dis 2017; 2: e145–e147.
- Sherer DM, Gorelik C, Gabbur N, Borowski D, Serur E, Zinn HL, Kheyman M, Abulafia O. Transvaginal sonographic findings of a large intramural uterine hematoma associated with iatrogenic injury sustained at termination of pregnancy. Ultrasound Obstet Gynecol 2007; 30: 110–113.
- Caspi B, Rabinerson D, Appelman Z, Kaplan B. Penetration of the bladder by a perforating intrauterine contraceptive device: a sonographic diagnosis. Ultrasound Obstet Gynecol 1996; 7: 458–460.
- Lajinian S, Margono F, Mroueh J. Sonographic appearance of suspected iatrogenic uterine perforation: a case report. JReprod Med 1994; 39: 911–912.
- Cunat JS, Dunne MG, Butler M. Sonographic diagnosis of uterine perforation following suction curettage. J Clin Ultrasound 1984; 12: 108–109.
- Forster BB, Siu CM, Murray JB, Chung MH. Transabdominal and transvaginal sonography of uterine perforation following suction curettage. Can Assoc Radiol J 1989; 40: 318–319.
- Skolnick ML, Katz Z, Lancet M. Detection of intramural uterine perforation with real-time ultrasound during curettage. J Clin Ultrasound 1982; 10: 337–338.)
- Sherer DM, Novac S, Dalloul M, Salame Gh, Zinn H, Farnaz S, Abulafia O. Sonographic and Multiplanar Computed Tomographic Findings of Large Uterine Perforation 2 Weeks After First-Trimester Pregnancy Termination. JUM 2009; 28:699-701.
- Cheng PJ, Chuen HY, Soong YK. Sonographic diagnosis of a uterine defect in a pregnancy at 6 weeks’ gestation with a history of curettage. Ultrasound Obstet Gynecol 2003; 21: 501–503
- Drakonaki E, Sudoł-Szopińska I, Sinopidis Ch, Givissis P High resolution ultrasound for imaging complications of muscle injury: Is there an additional role for elastography? J Ultrason 2019; 19(77): 137–144.
- Тимербулатов В.М., Халиков А.А., Тимербулатов Ш.В., Верзакова И.В., Амирова А.М., Смыр Р.А. Травматические внутриорганные гематомы печени и селезенки. Вестник хирургии имени И.И.Грекова 2015; с.43-48.
- Kuwata T, Matsubara S, Kaneko Y, et al. Asymptomatic uterine artery pseudoaneurysm after cesarean section. J Obstet Gynaecol Res 2010; 36: 405-10.
- Nagayama C, Gibo M, Nitta H, et al. Rupture of pseudoaneurysm after vaginal delivery successfully treated by selective arterial embolization. Arch Gynecol Obstet 2011; 283: 37-40.
- Kim YA, Han YH, Jun KC, et al. Uterine artery pseudoaneurysm manifesting delayed postabortal bleeding. Fertil Steril 2008; 90: 849e11-4.1–3
- Abu-Yousef MM, Wiese JA, Shamma AR. The “to and fro” sign: duplex Doppler evidence of femoral artery pseudoaneurysm. Am J Roentgenol 1988; 150: 632-4.
- Baba Y, Matsubara S, Kuwata T, et al. Uterine artery pseudoaneurysm: not a rare condition occurring after non-traumatic delivery or non-traumatic abortion. Arch Gynecol Obstet 2014; 290: 435-40.
- Bouchet P, Chabrot P, Fontarensky M, et al. Pitfalls in diagnosis of uterine artery pseudoaneurysm after Cesarean section. Ultrasound Obstet Gynecol 2012; 40: 482-3.
- Ohta Y, Hamatani S, Suzuki T, Ikeda K et al. Clear cell adenocarcinoma arising from a giant cystic adenomyosis: a case report with immunohistochemical analysis of laminin-5 gamma2 chain and p53 overexpression. Pathology - Research and Practice 2008; V 204; 9: 677-682.
- Ludovisi M, Moro F, Pasciuto T, Di Noi S et al. Imaging in gynecological disease (15): clinical and ultrasound characteristics of uterine sarcoma. Ultrasound Obstet Gynecol 2019; 54: 676-687.
- Faria SC, Sagebiel T, Balachandran A, Devine C, Lal Ch, Bhosale PR. Imaging in endometrial carcinoma. Indian J Radiol.Imaging 2015; V25; 2: 137-147.



коментариев