 Введение
Введение
Вирусные инфекции в настоящее время представляют наиболее значимую проблему для здоровья человека, учитывая высокую заболеваемость, большое их разнообразие, как правило, пожизненное течение и отсутствие специфического лечения. Поэтому роль первичной профилактики в медицине приобретает важнейшее место в предупреждении вирусных инфекций.
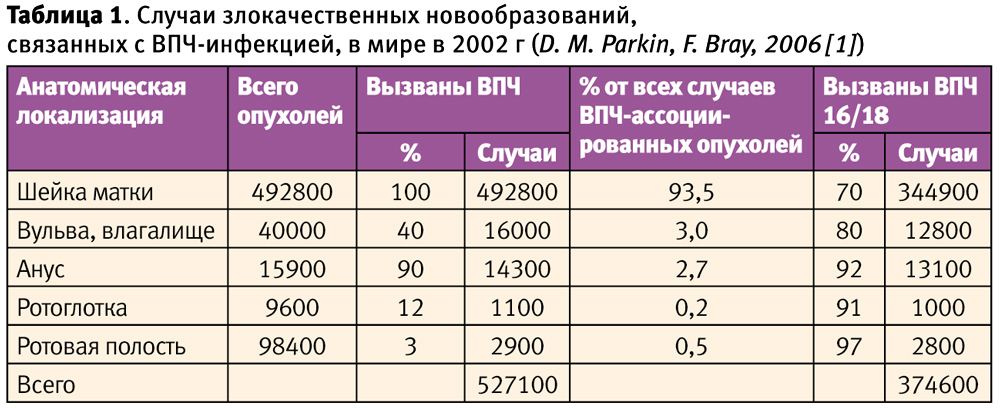
Папилломавирусная инфекция приобретает все большее распространение в мире: по данным ВОЗ ежегодно в мире диагностируется около 2,5–3 миллионов случаев. Помимо дерматогических заболеваний (аногенитальные бородавки, папилломатоз), которые являются прямым следствием генитальной папилломавирусной инфекции, в ряде случаев регистрируется онкологическая патология, вызываемая этим вирусом. К ней в первую очередь следует отнести рак шейки матки (РШМ), основным этиологическим фактором которого является вирус папилломы человека (ВПЧ). Роль определенных типов ВПЧ в возникновении РШМ общепризнанна, а РШМ в последнее время относится к заболеваниям, передаваемым половым путем. Количество случаев злокачественных новообразований, связанных с ВПЧ-инфекцией в мире, в 2002 г. составило более полумиллиона, при этом на долю ВПЧ 16 и 18 типа приходилось более трехсот тысяч случаев (D. M. Parkin, F. Bray, 2006 [1]). Среди них в 100% случаев РШМ обусловлен ВПЧ. В свою очередь РШМ составляет 93,5% всех случаев ВПЧ-ассоциированных опухолей. Более 70% РШМ вызваны ВПЧ 16 и 18 типа. ВПЧ также обусловловливают развитие рака вульвы, влагалища, ануса, ротоглотки и ротовой полости в совокупности в 6,5% случаев (Таблица 1, D. M. Parkin, F. Bray, 2006 [1]). Несомненным успехом современной медицины является вручение Нобелевской премии 2008 года по медицине и физиологии Харальду цур Хаузену за доказательство этиологической роли вирусов (в частности, ВПЧ) в онкогенезе (H. zur Hausen, 2009 [2]).
Распространенность вируса папилломы человека
Генитальная папилломавирусная инфекция является наиболее распространенной инфекцией, передаваемой половым путем (ИППП) среди женщин во всем мире. ВПЧ характеризуется широким спектром распространения, включая слизистые оболочки шейки матки, вагины, вульвы и ануса (D. M. Parkin, F. Bray, 2006 [1]; A. N. Burchell et al., 2006 [3]). Среди женщин, не имеющих симптоматики, инфекция выявляется в 2–44%, в зависимости от возраста, географического региона и социально-экономического уровня в популяции. В результате мета-анализа 78 научных исследований, проведенных во многих регионах мира, общая распространенность ВПЧ у женщин с нормальной цитологией составила 10,4%, со значительными различиями между регионами (Таблица 2, A. N. Burchell et al., 2006 [3]).
Анализ показал также, что частота выявления инфекции наибольшая среди молодых женщин и снижается у лиц среднего возраста, вновь увеличиваясь у женщин старше 65 лет. Появление этого 2-го пика неясно, однако, предполагается ряд возможных объяснений:
- Реактивация ранее нераспознанной инфекции происходит из-за снижения типо-специфического иммунитета или гормональной перестройки во время менопаузы;
- Контакт с новым партнером в среднем возрасте;
- Вероятен и так называемый когортный эффект, т. е. разные поколения женщин по-разному относились к случайным половым связям, и имелась разная доступность средств барьерной контрацепции. Изменения сексуальной морали коснулись и разных социальных групп.
Географические и социокультурные особенности сексуального поведения женщин и их партнеров-мужчин, несомненно, вносят свой вклад в частоту заболеваемости, особенно, в старших возрастных группах. Так, 80% мужчин и 65% женщин в возрасте 40–80 лет остаются сексуально активными, за исключением Азиатских популяций.
У мужчин методы, использующие определение ДНК, обнаруживают ВПЧ в уретре, анальной слизистой и ротовой полости примерно в 3,5–45%. Однако в целом в сравнительных исследованиях частота обнаружения ВПЧ у мужчин в 2–3 раза ниже, чем у женщин. Причиной этого может быть недостаточная пока валидизация диагностических тест-систем у мужчин и трудность получения материала.
Доказательствами прямого пути передачи вируса при половом контакте являются следующие: возникновение аногенитальных бородавок у партнера; заражение обоих партнеров одним типом вируса; крайне редкая заболеваемость у женщин, никогда не практиковавших вагинальные контакты; воспроизведенная во многих исследованиях ассоциация между количеством половых партнеров в течение жизни и у мужчин, и у женщин в равной степени; и, наконец, высокий риск заражения с новым половым партнером.
Существуют и другие пути передачи, кроме полового, например, орально-генитальный; при рукопожатии, так как в отдельных случаях ВПЧ обнаруживается на подушечках и под ногтями пальцев рук, но они не имеют существенного значения. Определяли возможность заражения генитальной инфекцией ВПЧ через пол и сидения в помещениях для купания общего пользования, однако, это встречается крайне редко, как и перинатальный путь передачи от инфицированной матери ребенку (A. N. Burchell et al., 2006 [3]). Инфицирование ВПЧ может произойти при соприкосновении кожи при генитальном контакте (P. E. Gravitt, R. Jamshidi, 2005 [4]; N. McIntosh, 2000 [5]), даже если имел место не проникающий половой контакт (N. McIntosh, 2000 [5]; J. M. Partridge, L. A. Koutsky, 2006 [6]).
В настоящее время известно, что использование презервативов не гарантирует 100% защиты, а только снижает риск передачи ВПЧ (N. McIntosh, 2000 [5], J. M. Partridge, L. A. Koutsky, 2006 [6]; R. L. Winer at al, 2006 [7]; M. J. Grainge et al., 2005 [8]). Особенно это относится к презервативам 1-ой генерации, которые имеются в России (в Европе доступны презервативы 3-ей генерации), поэтому становится очевидным, что столь популярный индивидуальный метод профилактики ИППП не обеспечивает выраженной защиты в отношении вирусных инфекций даже при правильном и постоянном их использовании.
Среди факторов риска заражения ВПЧ на первом месте стоит ранний сексуальный дебют. Однако, эта ассоциация кажется не столь однозначной, поскольку раннее начало половой жизни может быть маркером рискованного сексуального поведения, как большее число половых партнеров в течение жизни или конкурентное партнерство. Кроме того, не исключена роль биологических механизмов: незрелость шейки матки, неадекватная продукция протективной цервикальной слизи и шеечная эктопия могут предрасполагать подростков к инфицированию.
Обычно ВПЧ-инфекция носит временный характер и при первичном проникновении вируса в организм человека самоизлечение может наступить через 6–8 мес. Антитела к ВПЧ перестают выявляться через 1–1,5 года у 70–80% инфицированных женщин. Однако период реконвалесценции затягивается при повторных заражениях штаммами ВПЧ, относящимися к высокому риску; при инфекции несколькими типами папилломавирусов, а также при увеличении возраста пациентки.
Качество жизни и ВПЧ
Экономический ущерб от ВПЧ трудно переоценить: так, только в США ежегодные затраты на здравоохранение, связанные с ВПЧ и ассоциированные с ним заболевания – 2,3–4,6 млрд. долларов. По этому показателю инфекция занимает второе место после ВИЧ среди ИППП.
Кроме того, ВПЧ существенно снижает качество жизни инфицированных лиц, включая широкий спектр эмоциональных, социальных и сексуальных проблем (R. L. Fleurence, 2009 [9]). Первое – несмотря на отсутствие летальных случаев, аногенитальные бородавки наносят существенный вред здоровью, снижают качество интимной жизни пациентов, требуют длительного лечения и весьма часто рецидивируют независимо от метода лечения. Второе – у женщин с выявленной ВПЧ инфекцией возникают серьезные психологические нарушения, включающие страх, стресс, снижение самооценки, чувство вины, тревожность в отношении будущего негативного исхода инфицирования. Наконец, у женщин с диагностированным раком шейки матки показатели качества жизни достигают наибольшего снижения и обусловлены не только самим злокачественным процессом, но и объемом противоопухолевого лечения, включающим как хирургический, так лучевой и химиотерапевтический компоненты.
Вирус папилломы человека и иммунный ответ
ВПЧ относятся к семейству папилломавирусов (Papillomaviridae), к группе Papillomavirus. Диаметр вирусных частиц – 55 нм. Вирус не имеет внешней оболочки. Капсид вируса состоит из 72 капсомеров. Его генетический материал представлен кольцевой двухцепочечной молекулой ДНК длиной около 8000 пар оснований. Одна из нитей ДНК содержит 9 открытых рамок считывания, которые потенциально кодируют до 10 протеинов, и регуляторный участок генома.
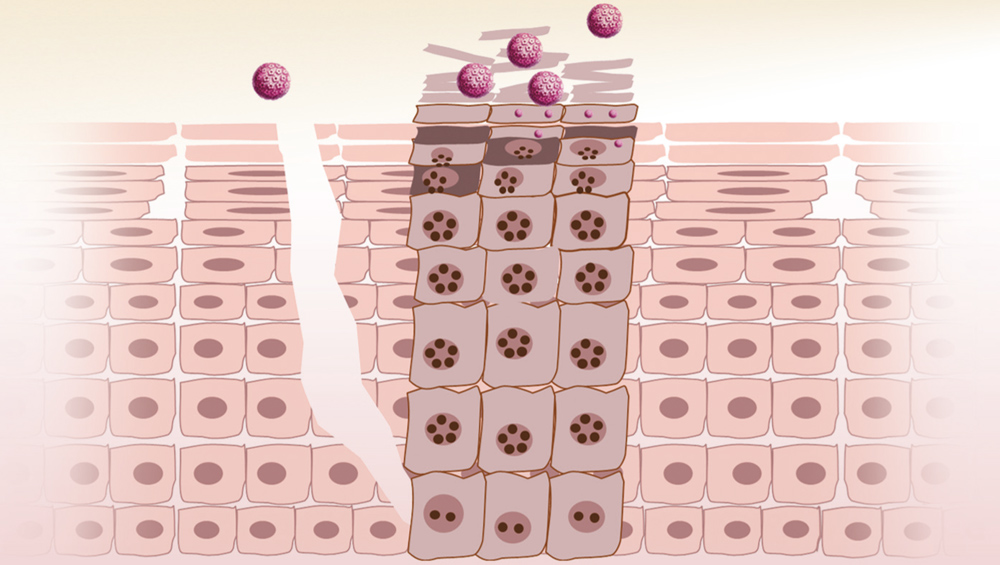
ВПЧ является чисто эпителиотропным вирусом и способен поражать клетки эпителия эктодермального происхождения (кожа, слизистые половых органов, ануса, ротовой полости). Характерная особенность вируса заключается в его способности вызывать пролиферацию эпителия кожи и слизистых оболочек.
В 1976 г. Мейзелс и Фортин впервые наблюдали появление коилоцитов при поражении многослойного плоского эпителия вирусами папиллом. Коилоциты представляют собой цитопатические изменения в дифференцирующихся кератиноцитах и являются наиболее легким морфологическим маркером продукции ВПЧ. По данным электронной микроскопии, в них присутствуют капсидный антиген и цельные вирионы (A. Meisels, R. Fortin, 1976 [10]).
В последние два десятилетия оказалось, что поздние гены L1 и L2 кодируют структурные белки вириона. Три ранних гена Е1, Е2, Е4 контролируют функции, необходимые для репродукции вируса, причем Е2 обладает функциями регулятора транскрипции вирусной ДНК. Гены Е5, Е6 и Е7 обладают активностью, стимулирующей пролиферацию и трансформацию клеток. В ходе опухолевой прогрессии кольцевой вирусный геном часто интегрирует в геном клетки путем разрыва ДНК и утраты генов E2, E4, Е5 и частично L2. В клеточный геном встраиваются регуляторная область URR и гены E6 и E7, которые постоянно экспрессируются в опухолевой ткани. Таким образом, в опухолевых клетках отсутствует продукция вирусных частиц и для поддержания трансформированного фенотипа достаточно активности генов E6 и E7. Интеграция ДНК ВПЧ неспецифична, происходит в различные участки генома, часто в участки повышенной хрупкости хромосом. Длительное время интеграция вирусной ДНК рассматривалась как необходимое условие прогрессии цервикальных дисплазий в РШМ (Н. Н. Мазуренко, 2003 [11]). 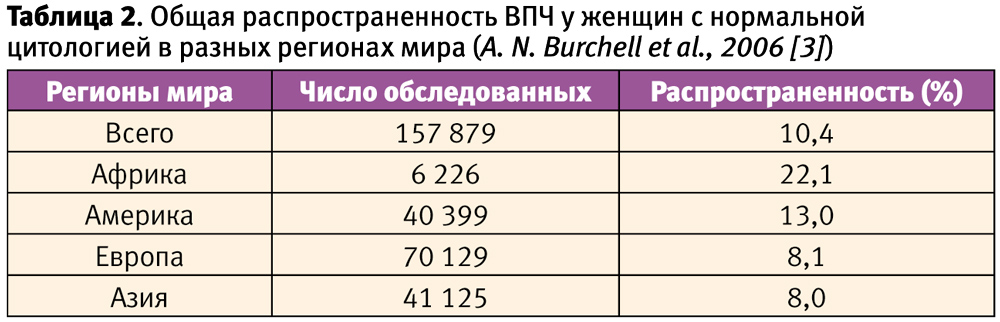
Прогрессия клеток, содержащих ВПЧ в дисплазии слабой и тяжелой степени, с последующей малигнизацией и инвазией опухолевых клеток определяется нарушением контрольных механизмов защиты хозяина. Активная роль иммунной системы в предотвращении возникновения РШМ подтверждается тем, что больные с нарушениями иммунной системы и иммунодефицитом имеют большую частоту ВПЧ-ассоцированных дисплазий и РШМ. По разным данным, от 32 до 50% ВИЧ-инфицированных женщин имеют цервикальную интраэпителиальную неоплазию (Cervical intraepithelial neoplasia – CIN). У женщин, получавших длительное время иммунодепрессанты при трансплантации органов, наблюдается усиление частоты инфекции ВПЧ в 9, а скорости прогрессии CIN – в 17 раз по сравнению с общей популяцией (M. Y. Tjiong et al., 2001 [12]).
Показано, что в регрессию CIN вовлечены Т-хелперы и во время регрессии действуют механизмы гуморального и клеточного иммунного ответов. Распознавание ВПЧ-антигенов продуктами генов основного комплекса гистосовместимости HLA I и II класса необходимо для элиминации вирусинфицированных клеток. Поскольку гены HLA I и II класса отличаются генетическим полиморфизмом, предполагают, что иммунологическая чувствительность к инфекции ВПЧ генетически предопределена и может быть важна для прогрессии CIN и РШМ. Многочисленные исследования, проведенные в различных популяциях, показали, что среди женщин с CIN и РШМ чаще встречаются женщины с определенными вариантами генов HLA I и II класса. Однако частота распространения того или иного варианта HLA I и II классов варьирует в различных популяциях. Тем не менее, наиболее часто встречается ассоциация между наличием B1* аллелей HLA II класса DR B1* 1501 и DQ B1* 0602 и инфекцией ВПЧ 16-го типа (A. H. Beskow et al., 2003 [13]). Поскольку эти аллели чаще встречаются не только среди больных РШМ, но и у «здоровых» женщин с инфекцией ВПЧ 16, они, по-видимому, обусловливают длительную персистенцию вируса в организме. Высокие титры ВПЧ 16 у больных раком in situ женщин выявляются в течение ряда лет еще до появления цитологических изменений. Таким образом, на начальном этапе инфекции ВПЧ нарушения в иммунном ответе могут способствовать длительной персистенции вируса в относительно высоких титрах. На основании данных Шведского онкологического регистра показано существование генетической предрасположенности к цервикальному раку: риск РШМ достоверно вдвое выше у сестер по сравнению со сводными сестрами или падчерицами (P. K. Magnusson, 2000 [14]).
Однако гены, ответственные за эту предрасположенность, пока не выявлены. Существует путь блокировки транскрипции ДНК ВПЧ, запускаемый паракринной стимуляцией клеток эпителия шейки матки макрофагами и цитокинами, в частности фактором некроза опухолей (TNFa). Это приводит к индукции эндогенного синтеза интерферона b и модификации транскрипционного фактора AP1, взаимодействующего с промотором ВПЧ. Предполагают, что модификация AP1 влияет на транскрипцию ВПЧ высокого риска на ранних стадиях канцерогенеза. В иммортализованных клетках транскрипционный фактор AP1 состоит из гомодимера c-jun/c-jun, а обработка TNFa приводит к сдвигу с образованием гетеродимера c-jun/fra 1 и подавлению транскрипции ВПЧ. Суперэкспрессия с-fos в иммортализованных клетках вызывает образование гетеродимера с-jun/c-fos и малигнизацию соответствующих клонов. Однако этот путь не функционирует в опухолевых клетках, так как сигнальный каскад TNFa прерывается при злокачественной трансформации (H. zur Hausen, 2002 [15]).
В 80-е годы 20-го века стали появляться сообщения о связи инфицирования папилломавирусами и онкологическими заболеваниями шейки матки у женщин, которые вскоре были доказаны убедительной статистикой (D. Maucort-Boulch et al., 2008 [16]; J. J. Kim, S. J. Goldie, 2008 [17]).
В тканях эпителиальных дисплазий шейки матки обнаруживаются эписомальные формы ДНК папилломавирусной инфекции. В большинстве случаев рак шейки матки определяется в интегрированной форме. Предполагают, что процесс интеграции составляет собой механизм прогрессии от дисплазии тяжелой степени к раку, который первоначально носит поликлональный характер и происходит на фоне недостаточности клеточного звена иммунитета. Риск злокачественного перерождения связан с несколькими типами папилломавирусной инфекции.
Сложность изучения разных типов вируса заключается в том, что зачастую трудно идентифицировать отдельно взятый тип для изучения ассоциации с раком, преимущественно с РШМ. Однако недавняя (Москва, 2007) монография Международного Агентства по Исследованию Рака указывает, что канцерогенными для человека могут быть вирусы высокого онкогенного риска [18]. Это типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68. Отмечено, что тип 16 наиболее часто встречается в ткани плоскоклеточного рака шейки матки, а тип 18 – в ткани железистого рака – аденокарциномы [18].
Онкогенные типы вируса папилломы человека и рак шейки матки
РШМ в мире является третьей по частоте причиной смертности женщин от рака после РМЖ и рака легкого (P. L. Stern, H. C. Kitchener, 2008 [19]). Для здравоохранения Российской Федерации РШМ является также значимой проблемой и занимает 5-ое место в структуре онкозаболеваний, а среди женщин социально активного и благоприятного для рождения детей возраста (15–40 лет) РШМ является наиболее важной причиной онкологической смертности (М. И. Давыдов, 2008 [20]).
Среди основных причин РШМ следует выделить вирусные инфекции (ВПЧ – 16, 18, 31, 45 типы), раннее начало половой жизни, беспорядочные половые связи, травмы шейки матки в родах, курение. Наиболее часто РШМ регистрируется в возрастных группах старше 45 лет (G. M. Clifford, S. Gallus, R. Herrero et al., 2005 [21]).
В последние годы обозначилась тенденция роста заболеваемости РШМ у женщин в возрастной группе до 29 лет. В России за последние 10 лет прирост заболеваемости РШМ в возрастной группе до 29 лет составил 150%. В г. Новосибирске первичная регистрация злокачественных новообразований шейки матки с 2005 года возросла на 4% и составила в 2007 году 15,1 на 100 тыс. населения, а смертность от этой патологии с 2005 года увеличилась на 40%. Ежегодно в Новосибирске выявляется более 110 новых случаев РШМ. Отмечается и высокий уровень смертности от РШМ в течение первого года после выявления заболевания – 21,7% в 2007 году, при среднероссийском показателе 16,3%. В 2007 году среди впервые выявленных РШМ: III стадия составила 33% (РФ 28,8%), IV – 12,1% (РФ 10,1%). Таким образом, в Новосибирске отмечается высокий удельный вес запущенных стадий заболевания – более 45% в 2007 году. При этом пятилетняя выживаемость составила 67,6%, (то есть 32,4% женщин не проживает пяти лет после постановки диагноза).
Имеющаяся тенденция роста запущенных случаев объясняется недостаточно развитой системой скрининга женского населения на ВПЧ-инфекции, которая связана с развитием РШМ в 100% (а с раком вульвы – еще в 40%). Как следствие, в Новосибирске низкие показатели выявляемости РШМ при профилактических осмотрах. Из впервые диагностированных случаев РШМ при плановых осмотрах в 2007 году выявлено только 19,1%, что значительно ниже даже среднероссийских цифр (28,3%).
Преждевременная смерть от РШМ поражает женщин в наиболее активный период жизни, когда они занимаются воспитанием детей, заняты карьерой, активно участвуют в социальной жизни и вносят вклад в общество. В Российской Федерации от РШМ ежегодно умирают более 6000 женщин. Проблема профилактики РШМ во всем мире в настоящее время решается с помощью вакцинопрофилактики против ВПЧ.
Риск злокачественного перерождения связан с несколькими типами папилломавирусной инфекции. Их обозначают как вирусы высокого онкогенного риска. Наиболее распространенные генотипы ВПЧ в этиологии РШМ – ВПЧ 16, 18, 45 и 31. ВПЧ 16 и 18 вызывают >70% случаев РШМ. ВПЧ 16, 18, 45 и 31 вызывают >90% случаев аденокарциномы (N. Munoz et al., 2004 [22], F. X. Bosch et al., 2003 [23], J. S. Smith, 2007 [24]).
К вирусам низкого риска относят 5 типов – 6, 11, 42, 43, 44. В Российской Федерации зарегистрированы зарегистрированы две профилактические вакцины, позволяющие предотвратить инфицирование онкогенными типами (16 и 18 тип) вируса папилломы человека и, таким образом, защитить женщин от РШМ.
В настоящее время ряд зарубежных стран уже приняли национальные рекомендации по массовой вакцинации для профилактики рака шейки матки. В 54 странах мира, в том числе в Европе, США, Австралии, Канаде вакцинопрофилактика рака шейки матки включена в национальный календарь прививок (P. L. Stern, H. C. Kitchener, 2008 [19]).
Перспективы вакцинации против ВПЧ
В настоящее время оценить эффективность вакцинации против ВПЧ очень сложно.
В то же время проведение рандомизированных плацебо-контролируемых двойных слепых исследований с участием девушек-подростков и молодых женщин показали многообещающие результаты использования двух зарегистрированных вакцин (Гардасил, Церварикс).
Комбинированный анализ результатов исследования и последующего пятилетнего наблюдения за вакцинацией Гардасилом и более чем семилетним периодом наблюдения за Цервариксом показал 100% защиту от цервикальных интраэпителиальных поражений высокой степени – CIN2+ (S. M. Garland et al, 2007 [25], D. M. Haper et al., 2006 [26]. Дополнительно, для Церварикса, было показано, что вакцинация обеспечивает перекрестную защиту у 40,6% вакцинированных в отношении любых цитологических нарушений, вызванных другими онкогенными типами вируса. Максимальная выраженность иммунного ответа отмечалась сразу по завершению курса вакцинации. Антитела сохранялись на протяжении пяти лет последующего наблюдения. Для Церварикса уровень антител, в 11 и более раз превышающий уровень антител в ответ на естественную ВПЧ-инфекцию, сохранялся более 7 лет и наблюдения за вакцинированными пациентками продолжаются (N. S. De Carvalho, 2009 [27]). Кроме того, доказана нейтрализующая способность вырабатываемых антител. Прямое сравнительное исследование двух вакцин против ВПЧ 6/11/16/18 (Гардасил) и вакцины против 16/18, содержащей адъювант ASO4-монофосфорил липида А (Церварикс) показало, что титр антител через месяц после введения первой дозы вакцины женщинам 18–26 лет был в 3,7 раз выше по ВПЧ 16 и в 7,3 раз выше по ВПЧ 18 в группе женщин, получивших Церварикс по сравнению с Гардасилом (M. H. Einstein, 2009 [28]). В исследовании длительного наблюдения было показано, что серологический ответ на введение двухвалентной вакцины был в 2 раза выше у девочек 10–14 лет, чем у женщин 15–25 лет, что указывает на целесообразность прививок в более раннем возрасте (D. M. Haper, 2004 [29]). Актуальным остается вопрос об эффективности вакцинации для женщин более зрелого возраста, учитывая, что средний возраст больных РШМ в настоящее время составляет 54,6 года. Женщины старших возрастных групп также могут получить профилактическую пользу от вакцинации, но не во всех случаях одинаковую. На модели квадривалентной вакцины было показано, что отмечалось снижение частоты заболеваний, ассоциированных с ВПЧ-вакцинных типов у женщин, которые на момент вакцинации были ВПЧ-позитивными, но у которых еще не было отмечено сероконверсии. Для ВПЧ-позитивных женщин при наличии сероконверсии это отмечено не было (С. И. Роговская, 2007 [30]). В 2006 г. представлены данные американского общества клинических онкологов об уровне антител после вакцинации бивалентной вакциной у 666 женщин различных возрастных групп: 15–25, 26–35, 36–45 и 46–55 лет. Выявлено, что во всех возрастных группах через 7 и 12 месяцев уровень антител выявлялся в 100% случаев и был в 16–25 раз выше, чем при естественном течении. Титр антител в старших возрастных группах был таким же или даже выше, чем у женщин в группе 15–25 лет при наблюдении в течение 4,5 лет и имел 100% эффективность против 16 и 18 типов ВПЧ. Кроме того отмечена и перекрестная реакция в отношении 31 и 45 типов.
Несмотря на положительные результаты клинических исследований вакцин, реальные последствия широкомасштабной вакцинации, которая приведет к снижению заболеваемости от злокачественной патологии, ассоциированной с ВПЧ, станут достоянием не ранее, чем через 2 десятилетия. В то же время, как показывают результаты математического моделирования, внедрение вакцины позволит существенно снизить заболеваемость РШМ в развитых странах. Например, вакцинация 75–100% населения Германии позволит снизить заболеваемость РШМ на 53–70% через 15 лет. Безусловно, вакцинация не может подменить собой скрининговые программы и не решает проблем женщин старше 26 лет, однако позволит значительно снизить заболеваемость и смертность от ВПЧ-ассоциированных заболеваний, сократить расходы здравоохранения за счет увеличения интервала в скрининговых программах.
В то же время, остается ряд вопросов в отношении вакцинации против ВПЧ медицинского, экономического, общеобразовательного и психологического характера, которые требуется еще решить. Безусловно, это вопросы организационного плана, решение которых способствовало бы включению вакцинации против ВПЧ в государственные программы вакцинации населения. Наиболее приемлемым возрастом для вакцинации подростков в России, возможно, будет 10–14 лет, когда отсутствует существенная «прививочная нагрузка», имеется минимальный риск предшествующего инфицирования и максимально высока иммуногенность вакцины [18]. Изучение экономической эффективности программ массовой иммунизации против ВПЧ показало: для стран с доходом менее 825 USD на одного человека экономически обоснованная цена вакцины для массовой иммунизации – менее 60 USD, однако сейчас она составляет 360 USD (T. C. Wright, 2006 [31]). Повышение общеобразовательного уровня как среди врачей акушеров-гинекологов, онкологов, педиатров, так и санитарной культуры женского населения о необходимости вакцинации против ВПЧ. Анализ уровня знания врачей о ВПЧ в Европейских странах и России показал, что в Европе 85% гинекологов и 93% педиатров знают, что ВПЧ является причиной развития РШМ в России только 21%. В Европе 93% врачей имеют информацию о профилактической вакцине против ВПЧ в России 28%. Достаточно низким остается и уровень знаний об этой проблеме среди женского населения. Опрос более 5000 женщин в различных станах Европы показал, что только 17% из них знают, что ВПЧ вызывает РШМ, 17% отметили, что основным путем передачи инфекции является половой, в России из 587 опрошенных женщин только 4% считали ВПЧ причиной развития РШМ. Интерес к проблеме вакцинации и желании вакцинироваться проявили 85–90% женщин европейских стран, в РФ большинство женщин не знают о профилактических вакцинах против ВПЧ (С. И. Роговская, В. Н. Прилепская, 2008 [32]). Также требуется дальнейшее изучение возможности создания коллективного иммунитета в отношении онкогенных типов ВПЧ – решение вопроса о необходимости вакцинации подростков мужского пола и мужчин, целесообразности создания мультивалентной вакцины.
Несмотря на многие еще нерешенные вопросы, полученные и накапливаемые в настоящее время данные, позволяют уже сейчас рассматривать вакцинацию как вполне реальный путь борьбы с РШМ в качестве первичной профилактики.
Таким образом, ВПЧ у значительной части инфицированных может приводить к развитию РШМ. Кроме того, проблема папилломавирусной инфекции имеет не только медицинское, но и социальное значение, снижая качество жизни у инфицированных женщин. Поэтому широкое внедрение специфической и неспецифической иммунопрофилактики имеет важное практическое значение. Наряду с решением вопросов о вакцинопрофилактике в фокусе внимания врача должны находиться: скрининговые программы, адекватное лечение клинических форм, повышение знаний о проблеме среди населения и профилактика инфицирования среди активной группы старше 26 лет.
Полный список литературы находится в редакции.


коментариев