СПІНАЛЬНА АНЕСТЕЗІЯ ПРИ КЕСАРЕВОМУ РОЗТИНІ У ВАГІТНИХ З ОЖИРІННЯМ
Приблизно 7% дорослого населення планети страждає на ожиріння. Сьогодні це зростаюча проблема у західному світі та в окремих країнах, що розвиваються. ВООЗ оцінює поширеність ожиріння як пандемію. Під час вагітності створюються сприятливі умови для розвитку жирової клітковини, біологічний сенс якої полягає у захисті майбутньої дитини.
Це обумовлено гормональною перебудовою в організмі жінки, а саме підвищеним синтезом прогестерону і ХГЛ (гормонів, що підтримують вагітність), а також дефіцитом естрадіолу, що виробляється яєчниками переважно поза вагітністю
Дія цих гормонів і обумовлює відкладення жирової тканини переважно в області молочних залоз, сідниць, стегон, живота.
У хворих з ожирінням вагітність рідко протікає без ускладнень. До найбільш поширених відносять гестаційний діабет, артеріальну гіпертонію, гіперкоагуляцію, інфекції сечовивідних шляхів, невиношування або переношування вагітності, прееклампсію, передчасне вилиття навколоплідних вод, народження дитини з великою масою тіла.
- Joshya Weiss, D. Fergal Malone у журналі «American Journal of Obstetrics and Gynecology» опублікували дослідження про вплив ожиріння на акушерські результати. Багатофакторний аналіз показав, що саме збільшення ІМТ при вагітності, а не вага, було значущим предиктором кесаревого розтину.
Безумовно, вагітна з ожирінням для анестезіолога є більш складною у плані анестезіологічного забезпечення. Кесарів розтин може бути проведений під загальною, реґіонарною і місцевою інфільтраційною анестезією.
Вибір методу анестезії визначається багатьма чинниками – досвідом і кваліфікацією операційної бригади, ступенем терміновості операції, станом матері та плоду і, не в останню чергу, – можливостями лікувального закладу [1]. Кожен метод анестезії має свої переваги і недоліки, для кожного існують досить суворі показання та протипоказання.
Серед анестезіологів різних шкіл і напрямів було (а в деяких лікувальних закладах і до сьогодні триває) багато суперечок щодо методу вибору оптимального анестезіологічного забезпечення операції КР. Спроба відповісти на ці питання була зроблена в Англії, де був проведений аналіз всіх причин материнської смертності. Порівняння показників виявило таку картину. Хоча материнська смертність у цілому неухильно знижується, летальність, пов'язана з анестезією, до останнього часу не знижувалася і до 1994 року, за даними J. L. Hawkins, була третьою причиною материнської летальності як такої [6].
При аналізі анестезіологічної летальності відзначено, що основною причиною серйозних ускладнень є неможливість інтубації трахеї з подальшою гіпоксемією або аспірація шлункового вмісту з розвитком синдрому Мендельсона. Зрозуміло, що такі серйозні ускладнення призвели до зростання популярності регіонарної анестезії як для планових, так і для екстрених операцій. Причини підвищеного ризику загальної анестезії пояснюються фізіологічними змінами під час вагітності.
Насамперед, це підвищений ризик аспірації шлункового вмісту (всі вагітні повинні розглядатись анестезіологом як пацієнти з повним шлунком), у 10–15 разів більша частота складних інтубацій, ніж у звичайній хірургії (1 складна інтубація на 250 інтубацій) [6].
При невдалій або довготривалій інтубації десатурація матері (відповідно, і плода) відбувається набагато швидше, ніж у невагітних. При цьому вентиляція маскою може бути неефективною та призводити до регургітації шлункового вмісту. Безумовно, всі ускладнення, які відбуваються з породіллею, мають суттєвий вплив на плід.
У даний час реґіонарна анестезія для акушерських операцій визначена як оптимальний метод анестезіологічної допомоги в акушерстві усіма провідними медичними організаціями світу (RCOG, FIGO, ACOG, AAGBI/OAA, ASA, SOAP та ін.).
Переваги регіонарної анестезії при операції кесаревого розтину:
- Профілактика аспіраційного синдрому.
- Мінімальне (або відсутнє взагалі) фармакологічне навантаження на плід і новонародженого.
- Зменшення обсягу крововтрати за рахунок гіпотензивного ефекту.
- Інтервал до вилучення плоду під час операції кесаревого розтину не обмежений у часі.
- Профілактика тромбоемболічних ускладнень.
- Змога побачити немовля з перших секунд його життя.
- Можливість раннього прикладання дитини до грудей матері (навіть під час операції).
- Зменшення вартості анестезіологічного забезпечення.
- Можливість раннього ентерального харчування породіллі.
Серед існуючих методів реґіонарної анестезії при кесаревому розтині є багато прихильників спінальної чи епідуральної анестезії. Все більшу поширеність завойовує в анестезіологічному забезпеченні цієї операції комбінована спірально-епідуральна анестезія. Всі ці методи мають свої певні пераваги та недоліки, тому і до сьогодні точаться суперечки щодо методу вибору регіонарної анестезії (табл. 1). 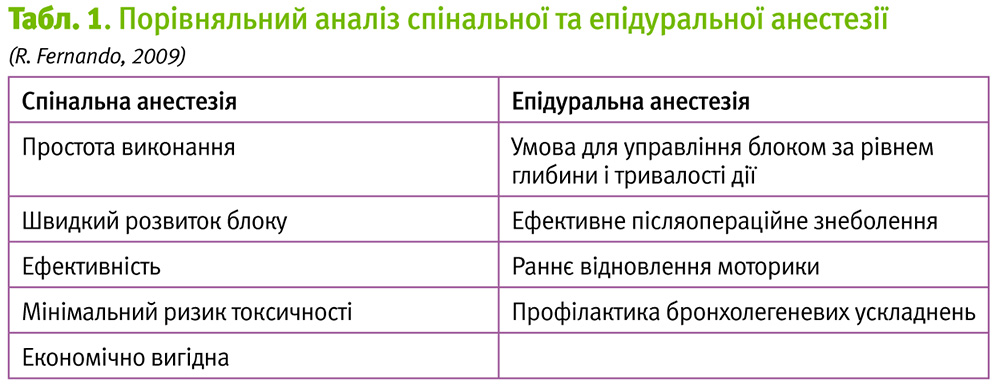
При цьому регіонарна анестезія не позбавлена побічних ефектів і ускладнень, серед яких розвиток артеріальної гіпотонії можна віднести до одного з найбільш частих ускладнень (від 30,5% до 85%) [2, 3]. Артеріальна гіпотонія негативно впливає не лише на організм матері [4], але й на стан плода [5] за рахунок зменшення плацентарної перфузії. Артеріальна гіпотензія – найбільш часте ускладнення спінальної анестезії. Причина даного ускладнення – медикаментозна симпатектомія. У вагітних внаслідок аорто-кавальної компресії, вона виникає частіше та є більш вираженою. Лікування (згідно протоколу «Кесарів розтин» №977 від 27.12.2011 р.) у разі зниження вихідного систолічного АТ на 30% або нижче 90 мм рт. ст. полягає у збільшенні темпу інфузії, зміщенні матки у лівий бік, інсуфляції кисню до 6–8 л/хв. У випадках рефракторності АТ до проведених заходів внутрішньовенно вводять 1–3 мг фенілефрину (мезатону).
Сьогодні для спінальної анестезії при КР в Україні дозволено застосування лідокаїну 2% та гіпербаричного 0,5% бупівакаїну. Для поліпшення якості аналгезії можливе додавання до розчину місцевого анестетика 15–25 мкг фентанілу [1].
Використання лідокаїну асоціюється з більшою частотою артеріальної гіпотензії та розвитком транзиторних неврологічних порушень [4]. Один із самих яскравих описів нейротоксичності місцевих анастетиків вперше описаний в 1993 р Schneider. Він повідомив про виникнення інтенсивного болю у спині, що розвивається у пацієнтів після спінальної анестезії лідокаїном, назвавши больові відчуття синдромом подразнення нервових корінців. Пізніше був запропонований існуючий нині термін «транзиторний неврологічний синдром». Надалі Y. Auroy встановив, що близько 75% неврологічних ускладнень при виконанні спінальної анестезії асоційовані з застосуванням лідокаїну. На даний час в Україні найпоширеніший препарат для спінальної анестезії є гіпербаричний бупівакаїн (Лонгокаїн Хеві, Маркаїн-Спінал Хеві, Бупівакаїн агетан та ін.). Для нього характерна велика тривалість дії (90–240 хв.).
При виборі препарату для спінальної анестезії обов'язково необхідно враховувати таку характеристику анестетика як баричність – відношення щільності анестетика до щільності ліквору при температурі тіла. Цей показник вкрай важливий, оскільки дозволяє судити про те, як буде вести себе анестетик при введенні у субарахноїдальний простір.
Існують гіпо-, ізо- та гіпербаричні розчини анестетиків. Тенденція до більш широкого застосування гіпербаричних розчинів пояснюється прагненням анестезіологів зменшити частоту високих блоків, оскільки вважається, що краніальне розповсюдження «важкого» анестетика може бути обмежене грудним кіфозом. Тобто при горизонтальному положенні вагітної на спині анестетик не підніметься вище T6-5, що і буде профілактикою високого блоку та його наслідків.
Для профілактики артеріальної гіпотензії при КР застосовують різні методи. Досить широко раніше застосовувався метод преінфузії кристалоїдами в об’ємі 15–20 мл/кг. Однак ця методика недостатньо ефективна і сьогодні вже не рекомендована. Більш ефективним вважається метод «постінфузії», коли інфузійна терапія розпочинається одразу після виконання спінальної анестезії у швидкому темпі.
Вільне орієнтування лікаря у питаннях оцінки якості, рівня і глибини досягнутого блоку є основою його своєчасних і адекватних лікувальних заходів при виникненні будь-яких ускладнень. Слід пам'ятати, що швидкість розвитку операційної анестезії неоднакова у різних препаратів – так, наприклад, при використанні лідокаїну блок розвивається за 2–4 хвилини, в той час як при використанні бупівакаїну його розвиток може затягнутися до 8–10 хвилин.
Для запобігання розвитку некерованої артеріальної гіпотензії при СА під час КР також використовують методику розрахунку доз місцевого анестетика. Існують різні варіанти дозування місцевих анестетиків при проведенні операції кесаревого розтину. Деякі з них засновані на застосуванні фіксованих доз препаратів. Інші засновані на розрахунку дози місцевого анестетика за морфометричними характеристиками пацієнта. Цей варіант більш обґрунтований, оскільки встановлено, що довжина і маса тіла значно впливають на остаточний рівень блоку. Наприклад, є дані про те, що час розвитку сенсорного блоку зростає із збільшенням довжини тіла і зменшується зі збільшенням маси [7].
Найбільш простим та часто вживаним є спосіб, що полягає у визначенні дози місцевого анестетика за зростом пацієнтки (Табл. 2). 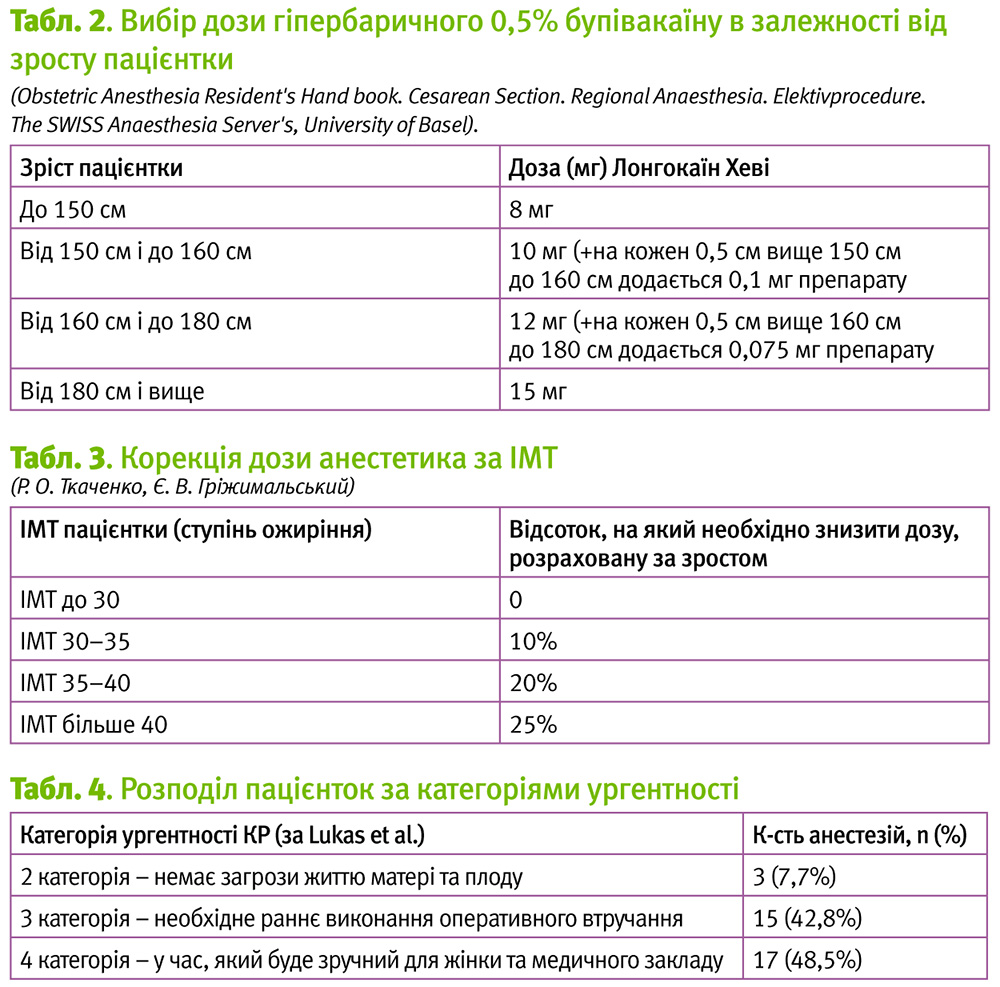
Недоліком вказаного способу є те, що відсутня корекція розрахованої за ростом дози анестетика при збільшеній масі тіла пацієнтки. При надмірній масі тіла (визначається як збільшення індексу маси тіла більше 25 кг/м2) відбувається зменшення обсягу субарахноїдального простору та об'єму ліквору. Введення дози місцевого анестетика, розрахованого тільки за зростом без корекції дози на збільшення маси тіла, призводить до більш краніального поширення анестетика. При цьому виникає неадекватно висока блокада симпатичної нервової системи, яка призводить до розвитку серцево-судинних ускладнень у вигляді артеріальної гіпотонії та брадикардії у матері.
Нашою метою була розробка методики підбору доз гіпербаричного бупівакаїну для спінальної анестезії при кесаревому розтині у пацієнток з підвищеною масою тіла.
Для попередження вищенаведених ускладнень ми пропонуємо корекцію розрахованої дози анестетика за зростом, у вигляді зниження дози препарату у залежності від ІМТ (табл. 3).
Для поліпшення якості аналгезії додаємо до розчину місцевого анестетика 25 мкг фентанілу.
Дослідження проводилось у Київському міському центрі перинатальної та репродуктивної медицини. У дослідження було включено 35 жінок з підвищеною масою тіла (ІМТ=33,6±4,3) та неускладненим перебігом вагітності у віці від 18 до 40 років, що прооперовані у терміні гестації від 38 до 41 тижнів (середній термін – 39,7±0,8 тижнів) в умовах спінальної анестезії, в основному, 3–4 категорії ургентності (табл. 4).
Всі пацієнтки були статистично однорідними за антропологічними характеристиками, ступенем анестезіологічного ризику і за характером оперативного розродження. В обох групах використовували гіпербаричний бупівакаїн. Пацієнтки були розділені на дві групи: I (n=15) – спінальна анестезія проводилася з розрахунком препарату за зростом, II (n=20) – спінальна анестезія проводилася з розрахунком препарату за зростом і корекцією за ІМТ пацієнтки по запропонованій нами методиці. Дослідження проводили у 2 етапи: I – на операційному столі перед спінальною анестезією, II – безпосередньо після вилучення плоду. Оцінювався гемодинамічний профіль апаратом КМ-АР-01 Діамант (Росія), а саме: систолічний та діастолічний тиск, частота серцевих скорочень, серцевий викид, серцевий индекс, загальний периферичний опір судин. Артеріальна гіпотонія визначалася нами як зниження систолічного артеріального тиску більше 25% від початкового рівня або нижче 90 мм рт. ст. При цьому ми збільшували темп інфузії кристалоїдів, а у випадках рефракторності АТ до проведених заходів внутрішньовенно вводили розчин мезатону (фенілефрину).
У результаті проведеного дослідження ми отримали наступне (табл. 5). 
У першій групі у 8 випадках (53,4%) було відзначено розвиток артеріальної гіпотонії, 7 (46,6%) з яких потребували додаткового введення мезатону.
У другій групі зниження систолічного артеріального тиску нижче 25% (або нижче 90 мм рт. ст.) від початкового рівня відмічався у 5 жінок (25%), з яких у 3 (15%) використовували мезатон. Отримано достовірне розходження між групами за частотою розвитку артеріальної гіпотонії (р<0,05).
Порівнюючи результати, отримані при оцінці гемодинамічного профілю, ми відмітили вірогідну різницю між показниками серцевого індексу та загального периферичного опору судин у групах порівняння (табл. 6). Так, у пацієнток I групи спостерігалися вірогідно нижчі вищезазначені показники, а також рівень систолічного артеріального тиску після вилучення плода та наростання тахікардії. Це свідчить, що у вагітних із підвищеною масою тіла застосування запропонованої нами схеми коригування дози гіпербаричного бупівакаїну супроводжується зменшенням частоти розвитку артеріальної гіпотензії на 28,4% і, як наслідок, вірогідно меншими проявами порушень центральної і периферичної гемодинаміки.
Перелік літератури знаходиться у редакції.
ДетальнішеСЕРДЕЧНО-ЛЕГОЧНАЯ РЕАНИМАЦИЯ У БЕРЕМЕННЫХ
В повседневной жизни пяти минут достаточно, чтобы сварить по вкусу яйцо – «в мешочек» или «всмятку» и сделать бутерброд. За это же время от дежурной бригады требуется убедиться в остановке сердца, начать сердечно-легочную реанимацию, и в том случае, если немедленно не восстановился сердечный ритм, извлечь плод путем операции кесарева сечения. Эти чрезвычайно высокие и трудновыполнимые требования, если учесть, что остановка сердца у матери – редкое и часто неожиданное осложнение, – диктует необходимость разработки четкого алгоритма и регулярных тренингов.
Знания, безусловно, необходимы, но решающее значение имеет способность дежурной бригады своевременно выполнить реанимационные мероприятия. Без сомнения, достижение сочетания теоретических знаний с клиническими навыками проведения реанимации является сложной задачей. В случае несвоевременно начатой сердечно-легочной реанимации и запоздалом родоразрешении, остановка сердца у беременной ухудшает исход для матери и плода. Редкая частота этого осложнения затрудняет выработку оптимальной лечебной стратегии и не позволяет подвести доказательную базу под наши рекомендации. По этой причине текущие протоколы основываются на описании случаев и рекомендациях экспертов. Хотя необходимость выполнения кесарева сечения в течение четырех минут от момента остановки сердца окончательно не доказана, все же есть основания в настоящее время рекомендовать именно такой алгоритм действий. Приводимые нами клинические наблюдения лишь подтверждает это мнение.
Зима
В приемное отделение городского родильного дома поступила женщина 26 лет с предвестниками родовой деятельности. Осмотрена дежурным врачом, заполнена соответствующая документация, акушеркой приемного отделения катетеризирована периферическая вена (что в дальнейшем очень облегчило работу анестезиологов), женщина определена в индивидуальный родильный зал вместе с мужем. Диагноз: І беременность 39–40 недель. Первый период родов. Через 4 часа самостоятельно отошли чистые околоплодные воды. На глазах у мужа и дежурной бригады женщина упала без сознания.
Вызвана реанимационная бригада. Пульс на периферии не определялся, на сонной артерии нитевидный, дыхание редкое и шумное, зрачки широкие, сознание отсуствует. Начат непрямой массаж сердца, с помощью мешка Амбу вентиляция легких, матка рукой смещена влево. Внутривенно введен 1 мг адреналина. Через 4 минуты самостоятельный сердечный ритм не восстановлен. Проведена интубация трахеи. Принято решение о срочном кесаревом сечении. Женщина перемещена в операционную (на одном этаже с родзалом), на фоне непрямого массажа сердца и искусственной вентиляции легких на первой минуте извлекли доношенную девочку с оценкой по шкале Апгар 5 и 7 балов. Повтор дозы адреналина, дефибриляция, непрямой массаж сердца. Через 10 минут сердечный ритм восстановлен. Во время операции развились признаки коагулопатии, произведена экстирпация матки. Для лечения ДВС-синдрома использовался октоплекс, СЗП, эритроцитарная масса, теплая донорская кровь. Объем кровопотери составил около 4000 мл. На протяжении трех суток еще несколько раз была зафиксирована остановка сердечной деятельности. Женщина умерла от полиорганной недостаточности. Причина смерти – эмболия околоплодными водами. Ребенок в удовлетворительном состоянии выписан домой.
Весна, март
В перинатальный центр поступила беременная 32 года с жалобами на слабость, отдышку, ощущения сердцебиения, отеки нижних конечностей. Ухудшение состояния почувствовала после перенесенного ОРВИ (болела неделю). Диагноз: ІІ беременность 34–35 недель. Комбинированный митрально-аортальный порок. СН ІІ.
Анамнез: Находится на учете в Национальном институте сердечно-сосудистой хирургии им. Н. М. Амосова по поводу митрально-аортального порока. Пять лет назад самостоятельные роды в НИИ ПАГ без осложнений. В 12 недель беременности консультирована кардиологами, получена рекомендация пролонгировать беременность.
В приемном отделении в момент поступления – потеря сознания с судорогами, непроизвольным мочеиспусканием. Зрачки расширены и не реагируют на свет, диффузный цианоз, пульсация на крупных артериях и дыхание отсутствует. Вызвана реанимационная бригада, начата сердечно-легочная реанимация. Диагностирована фибрилляция желудочков на ЕКГ. В течение 5 минут выполнения реанимационных мероприятий эффекта не было. Одновременно с СЛР выполнено кесарево сечение в приемном отделении (на месте происшествия). Извлекли ребенка, 5–7 балов по Апгар. На магистральные сосуды наложены зажимы. После очередного сеанса дефибрилляции сердечный ритм восстановлен.
Пациентка переведена в операционную, где была закончена операция. В дальнейшем предстояла борьба с постреанимационной болезнью, которая проявлялась полиорганной недостаточностью, отеком головного мозга и комой. На протяжении 6 суток пациентка был в коме на аппаратном дыхании через трахеостому. Была выписана в удовлетворительном состоянии и в дальнейшем прооперирована по поводу порока.
Дискуссия
Согласно европейским и американским рекомендациям по СЛР у беременных, если в течение 4–5 минут реанимационные мероприятия безуспешны, необходимо рассмотреть возможность выполнения реанимационного кесарева сечения и извлечения плода в течение 60 секунд. При этом приоритет всегда отдается жизни матери. Данное очень важное положение необходимо всесторонне обсудить и ввести в нормативные приказы по оказанию медицинской помощи в Украине. Так, на фоне продолжения проведения СЛР необходимо решить следующие вопросы:
- при сроке беременности <20 недель реанимационное кесарево сечение не показано;
- при сроке беременности 20–23 недели — проведение экстренной гистеротомии без сохранения жизни ребенка;
- при сроке беременности 24–25 недель — проведение экстренной гистеротомии с сохранением жизни матери и ребенка;
При беременности более 22 недель извлечение плода в условиях проведения СЛР обеспечит уменьшение аутокавальной компрессии, что, в свою очередь, увеличит венозный возврат крови к сердцу и сердечный выброс, на 25–50% увеличится ОЦК. Уменьшится сдавление легких диафрагмой, что позволит увеличить вентиляцию легких, а также повысится эффективность компрессии грудной клетки за счет уменьшения ее сопротивления.
При этом необходимо отметить, что, как показали результаты анализа, несмотря на то, что процедуры по спасению жизни матери первичны, у младенцев отмечался более высокий уровень выживаемости при извлечении их в течение 5 минут с момента остановки кровообращения у матери. Причем было показано, что раннее извлечение ребенка при остановке кровообращения у матери связано с улучшением исхода как для матери, так и для ребенка.
Резюме
- Остановка сердца – возможный финал при многих критических состояний состояниях.
- Выживание матери и плода зависят от быстрой и качественной реанимации.
- Необходимо предусмотреть возможность выполнения раннего (<5 мин.) кесарева сечения.
- Извлечение плода – часто необходимая составляющая восстановления кровообращения у матери, а не просто последняя отчаянная попытка.
- Реанимационные мероприятия следует продолжать и во время извлечения плода.
- Обучение по сердечно-легочной реанимации и интенсивной терапии у беременных необходимо для всех медработников акушерских клиник и отделений.

