Введение
Изменения в системе свертывания крови во время беременности обеспеспечиваются, с одной стороны, оптимальным плацентарным кровоснабжением на протяжении всей беременности с надежным антикоагуляционным потенциалом, что предупреждает развитие тромбозов сосудов маточно-плацентарного комплекса, а с другой стороны – характеризуются высокой коагуляционной способностью, которая уменьшает кровопотерю во время родов, путем быстрого и адекватного свертывания крови. Изменения в гемостазе начинают появляться уже с 12 недели беременности (Макацария А. Д., Мищенко А. Л., 1997).
Переход от угнетения к активизации повышения фибринолиза является необходимым, но потенциально небезопасным в плане развития «молниеносного» гиперфибринолиза.
Хирургическое вмешательство может способствовать развитию дисбаланса гемостаза. Венозные тромбозы и эмболии (ВТЭ) остаются одной из ведущих причин материнской смертности в развитых странах, преимущественно за счет ТЭЛА – до 20% в структуре акушерских ВТЭ [1, 2]. Послеродовый период является наиболее опасным в плане развития ассоциированных с беременностью и родами тромбозов, риск которых достигает в среднем 2‰ [3]. При проведении кесарева сечения частота ВТЭ, по разным оценкам, достигает 18 случаев на 1000 операций [4].
Наиболее часто ВТЭ развиваются в случаях, если возраст женщины старше 35 лет, имеется ожирение или родоразрешение выполняется путем кесарева сечения (КС) [9]. Согласно последним рекомендациям Американского общества специалистов по заболеваниям органов грудной клетки (ACCP), при беременности для тромбопрофилактики следует отдавать предпочтение низкомолекулярным гепаринам (НМГ), а не обычному гепарину [4]. Необходимо воздерживаться от использования непрямых антикоагулянтов при беременности (тератогенность, кровотечения у плода), а также прямых ингибиторов тромбина (типа дабигатрана) и пероральных блокаторов Xa фактора (типа ривароксабана). Профилактику ВТЭ с помощью НМГ целесообразно использовать у женщин, перенесших КС по неотложным показаниям, и у тех, кому было произведено плановое КС при наличии факторов риска развития ВТЭ.
Послеродовой период характеризуется наиболее высоким риском ВТЭ, который, по сообщениям, может быть до 25 раз выше, чем у небеременных женщин. Согласно данным литературы, 43—60% связанных с беременностью эпизодов ТЭЛА приходятся именно на послеродовый период.
Во время родов могут иметь место дополнительные факторы риска: метод родоразрешения (риск ВТЭ в 3—6 раз выше при КС по сравнению с вагинальными родами, повышен при экстренном КС, а также при инструментальных родах); длительность родов >12 ч.; иммобилизация, большая полостная операция длительностью >30 мин., во время беременности и в п/р периоде; ПР; большая потеря крови (>1 л) или переливание крови. В послеродовом периоде добавляются такие факторы риска ВТЭ как обезвоживание, иммобилизация и анемия. Продолжительность тромбопрофилактики после КС остается предметом обсуждения. Последние рекомендации предусматривают проведение тромбопрофилактики у этих пациенток в течение семи дней [15]. Однако нет научных доказательств в пользу той или иной продолжительности тромбопрофилактики после КС, только клинические рекомендации.
Цель работы
Изучить влияние п/о старта тромбопрофилактики эноксапарином натрия (Фленокс) на частоту тромботических и геморагических осложнений на фоне операции кесарева сечения.
Материалы и методы
Работа выполнялась на базе КУ «Днепропетровский городской родильный дом №1» ДОГА МОЗ Украины.
В исследование были включены женщины, которым родоразрешение проводилось путем КС под субдуральной, комбинированной (субдуральной и эпидуральной), общей анестезией. Мы изучали частоту возникновения геморрагических и тромботических осложнений у женщин после кесарева сечения, которые получали НМГ (эноксапарин натрия (Фленокс) 2000 анти-Ха МЕ, 0,2 мл) через 8–12 часов после операции (время было привязано к методу анестезии). Критерии включения: женщины, перенесшие оперативное родоразрешение путем КС; отсутствие применения во время беременности НМГ, отсутствие аллергической реакции на гепарин и его производные.
 Критерии исключения: женщины, которые во время беременности получали препараты для профилактики или лечение ВТЭ любым НМГ (высокий риск ВТЭ во время беременности), гестационная анемия тяжелой степени, коагулопатия, тромбоцитопения, наличие аллергической реакции на гепарин или его производные, отказ пациента от участия в исследовании. Позже исключили участниц, у которых продолжительность профилактики была меньше или больше необходимого срока (5 или 10 дней). Точки контроля: перед операцией, 1, 2, 7 сутки после операции, 30 сутки после выписки из стационара.
Критерии исключения: женщины, которые во время беременности получали препараты для профилактики или лечение ВТЭ любым НМГ (высокий риск ВТЭ во время беременности), гестационная анемия тяжелой степени, коагулопатия, тромбоцитопения, наличие аллергической реакции на гепарин или его производные, отказ пациента от участия в исследовании. Позже исключили участниц, у которых продолжительность профилактики была меньше или больше необходимого срока (5 или 10 дней). Точки контроля: перед операцией, 1, 2, 7 сутки после операции, 30 сутки после выписки из стационара.
У пациентов исследовали конечные точки эффективности и безопасности вводимых препаратов, что включало обьем кровопотери на фоне тромбопрофилактики, повторное вмешательства по поводу геморрагических осложнений, кровоточивость раны в раннем послеоперационном периоде, дополнительная терапия кровоточивости, кровотечение либо кровоточивость, которые не привели к отмене препарата и использованию дополнительных мероприятий, кровотечение по дренажам в раннем послеоперацинном периоде, гематомы в области послеоперационной раны, наличие экхимозов в месте иньекции препарата. Сюда же относили тромботические осложнения: бессимптомный либо симптоматический ТГВ, ТЭЛА, связанная с ВТЭ материнская смертность за трехмесячный период после КС. Статистическая обработка результатов с помощью программного обеспечения пакета MS Excel проводилась с помощью расчета критериев Стьюдента с р<0,05. В иследование было включено 100 пациенток, перенесших КС и рандомизированых в две группы: группа 1 – с послеоперационным стартом эноксапарином натрия (Фленокс), в дозе 2000 анти-Ха МЕ (0,2 мл) через 8 часов, группа 2 – с послеоперационным стартом эноксапарином натрия (Фленокс) через 12 часов по 2000 анти-Ха МЕ (0,2 мл) 1 раз в сутки 7 дней.
В случае регионарной анестезии эноксапарин натрия (Фленокс) вводили не менее чем через 8 часов после удаления эпидурального катетера или через 10–12 часов при его наличии. Длительность курса тромбопрофилактики составила 7 дней, так как пятидневный курс рекомендовался клиническими руководствами 2008 года для тромбопрофилактики после КС, а многие показатели свертывания крови начинают нормализоваться только после первой недели послеродового периода, хотя риск может сохраняться и до шестой недели.
Результаты и обсуждение
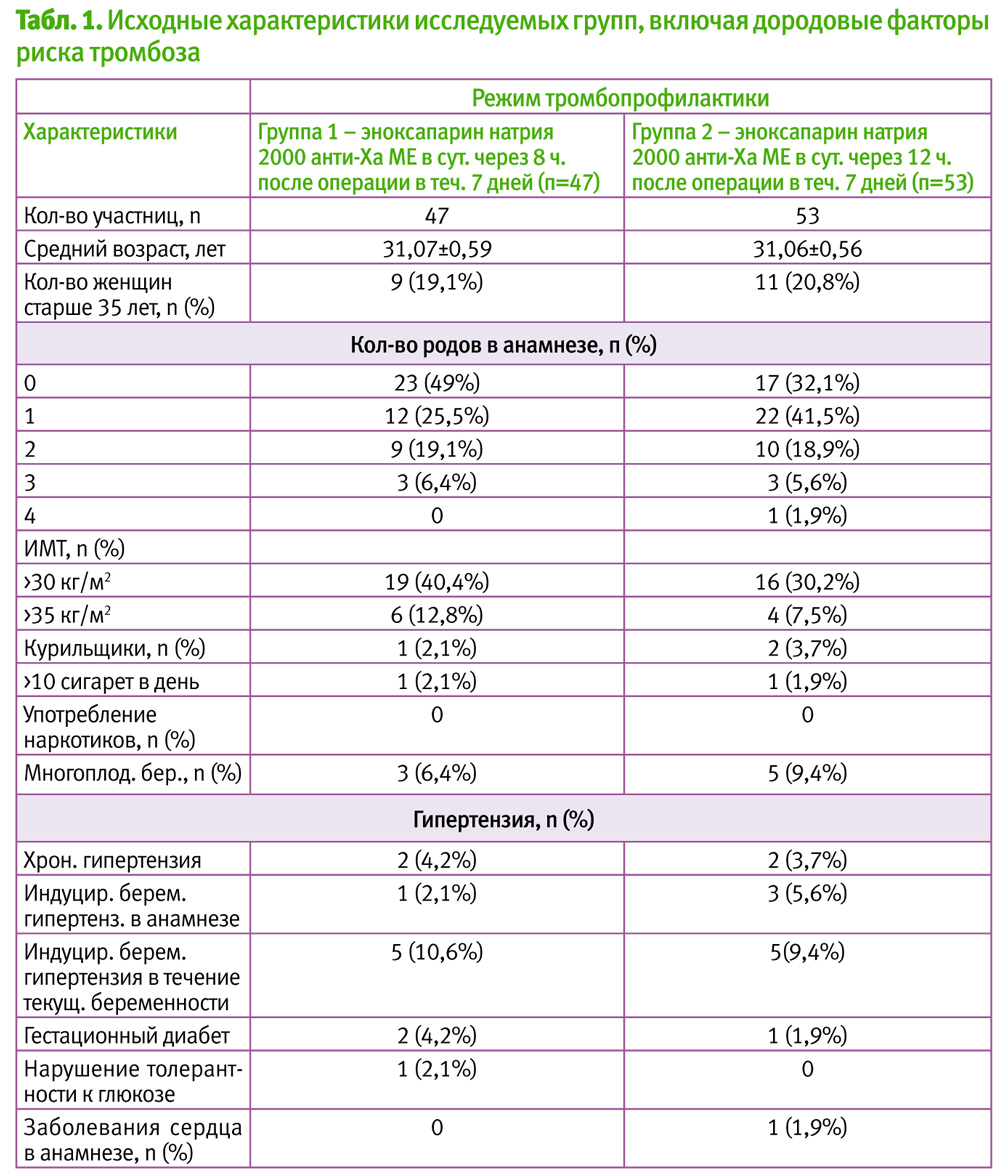
В таблице 1 приведены характеристики женщин, которые были включены в исследование с наличием у них факторов риска во время беременности. Средний возраст составил 31,07±0,59. У 67% женщин были 1 роды, у 12% – 3 роды и у 1,9% – 4 роды в анамнезе.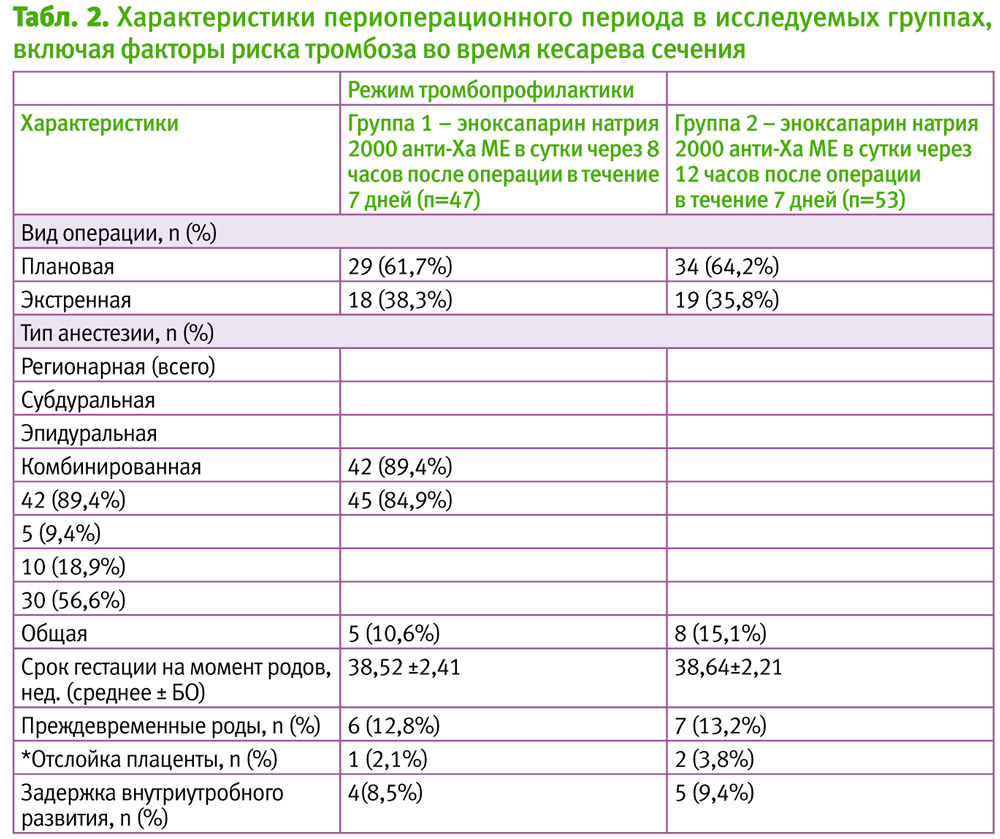
Многоплодная беременность была зарегистрирована у 15,8% женщин. ИМТ >30 кг/м – у 70,6%. Частота таких факторов риска как хроническая гипертензия и гипертензия в анамнезе, были незначительны (7,9% и 7,7%).
В табл. 2 приведены характеристики родов и сопутствующие им факторы риска тромбоэмболических осложнений. 26% родов были преждевременными. При этом 37,1% вмешательств были экстренными, что само по себе является дополнительным фактором риска. Основная часть пациенток (87,2%) получала региональное анестезиологическое обеспечение. Задержка внутриутробного развития была диагностирована у 9% пациентов, дополнительным риском также послужила отслойка плаценты (3%). На протяжении всего исследования не было зарегистрировано ни одного ТГВ или ТЭЛА.
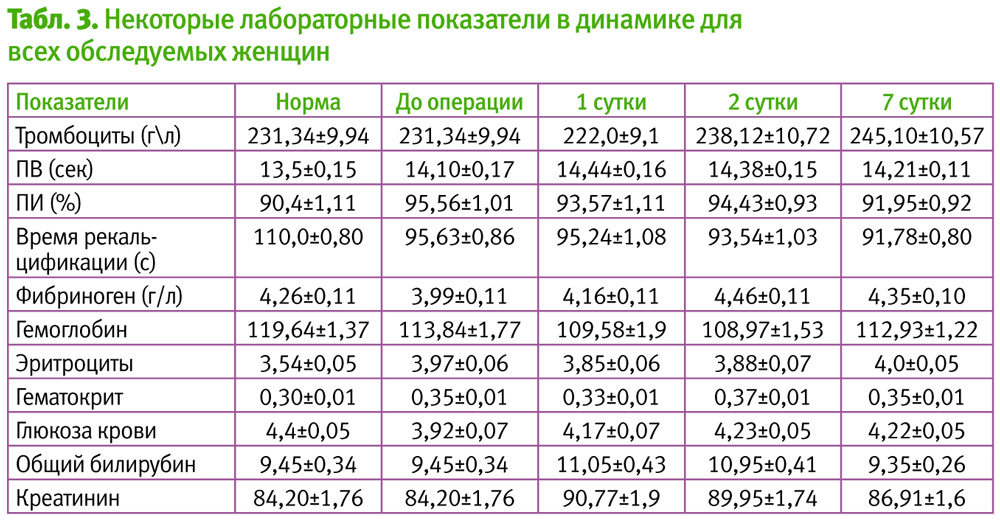
Анализ лабораторных показателей не выявил достоверной разницы между пациентками 1 и 2 групы, таким образом в таблице приведены сводные данных всех пациентов. На 1 сутки после операции на фоне ТПФ эноксапарином натрия (Фленокс) система сосудисто-тромбоцитарного (количество тромбоцитов) гемостаза достоверно не отличалась от нормы (р<0,05).
В то же время, внешний (ПВ, ПИ), внутренний (время рекальцификации) и общий (фибриноген) пути коагуляции находились в пределах нормы (р<0,05). На 2 сутки после операции количество тромбоцитов всего лишь на 3% (р>0,05) превышало дооперационные значения. Показатели ПВ и ПИ соответствовали дооперационному этапу и 1 суткам послеоперационного периода.
Уровень фибриногена на 11,8% (р<0,05) превышал дооперационный или на 7,2% (р>0,05) предыдущий этап. На 7 сутки послеоперационного периода количество тромбоцитов недостоверно превышало дооперационный этап (на 6%, р>0,05).
Показатели внешнего, внутреннего путем коагуляции оставались в пределах дооперационных данных. В то же время уровень фибриногена на 9% (р<0,05) превышал дооперационный этап, но на 2,5% (р>0,05) был ниже предыдущих показателей, т. е. достоверно не отличаясь от 2 суток послеоперационного периода.
Обсуждение
В нашем учереждении к профилактическим мерам тромбопрофилактики относятся: рекомендации относительно физ. упражнений для ранней мобилизации нижних конечностей и раннее вставание (в теч. 2 ч. после вагинальных родов и через 6 ч. после КС); обеспечение адекватной гидратации в п/р периоде с помощью раннего начала приема жидкости и пищи (сразу после вагинальных родов, через 4–6 ч. после КС с локально-регионарной анестезией и через 6–8 ч. после КС под общим наркозом), и при необходимости с помощью инфузионной терапии; тромбопрофилактика эноксапарином натрия (Фленокс) 2000 анти-Ха МЕ, 0,2 мл (начинается не позднее, чем через 8 ч. после КС).
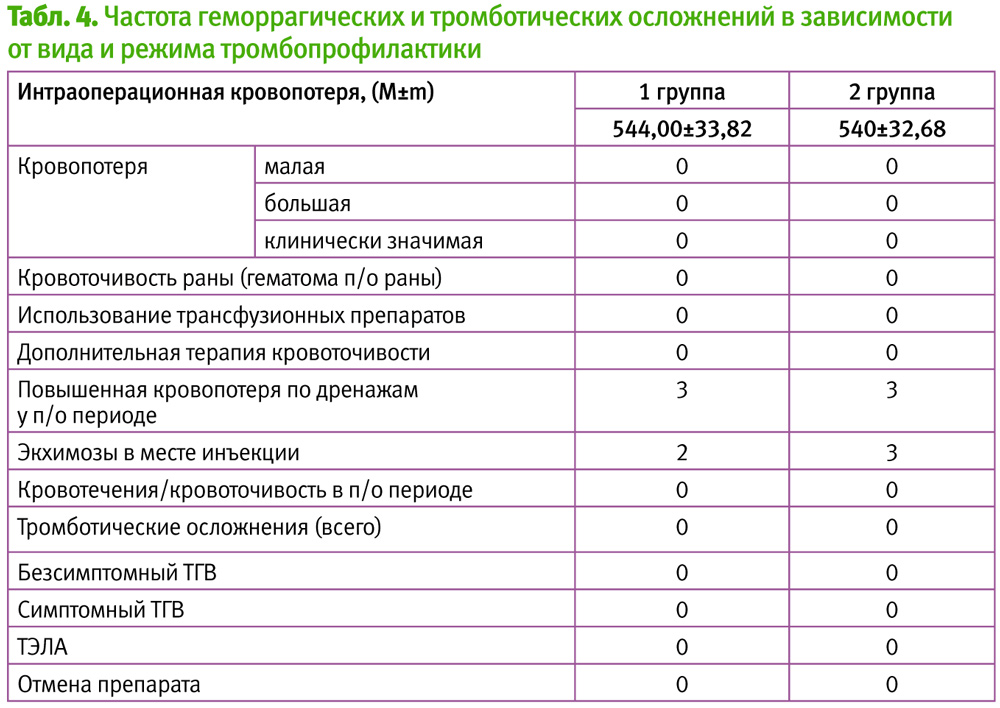
Анализ показал, что среднее время оперативного вмешательства составляло 0,68±0,05 ч., при этом объем кровопотери составил 544,00±33,82 мл и 540,00±31,68 мл (для 1 и 2 групп), обьем инфузионной терапии за время оперативного вмешательства – 1566,02±87 мл. Применение ТПФ эноксапарином натрия (Фленокс) независимо от начала послеоперационного старта не привело к исключению пациентов из данного исследования.
Легкий экхимоз в месте инъекции препарата был выявлен у 2 пациенток 1 группы и 3 пациентов 2 группы. Ни одного случая гематомы в области послеоперационного рубца больше 25 см в обеих исследуемых группах. Не было выявлено ни одного случая тромбоцитопении либо позднего послеоперационного кровотечения. Кровоточивость по дренажам в раннем послеоперационном периоде отмечалась у 3 пациенток 1 групы и 3 пациенток групы, что однако, не привело к отмене данного препарата и не потребовало применения дополнительных гемостатических средств.
Это подтверждалось показателями гемостаза на фоне применения эноксапарина натрия (Фленокс). На 1, 2 сут. после операции мы отмечали стабильность сосудисто-тромбоцитарного гемостаза, внешнего и внутреннего путей коагуляции, и только на 2 сут. после операции отмечена активация общего пути свертывания (фибриноген). Вместе с тем, на 7 сут. мы не увидели достоверных отличий от предыдущего этапа, что свидетельствовало о гемостазиологическом балансе, на фоне п/о старта тромбопрофилактики эноксапарином натрия (Фленокс).
Выводы
- Тромбопрофилактика эноксапарином натрия (Фленокс) в дозе 2000 анти-Ха МЕ (0,2 мл) в режиме послеоперационного старта не нарушает гемостазиологический баланс до 7 сут. послеоперационного наблюдения.
- В условиях КС на фоне тромбопрофилактики эноксапарином натрия (Фленокс) (2000 анти-Ха МЕ/0,2 мл) в п/о старте (через 8 и 12 ч.) мы не увидели достоверных отличий в частоте возникновения тромбо-геморрагических осложнений, что подтверждалось минимизацией геморрагических и отсутствием тромботических осложнений в п/о периоде.
- Послеоперационный старт тромбопрофилактики эноксапарином натрия (Фленокс) в дозе 2000 анти-Ха МЕ, 0,2 мл (через 12 ч. п/о) показал свою эффективность и безопасность, на основании данных гемостаза и частоты возникновения тромботических и геморрагических осложнений.
- Учитывая, что стандартная коагулограмма не затрагивает всех звеньев коагуляции, для полноценного анализа гемостазиологичсекой картины рекомендовано исследовать фибринолитическую систему и посткоагуляционную фазу коагуляции.


коментарів