Повышение активности трансаминаз возможно и при развитии синдрома холестаза. Холестаз обусловлен как нарушением желчевыделительной функции гепатоцитов и поражением желчных канальцев (внутрипеченочный холестаз), так и нарушением оттока желчи по печеночным и общему желчному протокам в результате их обтурации (внепеченочный холестаз), т. е. связан с развитием патологического процесса на каком-то участке желчного тока – от гепатоцита до Фатерова соска.
Желчь представляет собой изосоматический электролитный раствор, в состав которого входят: желчные кислоты (67%), фосфолипиды (22%), белки (4,5%), холестерол (4%), билирубин (0,3%).
Образование желчи представляет собой сложный биохимический процесс, происходящий в печени и состоящий из нескольких этапов. Вначале происходит захват компонентов желчи, прежде всего, желчных кислот, других органических и неорганических соединений из крови, далее происходит перенос их сначала внутрь гепатоцита, а затем – в просвет желчного капилляра. При холестазе наблюдаются уменьшение канальцевого тока желчи, печеночной экскреции воды и/или органических анионов (билирубина, желчных кислот), накопление желчи в гепатоцитах и желчевыводящих путях, задержка компонентов желчи в крови (желчных кислот, липидов, билирубина).
По проявлению холестаз можно разделить на вне- и внутрипеченочный, острый и хронический, желтушный и безжелтушный.
Повышенная концентрация желчи вызывает печеночные и системные повреждения, обусловленные повреждающим действием токсичных желчных кислот.
Желчные кислоты – монокарбоновые гидроксикислоты из класса стероидов, производные холановой кислоты. Основными типами желчных кислот, циркулирующими в организме человека, являются так называемые первичные и вторичные желчные кислоты.
Первичные кислоты – холевая и хенодезоксихолевая – синтезируются печенью.
Вторичные кислоты образуются из первичных желчных кислот в толстой кишке под действием кишечной микрофлоры: дезоксихолевая, аллохолевая. Урсодезоксихолевая кислота – третичная желчная кислота, которая также образуется под действием ферментов микроорганизмов. Из вторичных кислот в кишечно-печеночной циркуляции в заметном количестве участвует только дезоксихолевая кислота, всасываемая в кровь и секретируемая затем печенью в составе желчи.
В желчном пузыре человека желчные кислоты находятся в виде конъюгатов холевой, дезоксихолевой и хенодезоксихолевой кислот с глицином и таурином: гликохолевой, гликодезоксихолевой, гликохенодезоксихолевой, таурохолевой, тауродезоксихолевой и таурохенодезоксихолевой кислот – соединений, называемыми также парными кислотами.
У здорового человека при наличии желчного пузыря синтезированные в гепатоцитах первичные желчные кислоты экскретируются в желчь конъюгированными и по желчевыводящим путям поступают в желчный пузырь, где и накапливаются. В стенках желчного пузыря происходит всасывание незначительного количества желчных кислот (примерно 1,3%). В норме основная часть желчных кислот находится в желчном пузыре и только после стимуляции пищей рефлекторно происходит сокращение желчного пузыря и желчные кислоты поступают в двенадцатиперстную кишку.
Из кишечника желчные кислоты с током портальной крови вновь попадают в печень, которая абсорбирует из портальной крови практически все желчные кислоты (до 99%); совсем небольшое количество (около 1%) попадает в периферическую кровь.
Гиперпродукция вторичных кислот вызывает повреждение мембран митохондрий гепатоцитов, блокаду синтеза АТФ в клетке, повышение внутриклеточной концентрации кальция, стимуляцию кальцийзависимых гидролаз, повреждающих цитоскелет гепатоцита. 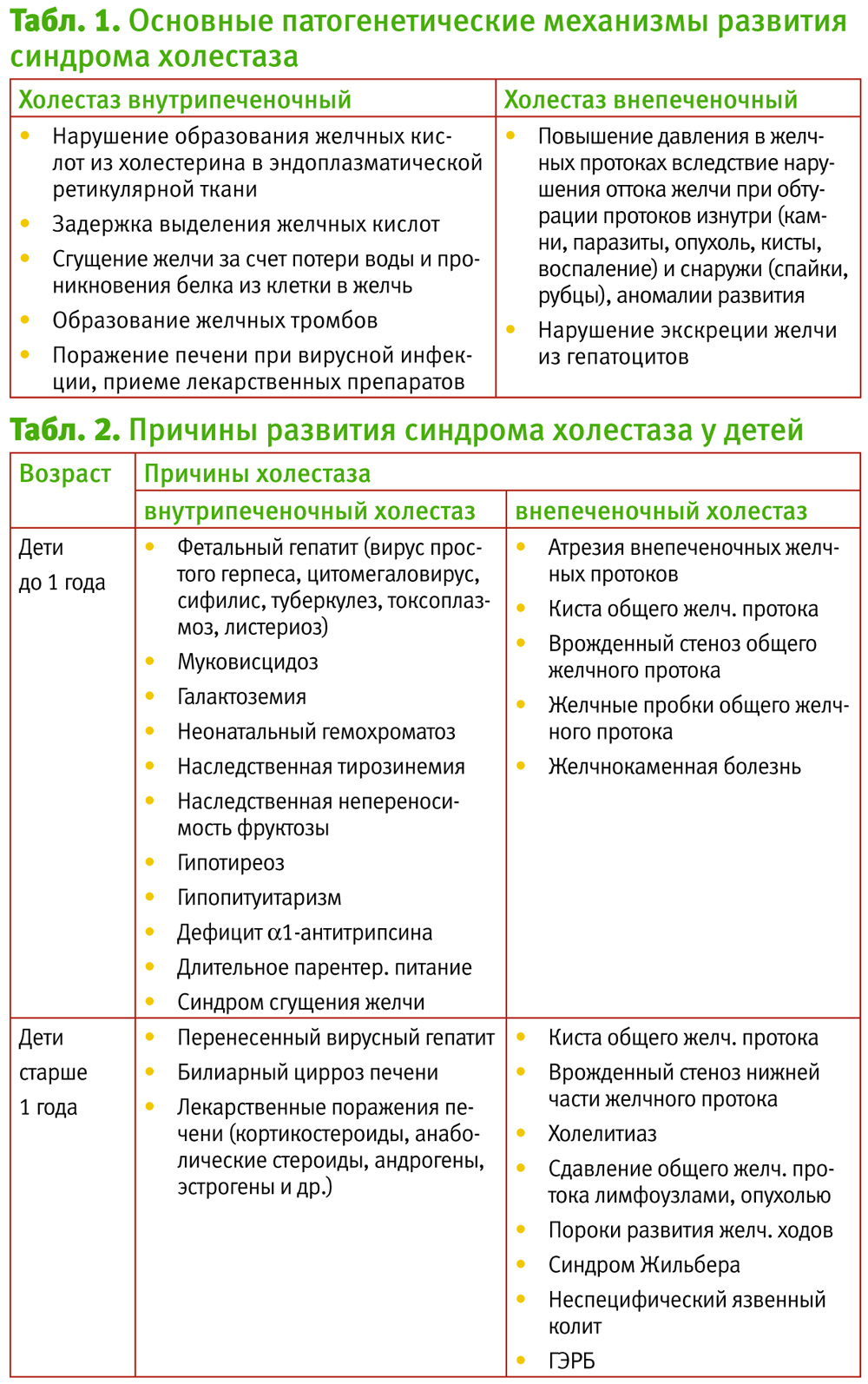
С токсическим влиянием желчных кислот связывают также апоптоз гепатоцитов. Этот механизм характеризуется повышением внутриклеточной концентрации магния с последующей активацией магнийзависимых трипсиноподобных ядерных протеаз-эндонуклеаз и деградацией ДНК гепатоцита.
Существует также альтернативный, отсутствующий в норме, механизм развития апоптоза, связанный с экспрессией антигенов HLA I класса на гепатоцитах и HLA II класса на эпителиальных клетках желчных протоков, что может способствовать развитию аутоиммунных реакций против гепатоцитов и желчных протоков.
Повреждение гепатоцитов уменьшается за счет перемещения канальцевых белков-переносчиков желчных кислот в синусоидальную мембрану, в результате чего меняются полярность гепатоцита и направленность транспорта желчных кислот, предотвращается накопление желчных кислот в цитоплазме.
Основные причины развития синдрома холестаза у детей представлены в таблице 2.
Для обеих форм холестаза характерны следующие биохимические изменения: повышение активности щелочной фосфатазы (ЩФ), гамма-глутамилтрансферазы (ГГТ) и некоторых других ферментов (лейцинаминопептидазы, 5-нуклеотидазы и др.), а также гиперхолестеринемия, нередко в сочетании с повышением уровней фосфолипидов, b-липопротеидов, желчных кислот и гипербилирубинемия (преимущественно за счет повышения прямого билирубина).
Щелочная фосфатаза катализирует отщепление фосфорной кислоты от ее органических соединений. Фермент локализован на клеточной мембране и принимает участие в транспорте фосфора. Изоферменты ЩФ обнаружены в стенках желчных протоков (внутри- и внепеченочных), внепеченочно – в остеобластах, в слизистой оболочке кишечника, в плаценте и лактирующей молочной железе. Так как в клинической практике определяется суммарная активность ЩФ, а не ее изоферментов, то высокие концентрации не всегда свидетельствуют о повреждении печени. Печеночный генез повышения уровня ЩФ диагностируется при сочетании ее высоких концентраций одновременно с другими маркерами холестаза (ГГТ, лейцинаминопептидазой и др.). Причинами повышения «печеночной» ЩФ является холестаз любой этиологии и локализации: внутрипечёночный холестаз при гепатите и циррозе, внепеченочный – в случае развития механической желтухи, алкогольной болезни печени, холестатических лекарственных повреждений печени (тетрациклином, парацетамолом, фенацетином, 6-меркаптопурином, салицилатами и др.). Резкое повышение ЩФ в некоторых случаях является онкомаркером (наблюдается у 90% больных первичной гепатоцеллюлярной карциномой и при метастазах в печень). При нормальном уровне ЩФ наличие холестаза сомнительно. Щелочная фосфатаза в костной ткани продуцируется остеобластами в местах интенсивного формирования кости (у детей уровень щелочной фосфатазы выше до периода полового созревания) или повышенной резорбции (у женщин в постменопаузе). Увеличение активности костной фракции ЩФ сопровождает заживление переломов, рахит, болезнь Гоше, костные изменения, связанные с гиперпаратиреозом, при остеогенной саркоме, метастазах рака в кости, миеломной болезни, лимфогранулематозе с поражением костей. Причиной повышения ЩФ за счет кишечной фракции могут являться язвенный колит, болезнь Крона, опухоли кишечника.
При обнаружении высоких уровней ЩФ показано одновременное определение концентраций ГГТ, АлАТ и АсАТ, уровень общего билирубина и его фракций.
Показано также проведение УЗИ органов брюшной полости.
УЗИ имеет низкую информативность в отношении определения стадии поражения печени и характера морфологических изменений, однако позволяет выявить признаки портальной гипертензии, косвенно подтверждающие цирроз печени, или нарушения проходимости желчевыводящих путей, т. к. гепатомегалия – признак внепеченочной обструкции. Более высокую информативность имеет КТ/МРТ органов брюшной полости.
Гамма-глутамилтрансфераза – микросомальный фермент, участвующий в обмене аминокислот. Наибольшая активность отмечается в почках (в 7000 раз выше, чем в сыворотке), печени (в 200–500 раз выше, чем в сыворотке) и поджелудочной железе. Незначительная активность ГГТ определяется в кишечнике, мозге, сердце, селезенке, простате.
Несмотря на то, что активность фермента наиболее высока в почках, источник сывороточной активности ГГТ – преимущественно гепатобилиарная система, и увеличение значений ГГТ в сыворотке – наиболее чувствительный лабораторный показатель при заболеваниях гепатобилиарной системы (маркер холестаза в совокупности с другими маркерами).
Активность ГГТ сыворотки возрастает при всех формах заболеваний печени. Она наиболее высока в случае развития обструктивных поражений печени (внутри- или подпеченочном холестазе), достигая повышения в 5–30 раз от нормальных значений. В связи с тем, что ГГT содержится в микросомах гепатоцитов, лекарственные препараты из группы индукторов микросомального окисления могут стимулировать ее активность. К индукторам микросомальных ферментов печени относятся снотворные средства (барбитураты, хлоралгидрат), транквилизаторы (диазепам, хлордиазепоксид, мепробамат), нейролептики (хлорпромазин, трифлуоперазин), противосудорожные (фенитоин), противовоспалительные (фенилбутазон), некоторые антибиотики (рифампицин), диуретики (спиронолактон) и др. лекарственные средства.
При алкогольной болезни печени ГГТ повышается более значительно, чем другие показатели повреждения печени. При острых и хронических панкреатитах, а также в случаях злокачественных заболеваний поджелудочной железы активность ГГТ может превышать норму в 5–15 раз. Для диагностики холестаза необходимо обязательно параллельно определять ЩФ и ГГТ. Изолированное повышение ГГТ (без ЩФ) может наблюдаться на начальных этапах токсического повреждения печени, при гипоксическом повреждении печени (оксидативный стресс при диабетическом кетоацидозе), при опухолях печени.
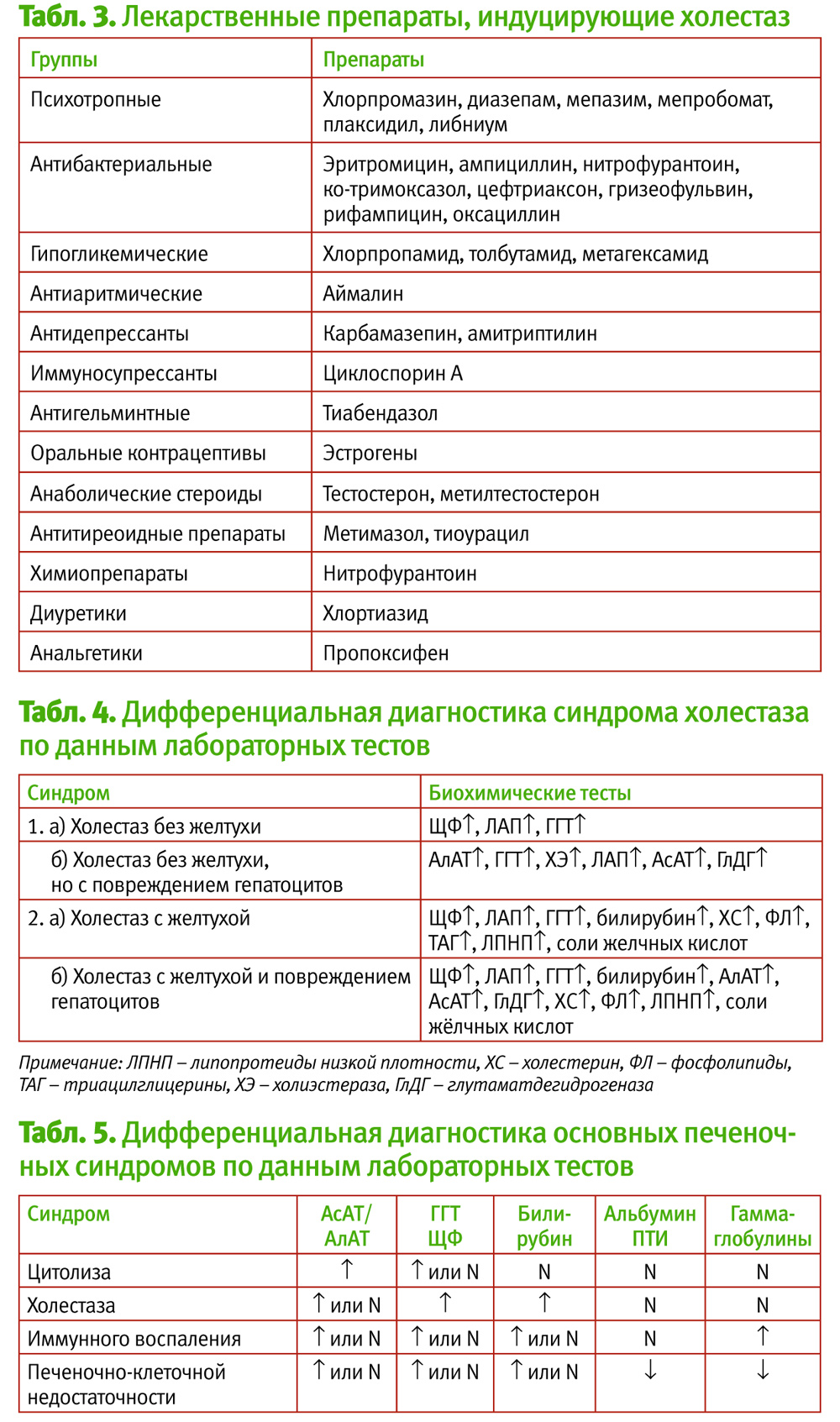
Лейцинаминопептидаза (ЛАП) отщепляет амидные группы от различных аминокислот. Самые высокие концентрации фермента выявляются в печени, почках, тонкой кишке. Уровень активности ЛАП в норме — 15–40 МЕ/л. Активность фермента у детей сопоставима с таковой у взрослых. Повышение активности в сыворотке крови отмечается при желтухе новорожденных вследствие повреждения гепатоцитов, при циррозе, новообразованиях печени болезнях поджелудочной железы и всех формах внутри- и внепеченочного холестаза.
ЛАП имеет примерно такое же клиническое значение, как и щелочная фосфатаза. Однако активность ЛАП при заболеваниях костной ткани практически не меняется. Поэтому определение ЛАП используется для дифференциальной диагностики заболеваний гепатобилиарной системы и костной ткани, когда повышена активность щелочной фосфатазы. ЛАП повышается при механической желтухе, при метастазах в печень, даже в отсутствие желтухи, тогда как при других заболеваниях печени, например, при гепатите и циррозе, ее активность повышается в значительно меньшей степени.
Активность ЛАП возрастает при острых панкреатитах и холециститах, у больных инфекционным мононуклеозом, лимфогранулематозом, саркоидозом. Повышение активности ЛАП при этих заболеваниях обусловлено холестатическим компонентом в процессе их развития.
Активность ЛАП возрастает в поздних стадиях беременности, что связано с появлением в сыворотке крови плацентарной формы фермента.
При острых вирусных гепатитах активность ЛАП повышается у 80% больных, что снижает ценность определения фермента в дифференциальной диагностике желтух.
Холестерин может рассматриваться как маркер холестаза только при его одновременном повышении с другими маркерами (билирубин, ЩФ, ГГТ и др.). Изолированное повышение холестерина имеет другие причины и не свидетельствует о холестазе.
Наряду с синдромом цитолиза у пациентов с поражением печени различной этиологии отмечается развитие синдрома печеночно-клеточной недостаточности, который представляет собой группу биохимических признаков, свидетельствующих о значительном снижении различных функций печени, в первую очередь синтетической. Для данного синдрома характерны биохимические изменения в виде гипоальбуминемии, снижения активности холинэстеразы в плазме крови, снижения концентрации холестерина, протромбина, фибриногена, гипербилирубинемии (преимущественно за счет увеличения свободной фракции), снижения уровней II, V, VII факторов свертывания крови, повышения в крови печеночно-специфических ферментов – фруктозо-1-фосфатальдолазы, сорбитолдегидрогеназы, орнитинкарбамил-трансферазы и др.
Морфологическим субстратом синдрома печеночно-клеточной недостаточности являются выраженные дистрофические изменения гепатоцитов и/или значительное уменьшение функционирующей паренхимы печени в результате ее некротических изменений.
Развитие синдрома печеночно-клеточной недостаточности сопровождается повышением в крови печеночно-специфических ферментов – глутаматдегидрогеназы, фруктозо-1-фосфатальдолазы, сорбитолдегидрогеназы, орнитинкарбамилтрансферазы и др. и снижением активности холинэстеразы в плазме крови.
Глутаматдегидрогеназа (ГлДГ) в норме присутствует в крови в небольших количествах, так как является митохондриальным ферментом, то есть, он расположен внутриклеточно. Степень увеличения активности данного фермента определяет глубину поражения печени.
Увеличение концентрации ГлДГ в крови является признаком начала дистрофических процессов в печени, вызванных эндогенными или экзогенными факторами. К эндогенным факторам относят опухоли печени или метастазы в печень, а к экзогенным – токсины, повреждающие печень (тяжелые металлы, антибиотики и т. д.), и инфекционные заболевания. В случае выявления повышенной концентрации ГлДГ, АлАТ и АсАТ рассчитывается коэффициент Шмидта (КШ).
КШ = (АсАТ+АлАТ)/ГлДГ.
При обтурационной желтухе коэффициент Шмидта равен 5–15, при остром гепатите – более 30.
Сорбитолдегидрогеназа (СДГ) в норме в сыворотке крови выявляется в следовых количествах, а ее активность не превышает 0,4 Ед/л. Активность СДГ увеличивается в 10–30 раз при всех формах острого гепатита. Сорбитолдегидрогеназа является органоспецифическим ферментом, который отражает повреждение мембран гепатоцитов при первичном развитии острого процесса или при обострении хронического.
Фруктозо-1-фосфатальдолаза (Ф-1-ФА) является ферментом группы альдолаз, участвующих в процессах углеводного обмена (расщепляет фосфорилированные гесозы на триозы).
Подавляющее количество данного фермента представлено в ткани печени, поэтому фруктозо-1-фосфатальдолаза считается специфичным маркером повреждения печени. Ф-1-ФА в норме в крови содержится в следовых количествах (0–1 усл. ед).
Повышение активности Ф-1-ФА наблюдается исключительно при поражении печени различной этиологии: вирусном гепатите (повышение активности фермента отмечается в ранние сроки заболевания – в преджелтушный период), токсическом гепатите (отравления гепатотропными ядами – техническими жидкостями, суррогатами алкоголя, лекарствами и т. д.), хроническом гепатите в фазе обострения наследственных ферментопатиях. 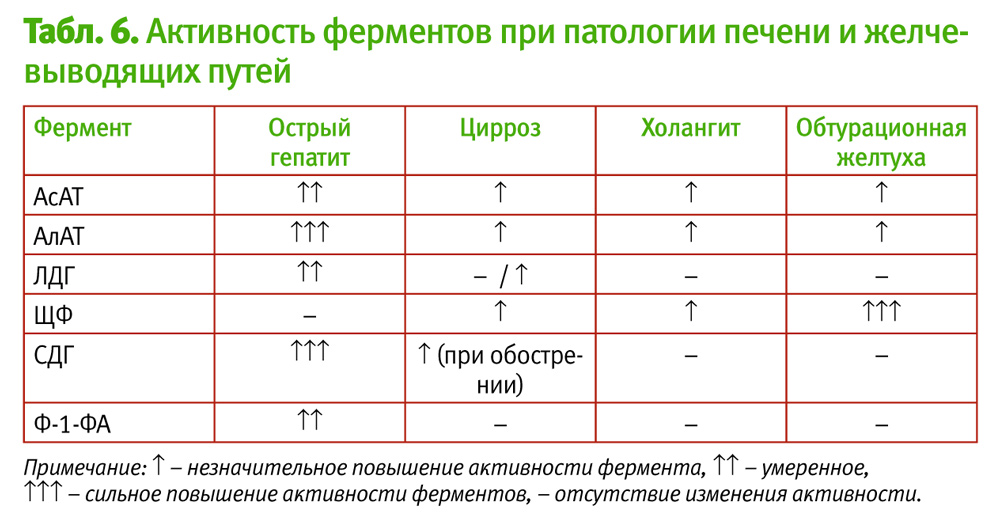
Повреждение печени и, как следствие, повышение активности фруктозо-1-фосфатальдолазы может быть вызвано приемом гепатотоксических лекарственных средств: антиаритмических (амиодарон), макролидов (эритромицин), пенициллинов (азлоциллин, мезлоциллин, пиперациллин), НПВП, антигипертензивных (ацебутолол, лабеталол, метопролол, метилдопа), антиконвульсантов (вальпроевая кислота и вальпроаты, карбамазепин), антитиреоидных (тиамазол), гормональных (анаболические стероиды – метандростенолон, нандролон, тестостерон; пероральные контрацептивы, эстрогены), препаратов золота (ауранофин), цитостатиков (аспарагиназа, даунорубицин, кармустин, меркаптопурин, метотрексат, этопозид, идарубицин, сарграмостим, сульфонилмочевина и др.), средств для наркоза, противотуберкулезных (изониазид, рифампицин, этамбутол), противогрибковых (кетоконазол, итраконазол, флуконазол) и др. препаратов.
Холинэстераза – гидролитический фермент, расщепляющий эфиры холина непосредственно на холин и кислотные компоненты.
В тканях человека встречаются 2 вида фермента: ацетилхолинэстераза («истинная» холинэстераза), которая преимущественно находится в нервной ткани, скелетных мышцах и в низкой концентрации в эритроцитах, и сывороточная, которая находится в печени, поджелудочной железе, секретируется печенью в кровь. Сывороточная холинэстераза является ферментом, катализирующим реакцию гидролиза ацетилхолина. Определение активности сывороточной холинэстеразы представляет наибольший интерес для диагностики токсических поражений печени, а также как показатель состояния белково-синтетической функции печени и для оценки риска при применении миорелаксантов в хирургической практике. Понижение активности холинэстеразы в сыворотке сопровождается, как правило, снижением концентрации альбумина и ростом активности трансаминаз. Восстановление активности фермента свидетельствует о нормализации функции печени.
В клинической практике одним из основных аспектов диагностики повреждения печени является выявление нарушения обмена билирубина, т. к. нарушение пигментного обмена и интерпретация данных лежит в основе дифдиагностики одного из самых частых проявлений заболеваний печени – желтухи. Оценка характера нарушений пигментного обмена проводится по результатам исследования билирубина сыворотки крови и его метаболитов в моче и кале. При паренхиматозной желтухе в крови увеличено содержание как свободного (непрямого), так и связанного (прямого) билирубина. Последний, являясь хорошо растворимым в воде соединением, легко проходит почечный фильтр и появляется в моче, обуславливая ее темно-коричневую окраску. В моче также в больших количествах присутствует уробилиноген или его окисленная форма уробилин. В кале содержание стеркобилина может быть несколько уменьшено в связи с нарушением выделения гепатоцитами желчи.
Механическая желтуха развивается при обтурации внепеченочных желчевыводящих путей или сдавлении общего желчного протока извне, в результате чего блокируется выделение желчи в кишечник и, соответственно, не образуется уробилиноген и стеркобилиноген. В связи с этим уробилин в моче и стеркобилин в кале полностью отсутствуют (ахоличный кал). В крови значительно нарастает уровень связанного (прямого) билирубина, в моче появляется большое количество связанного билирубина и моча приобретает темно-коричневый цвет («цвет крепко заваренного чая»).
При гемолитической желтухе происходит образование в клетках ретикулоэндотелиальной системы большого количества свободного (непрямого) билирубина, который полностью не метаболизирован в печени. В результате в крови увеличивается содержание свободного (непрямого) билирубина, в моче значительно повышен уровень уробилина. Причиной повышения в крови непрямого билирубина также могут стать так называемые «пигментные гепатозы» (синдромы Жильбера и Криглера-Найяра), в основе которых лежат генетические дефекты нарушения захвата билирубина гепатоцитами, а также снижение активности или отсутствие глюкуронилтрансферазы в гепатоците.
Изолированное повышение в крови прямого билирубина и, как следствие, темно-коричневая окраска мочи и осветление кала, могут наблюдаться при синдромах Дабина–Джонсона и Ротора, наследственных пигментных гепатозах, при которых генетический дефект затрагивает механизмы выделения связанного билирубина из гепатоцитов в желчь.
Таким образом, клинико-лабораторная диагностика поражения печени часто представляет собой довольно сложный и многогранный процесс, одной из составляющих которого является определение активности печеночных ферментов. Энзимодиагностика в современных лабораториях позволяет оценить поражение печени и провести дифференциальную диагностику по показателям активности многих ферментов, а высокая чувствительность энзимодиагностики является залогом правильной интерпретации данных и своевременного назначения эффективной терапии.

коментарів