Благодаря достижениям микробиологии, в XIX веке у человечества возникла надежда раз и навсегда победить бактериальные инфекции. Открытие антибиотиков и успехи вакцинопрофилактики превратили эту надежду в твердую уверенность в том, что многие инфекционные заболевания скоро будут ликвидированы навсегда. И действительно, в середине ХХ века, когда пара инъекций пенициллина вылечивала разлитую пневмонию, а несколько инъекций стрептомицина — тяжелые формы туберкулеза, в это трудно было не поверить. Скорая победа над инфекциями грезилась медицинскому сообществу такой же неотвратимой, как торжество коммунизма во всем мире
И все же природа устроена не так просто, как нам хотелось бы...
Микробные сообщества, как сложные системы, подчиняются принципу Ле Шателье–Брауна (Le Chatelier-Braun principle), обобщенная формулировка которого гласит: «Если систему дестабилизировать извне, то система ответит такими процессам и, которые ослабят влияние произведенного воздействия». Иными словами, микробы найдут способ выжить. Благодаря этому свойству сложных систем на арену борьбы с медицинскими достижениями вышла антибиотикорезистентность — явление, которое постепенно становится могильщиком триумфального «золотого века» противоинфекционной терапии. У химиотерапии начинаются суровые трудовые будни.
В настоящем обзоре мы сосредоточимся на новых, еще не известных широкому медицинскому сообществу механизмах формирования устойчивости микробов к препаратам. Такие виды антибиотикорезистентности формируются внутри особых форм микробных сообществ — биопленок*.
По правилам республики
Поведение единичных микробных клеток подчиняется двум стратегическим принципам. 1. Микробы концентрируются в местах с оптимальными для них условиями (отсутствие повреждающих факторов, наличие питательных веществ, подходящая температура и атмосфера). 2. Микробы стремятся к самовоспроизводству или размножению.
Однако, как только количество микроорганизмов увеличивается и их концентрация достигает некой критической плотности, у сообщества появляются качественно новые черты. Обостряется конкуренция, в результате функциональной дифференцировки возникает специализация — отдельные клетки могут изменять свое поведение в интересах других микробов, обитающих по соседству.
Таким образом, «повадки» патогенных микроорганизмов, находящихся внутри локализованных скоплений, принципиально отличаются от поведения аналогичных единичных микробов. Внутри возникающей системы могут наблюдаться взаимно противоречивые явления: в территориально ограниченном пространстве прекрасно «уживаются» конкуренция и альтруизм, специализация со снижением фертильности и стремлением размножаться. Это логично, потому что оптимальное энергетическое состояние динамической системы может формироваться только в условиях существования взаимно противоположных процессов, уравновешивающих друг друга. Динамический хаос, наблюдаемый в подобных системах, — необходимое условие для возникновения упорядоченных структур. И новая структура возникает! Микробы организуются в единую архитектурную композицию, которая получила название «биопленка».
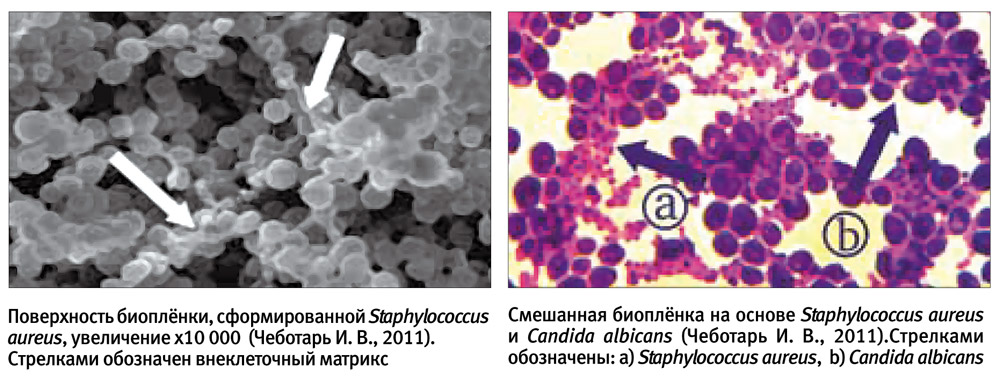
Микробная биопленка — надклеточная система, состоящая из микробных клеток и ассоциированного с ними внеклеточного полимерного матрикса, которая локализуется на какой-либо поверхности. Жизнь в микробных сообществах настолько сложна, что применительно к ним стали использовать термины «социальная жизнь микробов», «бактериальные города», «микробные республики», «микробный социум» и т. д. Внутри микробных коллективов происходит много удивительных процессов самоорганизации, важнейший из которых — «общение» клеток между собой при помощи особых сигнальных молекул. Эта система межклеточной коммуникации получила название «кворум сенсинг» (quorum sensing). В результате клетки обретают согласованное поведение, в управлении которым участвуют все члены микробного сообщества. Мы наблюдаем поистине демократическое «общество». И тем печальнее для нас тот факт, что такие «демократические республики» часто занимают территории внутри человеческого организма, нанося существенный ущерб здоровью. Ответная реакция современного человека включает не только атаку биопленок силами иммунной системы, но и противобиопленочную агрессию с применением «средств массового поражения» — антибактериальных средств. Отдельно следует отметить и то, что способностью к формированию биопленок обладают не только бактерии, но и грибы. Например, на долю Candida albicans приходится не менее 10% септицемий — весьма опасного состояния, причина которого также, скорее всего, кроется в чрезвычайно высокой резистентности биопленки к противогрибковым препаратам.
Человек хочет полностью уничтожить патогенное начало. Но «республика» имеет выработанный в ходе эволюции набор инструментов, позволяющий защититься от внешней «тирании».
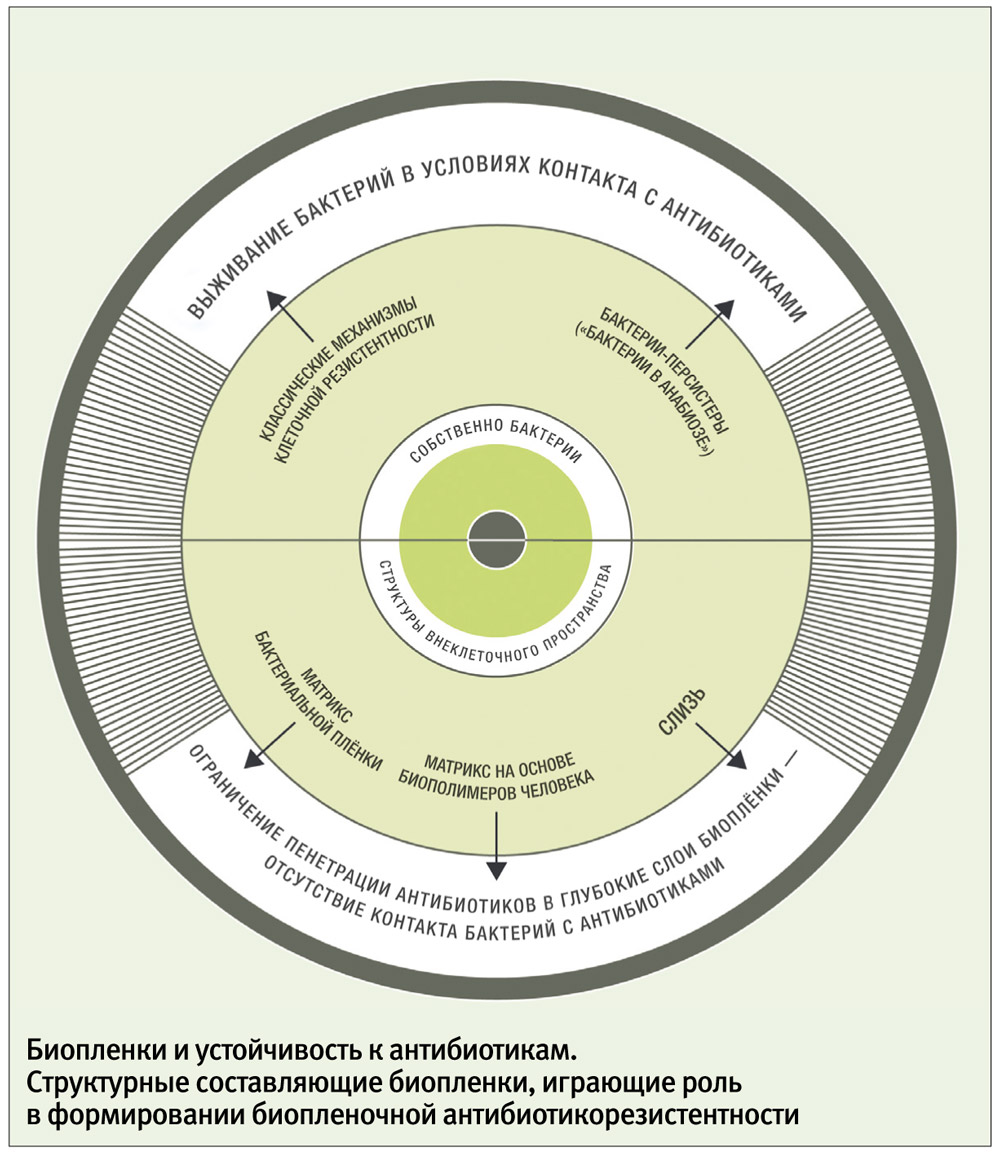
Три аспекта устойчивости
Наиболее важной для практической медицины характеристикой биопленок признана их уникальная устойчивость к антимикробной терапии. Основатели учения о биопленках доктор Уильям Костертон (William Costerton) и доктор Родни Донлан (Rodney Donlan) считают, что биопленочные микробы могут выживать в условиях обработки антибиотиками, концентрации которых превышают терапевтические в десятки и сотни раз. Иными словами, в рганизме пациента концентрации антибиотиков, которые способны уничтожить некоторые биопленочные микробы, недостижимы!
Как же формируется биопленочная антибиотикорезистентность?
Для обособленных (небиопленочных, или планктонных) микробных клеток классическими признаны пять типов устойчивости к антибиотикам: модификация мишени, инактивация антибиотика, активное выведение антибиотика из микробной клетки (эффлюкс), нарушение проницаемости внешних структур микробной клетки, формирование метаболического шунта. Накопленная научная информация позволяет утверждать, что у биопленочных клеток присутствуют почти все типы «планктонной» резистентности. Однако в биопленках существуют еще и особые, присущие только им формы устойчивости, которые могут быть связаны по крайней мере с тремя типами механизмов.
Во-первых, мультирезистентность, вероятно, обусловлена существованием в биопленках особых персистирующих форм бактерий, или персистеров. Персистер — это фенотипический вариант клеток с обычным для данного штамма генотипом, но с сильно заторможенным метаболизмом. Состояние метаболической инертности клеток с выключением многих биохимических процессов образно называют «бактериальным анабиозом». Персистеры существуют не только в биопленках. Во всех культурах, где преобладают замедленные типы деления клеток (а биопленка относится к таким культурам), относительное количество персистеров больше, чем среди быстро делящихся бактерий. В биопленках концентрация персистеров высока. Главная особенность персистирующих клеток — их удивительная способность к выживанию при воздействии антибактериальных агентов. Механизм такой устойчивости можно объяснить с позиций общей метаболической инертности клеточных структур. Известно, что антибиотики эффективнее действуют на быстро растущие и размножающиеся клетки. Механизм действия антибактериальных препаратов связан с угнетением жизненно важных для бактерий биохимических процессов. Клетки-персистеры не могут быть заблокированы этой группой лекарств, так как в них все метаболические пути перекрыты и без участия антибиотиков.
Во-вторых, антибиотикорезистентность может быть следствием фильтрующей способности внеклеточного матрикса. Матрикс не только связывает клетки в единую структуру, но и заполняет межклеточные пространства, образуя трехмерную фильтрующую систему. Это позволило назвать биопленку «молекулярным фильтром» и считать фильтрацию одной из важнейших функций биопленки. Опубликованы работы, в которых наблюдали замедленную диффузию антибиотиков внутрь биопленок, например, затруднение пенетрации ципрофлоксацина внутрь биопленки, сформированной P. aeruginosa.
Элементы матрикса выступают не только в роли пассивного фильтра. Глицерол-фосфорилированные в-глюканы, составляющие матрикс P. aeruginosa, не просто замедляют диффузию аминогликозидов (канамицина) сквозь биопленку, но и активно связывают антибиотик. Слизь, которая продуцируется некоторыми патогенами, заполняя межклеточное пространство в биопленках, также может обладать антибиотикосвязывающим действием. Слизистые полисахариды из биопленок Staphylococcus epidermidis снижали антибактериальный эффект ванкомицина и тейкопланина. Аналогичное подавление активности гликопептидов (ванкомицина, тейкопланина) и в-лактамов (амоксициллина, цефотаксима) было получено в опытах со слизью разных штаммов эпидермального и золотистого стафилококков, а слизь P. aeruginosa ингибировала активность тобрамицина.
Третий механизм множественной лекарственной устойчивости, вероятно, связан с тем, что внутри биопленки могут присутствовать популяции бактерий с разными защитными свойствами, дополняющими друг друга. Например, P. aeruginosa способны экзоцитировать везикулы, содержащие высокую концентрацию в-лактамазы, тем самым обеспечивая защиту своих лактамазодефицитных «сородичей» от специфических антибиотиков на расстоянии.
Наиболее сложные сочетания антибиотикорезистентности наблюдают в полимикробных биопленках. Сейчас доказан факт межвидовой передачи генов антибиотикорезистентности, которая успешнее реализуется в условиях тесного контакта бактерий внутри биопленки. Вероятно, такая генетическая кооперация и «взаимовыручка» внутри биопленки позволяют микробному сообществу более рационально использовать свои ресурсы и гибко реагировать на повреждающие факторы, достигая при этом главной стратегической цели — выживания вида.
Анализируя проблему биопленочной антибиотикорезистентности, необходимо помнить, что биопленка — это живая, изменяющаяся и развивающаяся система, поэтому и резистентность нужно рассматривать как динамическое понятие.
Действительно, опубликованы работы, которые подтверждают, что возникновение и выраженность резистентности биопленочных бактерий зависят от многих параметров. К факторам, которые могут усиливать антибиотикорезистентность биопленочных бактерий, можно отнести недостаток кислорода (для P. aeruginosa), ограничение питательных веществ (для Klebsiella pneumoniae), микроокружение (для S. aureus) и, конечно же, сигналы межклеточной кооперации «кворум сенсинг».
Что делать, когда известно, кто виноват?
Итак, теоретические механизмы биопленочной устойчивости понятны. Но для практикующего врача один из важнейших вопросов заключается в том, как уничтожить биопленку. Все изложенное выше не означает, что все биопленки устойчивы ко всем антибиотикам! Антибиотикорезистентность — понятие, которое подразумевает конкретный антибиотик и конкретный микроорганизм. Важнейшим условием успешного противостояния микробным ассоциациям, как и в случае небиопленочных инфекций, считают правильный выбор эффективного противомикробного средства.
Медицинской науке известны примеры удачного выбора антибиотиков для ликвидации той или иной биопленки. Хороший пример такого препарата — фентиконазола нитрат. Для него характерна высокая эффективность в отношении кандидозных биопленок. Такую результативность исследователи продемонстрировали в опытах с клиническими изолятами C. albicans. Были исследованы 35 биопленкообразующих штаммов C. albicans, и все образованные ими биопленки были уничтожены терапевтическими дозами фентиконазола.
Стоит подчеркнуть, что система «биопленка—антибиотик» чрезвычайно сложна и многофакторна.
Конечно, эффект от воздействия антибиотика на биопленку зависит не только от типа антибиотика и видовой принадлежности бактерий, но и от их штаммовых особенностей, а также от возраста биопленки и ее локализации, то есть от параметров, которые могут определять химический состав и архитектуру матрикса. Из этого следует, что важная задача микробиологии состоит в том, чтобы предоставить клиницистам простой и надежный способ, позволяющий быстро выбрать антибиотик для ликвидации патологической биопленки.
Успехи в исследовании биопленок дают надежду, что эта задача будет решена в ближайшие годы.
Опубликовано с разрешения журнала Status Praesens, Москва.


коментариев