Результаты анализа демографических показателей за последние 15–20 лет свидетельствуют о том, что Украина находится в состоянии глубокого демографического кризиса. Особую значимость в свете этих данных имеет проблема невынашивания беременности: связанные с ней прямые репродуктивные потери каждый год составляют в Украине 36–40 тыс. неродившихся детей [1], что ставит исследования в данной области в ряд важнейших задач современной медицины
При невынашивании беремености в 85% случаев на разных сроках выявляется недостаточность лютеиновой фазы (НЛФ) [2], с учетом чего ведущей группой препаратов, применяющихся для подготовки к беременности и ее сохранения при НЛФ, являются препараты гормона желтого тела и его аналоги, что является патофизиологически обоснованным способом профилактики и коррекции cвязанных с дефицитом прогестерона состояний.
Жестким требованиям по эффективности и безопасности для матери и плода в наибольшей мере отвечают препараты натурального прогестерона [26].
Натуральный прогестерон синтезируется из диосгенина – стероида растительного происхождения, экстрагируемого из ямса (рода Diascorea), он полностью идентичен прогестерону, продуцируемому яичниками [27]. Причиной отличий натурального и синтетических гестагенов являются особенности их метаболизма: только препараты натурального прогестерона являются субстратами для восстановленных 5a- и 5b-метаболитов, оказывающих специфическое действие на миометрий, половую дифференцировку плода, кожу и клетки мозга [28].
Фармакокинетика прогестерона
Создание микронизированных форм прогестерона [29, 30], благодаря увеличению его биодоступности, расширило возможности введения препарата за счет создания новых лекарственных форм и новых путей его введения, каждый из которых имеет свои преимущества и недостатки.
Основным преимуществом прогестерона для применения внутрь является удобство применения, однако при этом в кровь абсорбируется всего 50–60% дозы вследствие метаболизма препарата из-за эффекта первого прохождения через печень. Биодоступность препарата зависит от приема пищи, различий в наполнении желудка, в кишечном кровообращении и пр., что в ряде случаев мешало созданию предсказуемых концентраций в сыворотке крови [31–36]. Не наблюдается также стабильного поддержания концентрации препарата в сыворотке: через 1 час после приема внутрь уровень прогестерона сыворотки составлял 4,2 нг/мл, через 2 час – 11,7 нг/мл, уже после 4 час – 8,4 нг/мл, снижаясь к 8 часу до 1,6 нг/мл [37]. Показатели сывороточного прогестерона после приема внутрь были ниже, чем после в/м или вагинального введения [38–39] (Табл. 1), причем, даже при хорошем уровне концентрации в сыворотке, в эндометрии она была не очень высокой [40].
К недостаткам энтерального приема препарата относят более высокую частоту таких побочых эффектов как сонливость, головокружение, тошнота и рвота, а также то, что прием прогестерона внутрь может быть затруднен при гастрите и других заболеваниях ЖКТ [34, 41] и невозможен при рвоте беременных во время токсикоза.
Преимуществом внутримышечного (в/м) введения прогестерона является высокая биодоступность. При сравнительном исследовании параметров фармакокинетики после в/м инъекции и при оральном применении было установлено, что в/м применение способствует более быстрому, выраженному и длительному, благодаря депо в жировой ткани, его накоплению в сыворотке крови (Табл. 1) [33]. Для создания эффективных концентраций требуются небольшие дозы препарата: концентрация гормона в сыворотке, наблюдавшаяся в лютеальной фазе, создается после инъекции 25 мг прогестерона [43]. 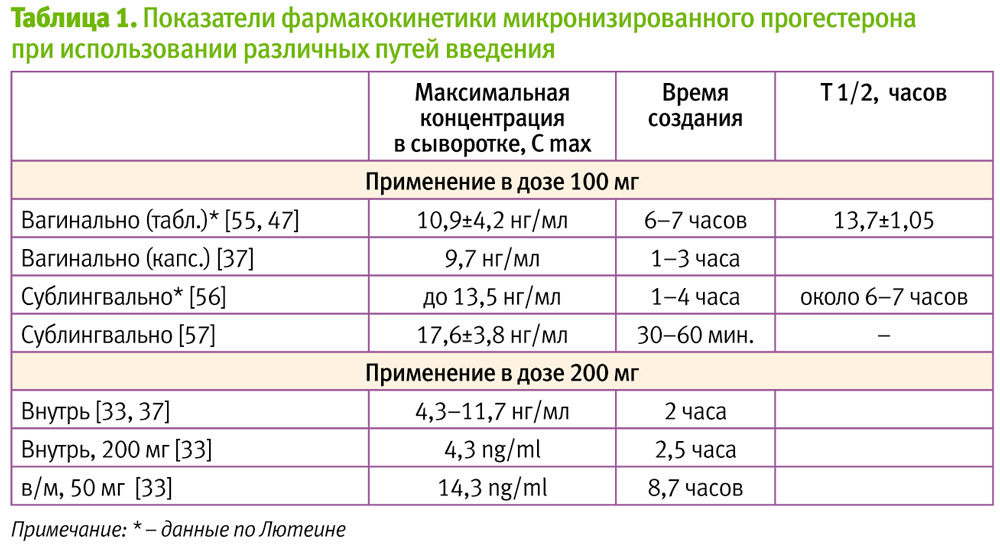
В то же время, применение препарата в/м неудобно (требуется помощь медперсонала) и ассоциируется с большим количеством побочных эффектов. Помимо системных, он оказывает также местные побочные эффекты: кровоизлияния в мышцу, боль в месте инъекции; масляные растворы могут способствовать также появлению олеогранулем, имеется болезненность в месте введения (кроме растворов в этилолеате); описаны случаи эозинофильной пневмонии; препарат не должен применяться у женщин с аллергией на арахисовое масло. Такая форма введения препарата является менее предпочтительной с точки зрения пациенток [44–45].
С учетом сказанного, в последнее время более широко применяется вагинальный прогестерон, более предпочтительный в ряде клинических ситуаций, что обусловлено, прежде всего, его фармакокинетическими характеристиками. Так, показано [39, 46], что при вагинальном применении концентрации прогестерона в плазме более чем в 3 раза выше, чем при оральном приеме, что объясняется хорошим всасыванием препарата со слизистой влагалища и отсутствием эффекта первого прохождения его через печень, в связи с особенностями анатомии венозных сосудов данной локализации. В то же время, эти концентрации ниже, чем после в/м введения [39], поэтому для достижения уровня гормона в сыворотке, соответствующего лютеальной фазе, эквивалентными являются дозы прогестерона для вагинального и в/м введения соответственно 100 мг и 25 мг [43].
В ряде работ было показано, что относительно низкие дозы гестагенов (50, 100 и 200 мг) при применении вагинально создают клинически эффективные концентрации в матке, несмотря на невысокий уровень гормона в плазме крови [47, 48], что объясняют накоплением гормона в высоких концентрациях именно в эндометрии, причем в концентрациях даже более высоких, чем при в/м введении: после вагинального введения 200 мг прогестерона в эндометрии создавалась концентрация 11,50±2,60 нг/мг, а после в/м инъекции 50 мг препарата – намного меньшая, 0,30±0,10 нг/мг [49, 50]. Подобное несоответствие объясняют «эффектом первого прохождения через матку» – накоплением препарата в высокой концентрации в матке благодаря хорошей резорбции из влагалища через его богатую венозную и лимфатическую систему [51–54]. Благодаря этой особенности фармакокинетики вагинально применяемый прогестерон отличается высокой клинической эффективностью. Не менее ценна особенность вагинального микронизированного прогестерона, которая также имеет значение для его клинической эффективности – создание стабильной концентрации препарата в сыворотке между введениями [18].
При сравнении (согласно инструкциям к препаратам) сывороточных концентраций прогестерона, создаваемых при введении различных его лекарственных форм – вагинальных таблеток ЛЮТЕИНА [55] и вагинальных капсул [37], обращают на себя внимание более высокие концентрации прогестерона сыворотки, создаваемые после введения вагинальных таблеток (Табл. 1) и составляют, соответственно, 10,9 и 9,7 нг/мл прогестерона.
Что не менее важно, вагинальные формы микронизированного прогестерона отличаются лучшей переносимостью и меньшим количеством побочных эффектов по сравнению с наблюдавшимися при применении гормонального препарата другими путями (в/м, внутрь) [58, 59]: клинический опыт свидетельствует, что диспепcические расстройства возникают в 2 раза реже, боль в животе – в 2,3 раза, головная боль – в 1,8 раза, сонливость – в 6 раз реже, чем в группах сравнения; метаболические эффекты микронизированного вагинального прогестерона также были выражены слабее, чем при системном энтеральном применении [60]. К недостаткам вагинальной лекарственной формы можно отнести возникающие иногда ощущения дискомфорта, раздражения и жжения, а также неудобство применения этой лекарственной формы при вагинальных кровотечениях (если кровотечение сильное, препарат может вымываться) [61, 62]. Определены некоторые ограничения по применению прогестерона вагинально. Как было показано в нерандомизированном исследовании [63], его использование в лечении женщин с цервикальной дисплазией 1 ст. замедляло регрессию дисплазии, что ассоциировалось с более длительным ее лечением/прогрессированием/потребностью в хирургическом лечении, однако в инструкции к препарату цервикальная дисплазия как противопоказание не зафиксирована.
С учетом сказанного, анализируя соотношение «польза–риск», в последнее время большинство авторов более предпочтительным считают вагинальный путь введения, основным преимуществом которого является возможность применения меньших доз прогестерона, обеспечивающих высокий уровень терапевтического действия – благодаря эффекту первого прохождения через матку, и вызывающих меньшее количество системных и местных побочных эффектов благодаря меньшим сывороточным концентрациям гормона [64].
Для достижения быстрого и сильного эффекта с минимальным побочным действием возможен также выбор сублингвального пути введения микронизированного прогестерона [55, 65].
В 2009 г. в Украине зарегистрирована инновационная лекарственная форма прогестерона – таблетки для сублингвального применения ЛЮТЕИНА 50 мг (Адамед, Польша). Благодаря отсутствию эффекта первого прохождения через печень и хорошей абсорбции с места введения, при их использовании создается высокая концентрация в сыворотке крови, на 39–71% превышающая концентрацию при вагинальном введении таблеток и капсул [37, 47, 55–57], а также существенно более высокая, чем создаваемая при энтеральном приеме удвоенной (!) дозы [33, 37], однако сопоставимая с концентрацией, возникающей при парентеральном введении [33, 56, 57] (Табл. 1).
Как установлено [56], для регуляции секреторного обмена эндометрия и сохранения беременности требуются концентрации прогестерона в сыворотке крови в пределах 12–15 нг/мл, соответствующие физиологической ранней лютеальной фазе. Надежное достижение такой концентрации также является преимуществом сублингвальных лекарственных форм перед применяемыми энтерально (Табл. 1), что подтверждатся результатами исследований [65] по сравнению уровней прогестерона сыворотки после введения микронизированного прогестерона сублингвально (ЛЮТЕИНА, сублингвальные таблетки, 100 мг 3 раза в день) и дидрогестерона внутрь (10 мг 3 раза в день): в группе получавших Лютеину уровень прогестерона сыворотки был выше на 23%.
Cистемные побочные эффекты микронизированного прогестерона при сублингвальном применении были незначительны [56]: отмечались единичные случаи сонливости, нарушений концентрации внимания, страха, депрессивные состояния, головная боль, головокружение, тошнота, редко – дисменорея, кровомазание, аменорея, покраснение кожи, угри, аллергические реакции, холестатическая желтуха.
Благодаря описанным фармакокинетическим преимуществам сублингвальной лекарственной формы – отсутствию эффекта первичного прохождения через печень и исключению пресистемного метаболизма, удобству применения (в том числе при рвоте) и хорошей переносимости, она может стать хорошей альтернативой другим лекарственным формам прогестерона, прежде всего энтеральным и препаратам для в/м введения, применяемым для поддержки беременности.
Клинические аспекты применения прогестерона
Использование гестагенов при угрозе выкидыша регламентируется Клиническим протоколом по акушерской помощи «Невынашивание беременности» (дополнение к приказу МЗУ №624 от 03.11.2008) [66]. В соответствии с ним, для лечения угрожающего аборта при наличии показаний используются различные препараты прогестерона: масляный раствор для в/м применения, микронизированный прогестерон для вагинального и перорального применения, синтетические производные прогестерона для энтерального применения. Первая и на данный момент единственная сублингвальная форма прогестерона – таблетки ЛЮТЕИНА – была зарегистрирована уже после создания Клинического протокола в Украине, в 2009 году. Дозы и сроки использования гестагенов протоколом не регламентированы.
При вагинальном применении микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки, 100 мг 2 раза в день) при угрозе прерывания беременности в сроке от 4–5 до 10–11 нед. у получавших препарат в 1 и 11 триместрах не отмечалось прерывания беременности до 22-й недели, была продемонстрирована высокая клиническая эффективность и хорошая переносимость интравагинальных таблеток. Через 5 нед. лечения редуцирование симптоматики позволило уменьшить дозу для дальнейшего применения до 50–100 мг [67]. Один из механизмов благоприятного воздействия прогестерона был раскрыт в рандомизированном двойном плацебо-контролируемом исследовании [68], в котором сравнивали эффекты различных форм прогестерона на маточно-плацентарное кровообращение на раних стадиях беременности (до 12 нед.). Использование вагинального (ЛЮТЕИНА), но не орального прогестерона (дидрогестерон), способствовало снижению индекса пульсации спиральных артерий и индекса резистентности. Анализ индексов сопротивления спиральной артерии свидетельствовал, что применение именно вагинального прогестерона лучше снижало повышенное сосудистое сопротивление в данных сосудах, улучшая доставку кислорода и питательных веществ к эмбриону, что делает более предпочтительным применение именно вагинальной лекарственной формы.
Группой очень высокого риска по невынашиванию беременности являются женщины с лейомиомой матки (угроза прерывания беременности почти в 75% случаев!). Сублингвальную форму микронизированного прогестерона (ЛЮТЕИНА) применяли [65] по 100 мг 3 раза в день, препарат сравнения (дидрогестерон) использовали по 10 мг 3 раза в день внутрь. При использовании прогестерона сублингвально отмечались достоверно более быстрый регресс УЗ-маркеров угрозы прерывания беременности (нормализация толщины миометрия, регресс ретрохориальной гематомы), было отмечено меньшее количество осложнений беременности и меньшая продолжительность пребывания в стационаре. Концентрация прогестерона в плазме крови при приеме Лютеины была достоверно выше (на 23,9%), что, в свою очередь, опосредованно свидетельствовало о более высокой его концентрации в матке, необходимой для сохранения беременности.
Критерием выбора дозы прогестерона может быть, по данным исследований [69], не только выраженность клинических признаков угрозы прерывания беременности, но и уровень гормона в сыворотке. Беременным с нормальным уровнем гормона назначали по 50 мг микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки) 2 раза в день, у беременных с дефицитом прогестерона до 35% использовали по 100 мг (2 таблетки) 2 раза в сутки; а женщинам с дефицитом прогестерона более 53% назначали по 150 мг прогестерона (3 таблетки) 2 раза в сутки. Под действием препарата была ликвидирована угроза выкидыша в I группе на 100%, во II–III группах сохранили беременность в 86 и 62% случаев, что объясняли изначально неблагоприятным в них прогнозом беременности.
Важным условием, определяющим выбор препарата для лечения, является его безопасность. Был проведен мониторинг [70] всех возможных нежелательных явлений и оценка переносимости природного микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки) у пациенток с симптомами угрозы выкидыша во время І триместра беременности. Полученные результаты клинического исследования свидетельствовали об отсутствии местных или системных побочных реакций.
Общепризнано, что при полиэтиологической природе преждевременных родов (ПР) именно снижение выработки прогестерона яичниками и плацентой приводит к повышению риска прерывания беременности на различных сроках ее развития. Результаты многочисленых исследований проблемы ПР [4, 71–74] нашли отражение в ряде международных практических рекомендаций и стандартов. В соответствии с указаниями комитета Американской коллегии акушеров и гинекологов (2008), всем женщинам со спонтанными ПР в анамнезе для профилактики повторного случая ПР целесообразно использовать препараты прогестерона [75].
В рекомендациях Польской гинекологической ассоциации (2012) рекомендуется применение гестагенов для профилактики преждевременных родов в одноплодных беременностях: 1) у беременных с преждевременными родами в анамнезе и шейкой матки длиной более 25 см — 17-альфа-гидроксипргестерона капроат внутримышечно в дозировке 250 мг/неделю; 2) у беременных с преждевременными родами в анамнезе и/или шейкой матки длиной менее 25 см – вагинально прогестерон 90–200 мг/сутки [14]. В соответствии с приказом № 624 МЗ Украины (2008), при лечении привычного невынашивания беременности для профилактики ПР рекомендуется лечение состояний, которые сопровождаются дефицитом эндогенного прогестерона (недостаточностью лютеиновой фазы).
Применение прогестерона при использовании вспомогательных репродуктивных технологий (ВРТ)
Даже при одноплодной беременности после экстракорпорального оплодотворения (ЭКО) частота самопроизвольных абортов составляет 20–45%, частота ПР — 18–36%, причем одной из причин этого является дефицит прогестерона [23]. В Кокрановском обзоре [76] была подтверждена целесообразность поддержки лютеиновой фазы при ЭКО с использованием агонистов ГнРГ: клинические данные об исходах ЭКО были существенно лучше при допольнительном использовании гонадотропина хорионического (ГХЧ) или прогестерона по сравнению с использованием только ГнРГ. Наименее эффективным оказался пероральный прием, результаты при в/м и вагинальном пути введения статистически не отличались [76, 77]. Одиним из механизмов протективного действия прогестерона вляется адекватная подготовка эндометрия к имплантации. Полноценное развитие пиноподий – маркера окна имплантации – было отмечено при использовании микронизированного прогестерона (ЛЮТЕИНА, вагинальные таблетки, 500 мг/сут в 2 приема) [78]. Было установлено [79], что у женщин, страдающих бесплодием в сочетании с очаговым аденомиозом, применение Лютеины вагинально по 100 мг 2 раза в день (5–25 день менструального цикла, 3 мес.) с целью подготовки к программе ЭКО приводило к подавлению секреции эстрогенов и пролиферативных процессов в эндометриоидных гетеротопиях, что способствовало повышению частоты имплантаций на 12% и благоприятно сказывалось на частоте вынашивания беременности и родов. При использовании протоколов, в которых не использовались аналоги ГнРГ (без дефекта лютеиновой фазы), потребности в применении гестагенов не было [80–82].
В программах донорства ооцита женщины реципиенты нуждаются в применении прогестерона, причем для нормального развития эндометрия они нуждаются в использовании также и эстрогенов, чередующихся с прогестероном [83, 84]. При оценке различных лекарствнных форм и путей введения прогестерона в циклах донации ооцита установлено, что показатели сывороточного прогестерона после орального его применения были ниже, чем после в/м или вагинального введения (39); лекарственная форма прогестерона для сублингвального применения, в отличие от орального, имела эффективность, сопоставимую с наблюдавшейся при в/м введении [85].
В США, Европе [86] и других странах микронизированный вагинальный прогестерон одобрен для поддержки беременности в 1 триместре у пациенток после ВРТ. 408 центров в 82 странах мира (284 600 циклов ЭКО; Западная Европа, США, Канада, Африка и др.), в 77% случаев назначали своим пациенткам именно вагинальный прогестерон. Важно, что синтетические гестагены (в т. ч. дидрогестерон) не фигурируют среди назначений репродуктологов в этих странах [87, 88]. Рекомендации по продолжительности применения прогестерона при ЭКО варьируют: рекомендуются как короткие, так и более длительные курсы его применения.
Одним из широко применяемых препаратов микронизированного прогестерона является ЛЮТЕИНА (Адамед, Польша), зарегистрированный в Украине с 2006 года.
Подводя итоги проведенного анализа литературы, можно выделить несколько заслуживающих внимания отличительных особенностей этого препарата:
- Содержит натуральный прогестерон, идентичный вырабатывающемуся в организме.
- Микронизированная форма прогестерона в препарате обеспечивает хорошее проникновение через слизистые оболочки и, соответственно, высокую его биодоступность.
- Имеет 2 лекарственные формы: вагинальные таблетки 50 мг и сублингвальные таблетки 50 мг, что позволяет выбрать путь введения, более предпочитаемый пациенткой.
- Сублингвальная лекарственная форма является инновационной для прогестерона и имеется только у препарата ЛЮТЕИНА (Адамед).
- Обе лекарственные формы – сублингвальная и вагинальная – обеспечивают попадание микронизированного прогестерона в организм, минуя печень, что позволяет избежать «эффекта первого прохождения через печень», увеличить биодоступность микронизированного прогестерона, уменьшить применяемые дозировки, нагрузку на печень и, соответственно, риск проявления гепатотоксичности.
- При использовании вагинальных таблеток, благодаря всасыванию через обширную сеть венозных и лимфатических сосудов, создается «эффект первого прохождения через матку»: при невысоких концентрациях прогестерона в сыворотке создаются высокие концентрации в эндометрии, обеспечивая высокую клиническую эффективность прогестерона при использовании в небольших дозах.
- При использовании вагинальных таблеток, благодаря невысокому уровню прогестерона в сыворотке крови, препарат проявляет хорошую переносимость, практически не вызывая системных метаболических побочных эффектов, характерных для энтеральных и парентеральных лекарственных форм прогестерона (влияния на свертываемость крови, углеводный и липидный обмен, задержку жидкости и пр.).
- При использовании вагинальных таблеток редко встречаются местные побочные эффекты.
- При использовании сублингвальных таблеток сохраняются преимущества энтеральной лекарственной формы (удобство применения, соответственно, более высокое качество жизни), но нет ее главного недостатка – эффекта первого прохождения через печень, следствием чего являются снижение биодоступности прогестерона и потребность в повышении дозы.
- Дозировка 50 мг в обоих видах таблеток – сублингвальных и вагинальных – позволяет обеспечить подбор дозы препарата в зависимости от конкретной ситуации, поддержание его концентрации в организме на нужном уровне (прием сублингвальных таблеток 3–4 раза в день), а также создает возможность постепенной отмены препарата, которая нередко рекомендуется при использовании гормональных препаратов.
- Активность препарата ЛЮТЕИНА при использовании для поддержки лютеиновой фазы изучена в ряде исследований, где препарат сравнивался с референтными препаратами, и показана сходная или более высокая клиническая эфективность.
- Микронизированный прогестерон – действующее вещество препарата ЛЮТЕИНА – не обладает тератогенной и мутагенной активностью.
- Существенным преимуществом препарата ЛЮТЕИНА является его ценовая доступность, что, наряду с отмеченными выше эффективностью и хорошей переносимостью, является немаловажным критерием при выборе препарата для длительного лечения.
Режим применения препарата Лютеина (вагинальные таблетки) при привычном и угрожающем выкидышах: вводят 50–150 мг прогестерона (1–3 вагинальных таблетки 50 мг) 2 раза в день. В случае привычных выкидышей введение Лютеины нужно начать во время цикла, когда запланирована беременность, или раньше. Лечение нужно продолжать непрерывно приблизительно до 18–20 недели беременности [55].
Режим применения препарата Лютеина (сублингвальные таблетки) при привычном невынашивании и угрозе самопроизвольного аборта: применяют по 100 мг прогестерона (2 сублингвальных таблетки Лютеина 50 мг) 3–4 раза в день. В случае привычного невынашивания применение Лютеины нужно начать во время цикла, в котором запланирована беременность или раньше (прегравидарная подготовка за 3–4 месяца). Лечение нужно продолжать непрерывно приблизительно до 18–20 недели беременности [56].
Режим применения препарата Лютеина (вагинальные таблетки) в программах искусственного оплодотворения: вводят вагинально по 150–200 мг прогестерона (3–4 таблетки) 2 раза в день. Лечение продолжают непрерывно до 77-го дня после перемещения зародыша. Завершают лечение путем постепенного уменьшения дозы [55].
Режим применения препарата Лютеина (сублингвальные таблетки) в программах оплодотворения in vitro (экстракорпорального): применяют по 100–150 мг прогестерона 3–4 раза в день сублингвально [56].
Список литературы находится в редакции.
