Среди многочисленных лекарственных растений, обладающих тропностью к нейро-эдокринной системе человека и животных, в последнее десятилетие особое внимание уделяется Agnus Castus. Vitex agnus castus (Прутняк, «Монаший перец», Авраамово дерево) принадлежит к семейству вербеновых (Verbenaceae). Природный ареал произрастания – Средиземноморье, Крым, Африка, наиболее теплые регионы Азии и Америки
Для лечебных целей используются плоды Agnus Castus (АК), содержащие иридоиды, флавоноиды и эфирные масла [25].
Первые упоминания об использовании вытяжек из плодов АК относят к античным временам. Подтверждения тому можно найти в работах Гиппократа (IV век до р. Х.), который предписывал АК для борьбы с маточными кровотечениями и «ускорения отхождения последа».
Диоскорид Педаний, греческий военный врач и натуралист (1 в. н. э.), один из основателей ботаники как науки, описал терапевтические свойства АК при воспалительных заболеваниях женских половых органов.
В народной медицине Витекс служит средством для подавления сексуального возбуждения. В своей книге о травах, изданной в 1697 г., Адам Лоницерус пишет: «Кто этими листьями устелет свое ложе, у того они отгонят все плотские соблазны». В гербариях Лоницеруса и Маттиолиса плоды и листья АК фигурируют как галактогога и аменогога [15].
В последнее время широкое применение экстрактов АК стало возможным после изучения их фармакологических свойств и открытия у пяти выделенных из липофильных фракций бициклических дитерпенов веществ, обладающих допаминергической активностью и селективным сродством к экстрогеновым рецепторам Р-подтипа. Последние, как известно, участвуют в регуляции жирового обмена, не оказывают влияния на матку и обмен в костной ткани, определяемый по уровню остеокальцина и щелочной фосфатазы [15, 18].
В экспериментах in vitro показано, что экстракты АК, обладая высоким сродством к Д2 эндорфинным рецепторам, ингибируют высвобождение пролактина (ПРЛ) из культуры пролактотрофных клеток гипофиза и этот эффект нейтрализуется антагонистом допамина – галоперидолом [24, 25, 27].
Многочисленные клинико-лабораторные исследования последних лет демонстрируют успешное применение АК и Мастодинона, в состав которого входит АК, при лечении латентной гиперпролактинемии (ГП) и мастодинии, предменструального и климактерического синдромов [3, 17, 19].
Так, Rao G. M. et al. (1997) в двойном слепом плацебо-контролируемом исследовании показали, что у пациенток с циклической масталгией отмечается достоверное снижение исходно повышенного ТРГ-стимулированного уровня ПРЛ наряду с эффективностью в отношении болей в молочных железах. Кроме того, также зафиксировано параллельное со значительным повышением уровня прогестерона (Р) по сравнению с таковым при использовании плацебо увеличение вдвое продолжительности лютеиновой фазы менструального цикла [23].
Таким образом, вышеизложенные данные послужили основанием для использования фитопрепарата Циклодинон (Агнукастон) (содержащего 20 мг активного АК, фирма Бионорика АГ, Германия) у пациенток с недостаточностью функции желтого тела, обусловленной относительной гиперпролактинемией, с целью коррекции имеющихся нарушений и оценки клинической эффективности и переносимости препарата.
Материалы и методы
Комплексному клинико-лабораторному обследованию подверглись 20 пациенток в возрасте от 25 до 41 (30,0±0,9) года с относительной гиперпролактинемией и страдающих нарушениями менструального цикла различного характера.
Критериями для включения в исследование являлись:
- отмена в течение 3-х и более месяцев, предшествующих проводимому обследованию, гормонотерапии и других медикаментов, влияющих на уровень половых стероидов и ПРЛ;
- отсутствие сопутствующей эндокринной патологии (нарушения функции щитовидной железы);
- исключение рака молочной железы, эндометрия или других гормонозависимых опухолей;
- исключение беременности;
- наличие маточных кровотечений неясного генеза;
- непереносимость препарата.
Группу контроля составили 15 соматически здоровых женщин в возрасте от 24 до 26 лет.
У находившихся под наблюдением больных жалобы, заставившие обратиться к гинекологу, были следующими:
- изменение ритма менструаций по типу олигоменореи (задержки от 7 до 14 дней) (20);
- скудные менструации (7);
- головные боли по типу мигрени (3), головокружения (3), слабость (2);
- предменструальные боли и нагрубание молочных желез (8);
- отсутствие беременности от 2 до 3,7 лет (5);
- психо-эмоциональные и вегето-сосудистые расстройства (5).
При выполнении работы наряду с общеклиническим обследованием, включающим подробное изучение анамнеза, особенностей менструального цикла, репродуктивной функции, общий и гинекологический осмотр, также использовали радиоиммунологические методы при исследовании сывороточных концентраций ПРЛ, эстрадиола (Е2), Р.
Учитывая наличие суточных ритмов секреции ПРЛ, забор крови осуществляли спустя 3–4 часа после пробуждения пациентки [13].
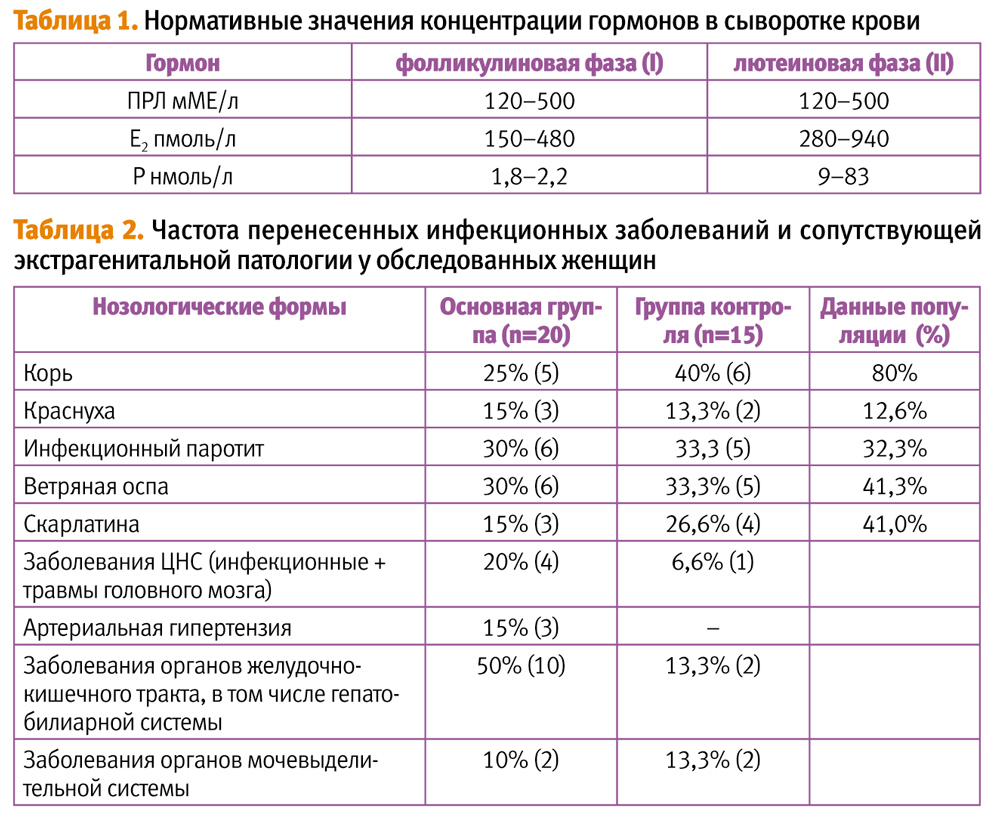
В качестве нормативных значений использовали пределы нормы, разработанные в лаборатории эндокринологии НЦ АГиП РАМН (табл. 1).
Так же, как и гормональные, на 4–5 и 20–21 дни спонтанной менструации всем обследованным до начала и после завершения трехмесячной терапии Циклодиноном (Агнукастоном) производилось эхографическое исследование органов малого таза на аппарате «Aspen» (фирмы Acuson, США) с использованием мультичастотного 4,0–6,0–8,0 МГц трансвагинального датчика. Все исследования осуществлялись в первой половине суток, по методике опорожненного мочевого пузыря. С помощью этого же аппарата и линейного датчика с частотой 7–10 МГц обследовали состояние молочных желез.
Для исключения опухолевого генеза ГП магнитно-резонансно-томографическое обследование (МРТ) проводили на оборудовании «Magnetom Impact» (Siemens) c контрастным усилением «Magnevit».
При статистической обработке данных применяли прикладные программы «Статистика» пакета MATLAB 5,3. Достоверность различий в группах определена по t-критерию Стьюдента, различия считались достоверными при р<0,05 [4, 9].
Объективизация эффективности лечения оценена путем математического расчета динамики гормональных параметров (в процентах) по формуле:
средний начальный – средний конечный х 100% [21]
показатель показатель
средний конечный показатель
Полученные результаты и их обсуждение
В соответствии с поставленной целью, комплексное клинико-лабораторное обследование проведено у 20 женщин (основная группа) с ГП в возрасте от 25 до 41 года (30,9±0,9 лет). По данным литературных источников, около 80% больных всех форм ГП – это молодые женщины аналогичного возрастного диапазона [5].
Средний возраст соматически здоровых женщин группы контроля составил 25,5±1,2 года. Ни одна из обследованных обеих групп не имела выраженных метаболических расстройств, о чем свидетельствует нормальный показатель индекса массы тела (18 кг/м2 ИМТ с 25 кг/м2).
При изучении приморбидного фона у больных с ГП превышения числа перенесенных в детском возрасте инфекционных заболеваний по сравнению с таковыми у обследованных контрольной группы и данными в популяции отмечено не было (р>0,05) (табл. 2) [1].
Вместе с тем, следует отметить, что у 20% из числа обследованных пациенток основной группы имели место заболевания ЦНС и перенесенные травмы головного мозга, после которых у трех развилась транзиторная артериальная гипертензия. Практически у каждой второй пациентки в структуре сопутствующей экстрагенитальной заболеваемости преобладала патология желудочно-кишечного тракта, в том числе гепато-билиарной системы (10 больных). В этом аспекте немаловажен тот факт, что трое из десяти пациенток в течение 2-х предшествующих настоящему обследованию лет перенесли эндоскопическую холицистэктомию по поводу желчно-каменной болезни. У трех других клинические проявления совпали с тяжелыми стрессовыми ситуациями в семье.
Наши данные, как и многочисленные указания в литературе, в том числе и эпидемиологические исследования, подтверждают значимость стрессорного фактора в развитии неопухолевой ГП [8, 16, 20, 22].
К провоцирующим моментам ГП у остальных пациенток, по-видимому, можно отнести 1,5–2-летний прием эстроген-гестагенных оральных контрацептивов. Влияние данной группы препаратов на секрецию ПРЛ общеизвестно и широко отражено в современной литературе. Как эндогенные, так и экзогенные эстрогены, входящие в состав комбинированных оральных контрацептивов и препаратов для заместительной гормонотерапии, использующихся в пери- и постменопаузальном периоде, активируют эстрогенчувствительный элемент гена ПРЛ и способствуют увеличению синтеза и секреции последнего. Оральные контрацептивы, возможно, не вызывают образования пролактинов, но способны стимулировать их развитие и функцию и обычно не назначаются пациенткам с такими опухолями [2, 14].
Анализ особенностей менструальной функции показал, что средняя продолжительность цикла составила 39,5±7,3 дня, длительность менструации – от 3 до 5 дней. Кроме того, 7 женщин основной группы обратились по поводу более скудных менструаций. В это же время, в группе контроля межменструальный интервал не превышал 28 (26,5±1,2) дней.
Развитие вторичной олигоменореи, типичного проявления ГП, как правило, относят к дебюту заболевания и при неопухолевом генезе частота ее достигает 58,1% [10, 11, 20, 28].
Однако, в литературе имеются указания и на сохранение регулярного ритма менструаций при пятикратном превышении ПРЛ у больных с аденомой гипофиза [12, 16]. В 30–70% случаев гиперпролактинемию сопровождает бесплодие [6, 7, 8, 26].
В наших наблюдениях отсутствие беременности отмечено у 25% пациенток.
В анамнезе остальные 11 (55%) женщин имели от 2 до 6 беременностей, из которых от 1 до 3-х завершились самостоятельными своевременными родами, от 2-х до 4-х – неосложенными искусственными абортами. Остальные 4 (20%) пациентки не планировали беременность.
В процессе изучения основных гормональных параметров, характеризующих стероидную функцию яичников и пролактинсекретирующую – аденогипофиза, получены данные, позволившие по степени повышения базального уровня ПРЛ всех обследованных основной группы разделить на две подгруппы (А и В). Так у 13 (65%) пациенток, отнесенных в подгруппу А, показатели среднего исходного уровня ПРЛ находились в диапазоне от 618,0 мМЕ/л до 774,0 мМЕ/л, составив в среднем 698,8 мМЕ/л. У остальных 7 (35%) данный средний исходный параметр достигал 1066,0 мМЕ/л (1028–1098 мМЕ/л), они и составили подгруппу В (табл. 3).
Как видно из представленных в таблице 3 данных, достоверных различий в содержании средних исходных уровней ПРЛ в I и II фазах менструального цикла у обследованных А и В подгрупп выявлено не было (р>0,05). Однако, у 5 пациенток подгруппы А отмечалось превышение его в 1,2 раза на 20–21 день по сравнению с таковым на 4–5 дни менструального цикла. Полученные сведения согласуются с данными Ю. А. Комаровой (1986), В. П. Сметник и Л. Г. Тумилович (1995) и, по-видимому, могут свидетельствовать об определенной этиологической роли ГП в генезе наблюдаемых у данной когорты пациенток предменструальных психо-эмоциональных расстройств и выраженной циклической масталгии [12, 23].
Подтверждения данного предположения можно найти в сообщениях Nunes M. et al. (1980), также обнаруживших изменения психо-эмоциональной сферы у больных с ГП [22].
Интересен тот факт, что несмотря на объективные различия в базальных уровнях ПРЛ, средние исходные концентрации Е2 по подгруппам существенно не отличались и составили 159,0 nмоль/л для подгруппы А и 163,1 nмоль/л для подгруппы В. Выявленные исходно пониженные по сравнению с нормативными и в группе контроля уровни Р (18,5 нмоль/л и 8,7 моль/л) – свидетельствовали о недостаточности функции желтого тела.
Вместе с тем, показатели средних конечных значений уровня ПРЛ после трехмесячной терапии Циклодиноном (Агнукастоном) заметно отличались.
Так, у пациенток подгруппы А как в раннюю фолликулиновую, так и лютеиновую фазы цикла, средние конечные показатели уровня ПРЛ снизились до нормальных значений, составив 498,7 мМЕ/л и 501,6 мМЕ/л – соответственно. В то же время, как показывают результаты обследования, у 7-ми пациенток подгруппы В конечные средние показатели ПРЛ и во II, и в I фазе менструального цикла не достигли нормативных отметок, а оставались повышенными от 760 мМе/л до 821,6 мМЕ/л, соответственно.
Трем пациенткам подгруппы В с конечными показателями уровня ПРЛ от 730 до 907 МЕ/л для исключения органических изменений гипофиза произведена МРТ головного мозга с контрастным усилением. Лишь в одном наблюдении картина магнитно-резонансной томографии была подозрительной в отношении микроаденомы за счет ассиметричности и неоднородности структуры гипофиза, ослабления накопления контрастного вещества. В двух других случаях на основе проведенного исследования опухолевая природа ГП была исключена.
Объективизация эффективности лечения произведена путем математического анализа, результаты которого позволили определить степень снижения уровня ПРЛ и повышения Р для каждой из выделенных подгрупп (табл. 4).
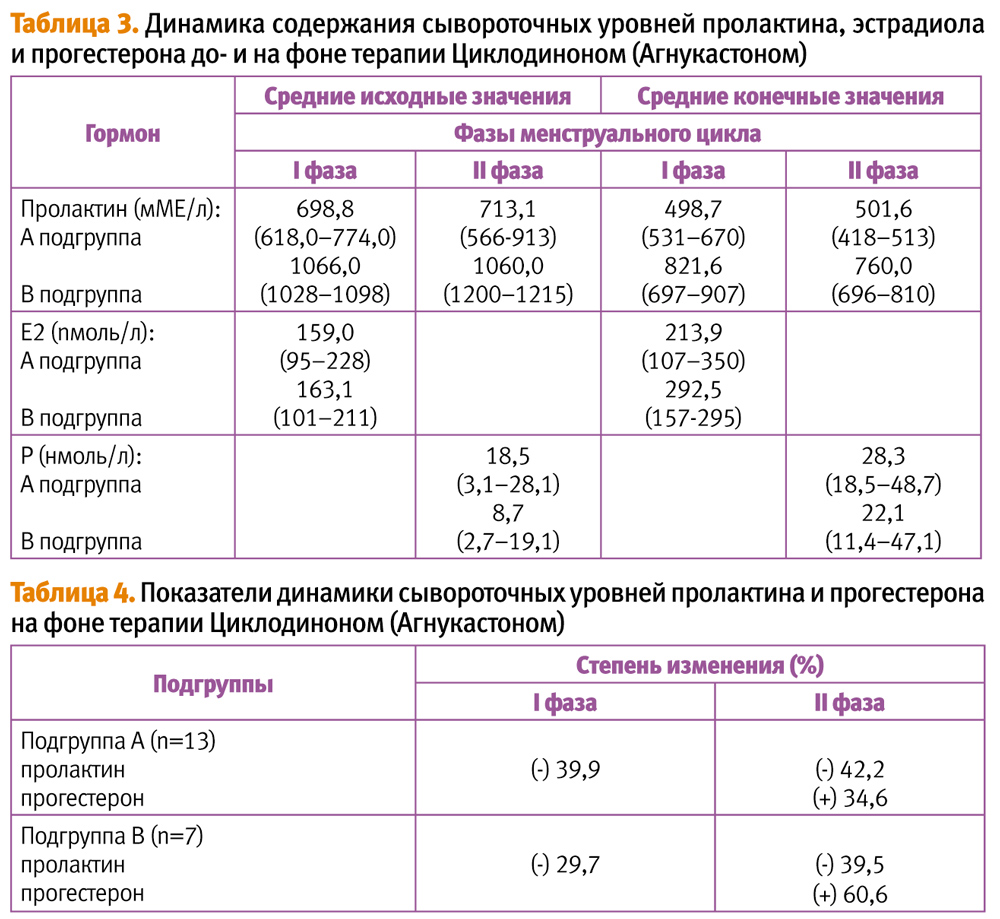
Анализируя приведенные выше данные, можно заключить, что степени снижения средних исходных уровней ПРЛ в подгруппе А в I и II фазах менструального цикла были соизмеримы и составили 39,9 и 42,2%. В то же время, в подгруппе В отмечалось более чем полуторакратное, по сравнению с подгруппой А, повышение средних конечных показателей Р в лютеиновую фазу менструального цикла (60,6% против 34,6%; р<0,05).
Терапевтическая эффективность применения Циклодинона (Агнукастона) в обеих подгруппах подтверждена не только клиникой (восстановление ритма менструации) и данными эхографического мониторинга (УЗ-признаки произошедшей овуляции, наличие полноценных желтых тел), но также повышением уровней Р на 20–21 дни цикла.
Сопоставляя графики ректальной температуры с концентрацией Р, нами были выявлены корреляции лишь в 35% случаев. Это еще раз подтверждает мнение о том, что базальная температура не может служить абсолютно объективным тестом, адекватно отражающим деятельность яичников.
К концу 3 месяца терапии ни в одном из наблюдений не было отмечено увеличения размеров тела матки и прогрессирования аденомиоза (3 случая I–II ст. диффузного аденомиоза), а также миоматозных узлов (2 наблюдения с межмышечным расположением последних 1–1,5 см в диаметре). Во всех случаях на момент завершения терапии состояние эндометрия соответствовало фазам менструального цикла.
Ультразвуковой мониторинг не выявил изменений в эхографической картине соотношения стромального, железистого компонентов и жировой ткани молочной железы до и после трехмесячного курса терапии. Вместе с тем, субъективное улучшение в отношении циклической масталгии было констатировано практически у всех 8 пациенток.
Важно отметить тот факт, что у 2 женщин (конечные показатели ПРЛ – 764,0 мМЕ/л, Р – 47 нмоль/л и 560,0 мМЕ/л, 68 нмоль/л, соответственно), страдающих вторичным бесплодием, в цикле отмены спонтанно наступили беременности, завершившиеся самостоятельными своевременными родами.
В результате проводимого суточного мониторинга артериального давления резких колебаний его у пациенток как с нормо-, так и гипотонией зафиксировано не было. Всеми отмечалась хорошая переносимость препарата.
Таким образом, резюмируя предварительные данные, касающиеся использования Циклодинона (Агнукастона) у женщин репродуктивного возраста, можно сделать следующие выводы:
Способность Циклодинона (Агнукастона) эффективно снижать повышенную секрецию пролактина отражает его «центральное» действие, обусловленное стимулирующим влиянием на дофаминовые рецепторы аденогипофиза.
При относительной функциональной гиперпролактинемии (600–700 мМЕ/л) пролактингибирующий эффект Циклодинона (Агнукастона) может достигать 100%, при более высоких показателях (от 800 до 1000 мМЕ/л) он не превышает 40%, что, по-видимому, служит показанием для увеличения используемых доз и/или более продолжительной терапии.
Под влиянием препарата Циклодинон (Агнукастон) наблюдается повышение циклической секреции прогестерона в лютеиновую фазу цикла, что способствует нормализации ритма менструаций.
Циклодинон (Агнукастон) может рассматриваться альтернативой лечению другими стимуляторами дофаминовых рецепторов при их непереносимости у больных с относительной гиперпролактинемией неопухолевого генеза.
Литература
- Борисова Ю. Ф. О половом развитии школьников г. Москвы: Автореф. дис. … канд. мед. наук. М., 1965. – 18 с.
- Вильям М. Кеттайл, Рональд А. Арки. Нейроэндокринология и передняя доля гипофиза // Патофизиология эндокринной системы. С-Петербург. – «Невский Диалект». – 2001. – С.28-40.
- Вишневский А.С., Сафронникова Н.Р., Мельникова Н.Ю., Григорьева Т.А. Новые подходы к синдрому гиперпролактинемии // Журнал Акушерства и Женских болезней. – Вып. 1. – Т. XLIX. – 2000. – С. 39-41.
- Закс Л. Статистическое оценивание – М: «Статистика», 1976.
- Мельниченко Г.А., Серебрянский О.Ю., Роменцова Т. И. Норпролак – новый агонист дофамина // Медицина для всех. – 1997. – № 1 (2). – С. 22-24.
- Назаренко Т. А., Дуринян Э. Р., Чечурова Т. Н. Пробл. репр. 1999; 5 (2): 48-51.
- Овсянникова Т. В. Гиперпролактинемия // Медицина для всех. – 1997. – № 1 (2). – С.19-21
- Овсянникова Т. В. Патогенез, клиника, диагностика и отдаленные результаты лечения бесплодия при гиперпролактинемии у женщин. Дис. Док. Мед. наук. – М., 1990.
- Платонов А. Е. Статистический анализ в медицине и биологии: задачи, терминология, логика, компьютерные методы. – М., Изд. РАМН, 2000.
- Прилепская В.Н. Вторичная аменорея // Акуш. гин. – 1990. – № 12. – С. 61-67.
- Сметник В. П. Гиперпролактинемия и нарушения функции репродуктивной системы // Акуш. гин. – 1990. – № 4. – С. 75-79.
- Сметник В. П., Марченко Л. А., Осипова А., Пробл. реп. 2000; 3: 42-7.
- Сметник В. П., Тумилович Л. Г. Неоперативная гинекология. – Санкт-Петербург, 1995, С. 154.
- Сметник В. П., Тумилович Л. Г. Неоперативная гинекология: руководство. М., 1999.
- Фитогормоны. Клиническая лекция. // Кн. – Под ред. Радзинского В. Е., Костина И. Н. – 2003. – Часть 1. – 64 с.
- Asa S., Rovacs K., Stefaneanu L. еt al. Pituitary adenomas in mice transgenic for growth hormone releasing-hormone // Endocrinology. – 1992. – Vol. 131. – P. 2083-2089.
- Berger D. Vitex Agnes castus: Unbedenklichkeit and Wirksamkeit beim praemenstruellen Syndrom, Wirkprinzipien und Wirkmechanismen eines neuetwickelten Extraktes. Dissertation, Phil. – Naturwissen-scgrtliche Fakultat, Universitat Basel, 1998, S. 220.
- Hoberg E., Sticher O., Orjala J.E., Meier B. Diterpene aus Fgnicasti fructus und ihre Analytik. Zeitschrift fur Phytotherapie, 1999, 149:3.
- Jarr H., Leonhardt S., Wuttke W., Behr B., Gorkow C. Agnus castus als dopaminerges Wirkprinzip in Mastodynon // N. Zeitschrift fur Phytotherapie. – 1991, 12: 77-82.
- Luciano A. Clinical presentation of Hyperprolactinemia // J. Reprod Med. – 1999. – Vol. – 44. – P. 1085-1090.
- MPH Edition Eхtrait de Psychiatrie Pratique de Medlien № 39 Avril 1987.
- Nunes M., Sobrinho L., Calhaz-Jorge C. et al. Psychosomatic factors in patients with hyperprolactinemia and/or galactorrhea // Obstet Gyn. – 1980. – Vol. 55. – P. 591-595.
- Rao G. M., Ney E., Herbert R. A. Influence of diet on mammary cancer in transgenic mice bearing on oncogene expressed in mammar tissue // Breast Cancer Res reat. 1997; 45: 149-158.
- Sliutz G., Speiser P., Schultz A.M., Spona J., Zeilinger R. Agnuscastus extracts inhibit prolactin secretion of rat pituitary cells. // Hormone and Metabolic Research. – 1993, 25: 243-255.
- Spengler B., Schmidt J., Porzel A., Christoffel V. Isolation and characterization of cyclic diterpenes from BNO 1095 (Vitex angus casts). In preparation (1999).
- Tan S. Current Opinion Obstet Gynaec 1990; 2: 378-85.
- Wuttke W., Gorkow C., Jarry H. Dopaminergic compounds in Vitex agnes castus. // In: Loew D., Rietbrock N (Hrsg) Phytopharmaka in forschung und klinischer Anwendung. Steinkopff, Darmstadt, 1995, S. 81-91.
- Yen S., Jaffe R. Prolactin in human reproduction. Reproductive Endocrimology // Physiology, Pathiphysiology, Clinical Management. – 4th Edition. – 1999. – P. 257-283.


коментарів