Синдром Дауна (СД) — самая известная и наиболее распространенная хромосомная аномалия, приводящая к выраженной умственной отсталости, имеющая характерные фенотипические проявления с нарушением соматического и психофизического развития. ОМIM-190685; МКБ-Х — Q.90. Синоним: трисомия 21, ранее употреблялся термин «монголизм».
Историческая справка
В 1846 году Сегуин (Seguin) описал детей с умственной отсталостью, которые имели монголоидные черты лица. Но он расценил эту патологию как разновидность кретинизма, вызванную снижением функции щитовидной железы. В 1866 году лондонский врач Джон Лэнгдон Хэйдон Даун (John Langdon Haydon Down) опубликовал небольшую статью, в которой настолько детально описал клиническую картину болезни, что она до сих пор считается эталоном. Он также организовал для этих больных специальный приют, которым руководил длительное время, имел большой опыт в их лечении и приобщении к полезной жизни в семье и обществе. Его идеи и нововведения были практичными и новаторскими и изменили отношение к тяжело больным детям. Доктор Даун первым стал различать умственно отсталых детей от детей с кретинизмом (вследствие гипотиреоза) и так называемых монголоидов (детей с СД). Термин «монголоиды» просуществовал в научной медицинской литературе почти 100 лет. В 70-х годах ХХ века специальная комиссия США по медицинской терминологии приняла решение о присвоении этой патологии официального названия — «синдром Дауна», в честь человека, впервые диагностировавшего и описавшего его. Примечательно, что у самого Д. Дауна родился внук с этим синдромом.
Этиология
 Спустя почти 100 лет после описания СД, в 1959 году два независимых исследования Жерома Лежена (Lejeune) и Патриции Джейкобс (Jacobs) установили, что причиной нарушения является трисомия 21 хромосомы, хотя еще в 1932 году Ваарденбург (Waardendurg) и Блеер (Bleyer) выдвинули гипотезу о хромосомном происхождении этого синдрома. В 1987 году идентифицированы гены (Olig 1 и Olig 2), индуцирующие его развитие, расположенные на длинном плече 21 хромосомы дистальнее критической области бэнда q22.1, между сегментами 21q22.1–21q22.3 (максимальный размер этого фрагмента 2000–3000 кб, содержит последовательность генов, определяющих активность ферментов SOD1, ETS2, CBS, нарушение продукции которых отмечается при синдроме Дауна), трипликация которого определяет фенотип СД.
Спустя почти 100 лет после описания СД, в 1959 году два независимых исследования Жерома Лежена (Lejeune) и Патриции Джейкобс (Jacobs) установили, что причиной нарушения является трисомия 21 хромосомы, хотя еще в 1932 году Ваарденбург (Waardendurg) и Блеер (Bleyer) выдвинули гипотезу о хромосомном происхождении этого синдрома. В 1987 году идентифицированы гены (Olig 1 и Olig 2), индуцирующие его развитие, расположенные на длинном плече 21 хромосомы дистальнее критической области бэнда q22.1, между сегментами 21q22.1–21q22.3 (максимальный размер этого фрагмента 2000–3000 кб, содержит последовательность генов, определяющих активность ферментов SOD1, ETS2, CBS, нарушение продукции которых отмечается при синдроме Дауна), трипликация которого определяет фенотип СД.
94% случаев СД представляют собой регулярные трисомии 21 хромосомы, обусловленные нерасхождением хромосом, чаще в I (76%) или реже во II (24%) мейотическом делении гамет, преимущественно материнского происхождения (80%). В пользу существования генного контроля свидетельствуют случаи повторного рождения в некоторых семьях детей с регулярной формой трисомии 21, что может объясняться генетически обусловленной тенденцией к нерасхождению хромосом либо как невыявленный мозаицизм (возможно, с вовлечением гонад), а также более высокой частотой кровнородственных браков между родителями таких детей.
4% СД представляют собой варианты робертсоновских транслокаций, обусловленных почти в половине случаев сегрегацией семейных сбалансированных хромосомных аберраций у родителей, преимущественно материнского происхождения — 39%, отцовского — 3%, имеющего в свою очередь более высокий рекуррентный риск (9–10%) СД для потомства, чем при реципрокных транслокациях отцовского происхождения — 2%. Чаще всего встречаются транслокационные варианты 14/21 хромосом (58–70%), реже 15/21 (22%) и 13/21 (5–10%) хромосом и летальные варианты 21/21. В большинстве случаев транслокационные варианты СД встречаются у молодых родителей в отличие от регулярной формы трисомии, которая чаще наблюдается у женщин старше 30 лет. Половина наблюдений транслокационного СД возникает de novo вследствие мутаций. Мозаичная форма СД составляет 2% от всех наблюдений и обладает значительным клиническим полиморфизмом фенотипических проявлений.
Распространенность
Средняя популяционная частота СД составляет 1:700–800 новорожденных. Высокая распространенность СД обусловлена довольно низким уровнем внутриутробной гибели плодов и относительно высокой жизнеспособностью больных по сравнению с другими хромосомными синдромами, что объясняется аномалией самой маленькой аутосомы в кариотипе человека. Частота среди новорожденных составляет 0,15%, среди абортусов 3%, среди умерших в перинатальном периоде 1%.
Прогноз
Развитие около 30% плодов с СД спонтанно прерывается в первую половину беременности, преимущественно в ранние сроки. Дети в основном погибают от пороков сердца и врожденного иммунодефицита (около 31% детей с трисомией 21 хромосомы умирают до конца 1-го года жизни, 40% — в конце 3-го года жизни), взрослые — из-за неврологических и злокачественных заболеваний, преждевременного старения организма. Максимальная продолжительность их жизни 50–60 лет. Ежегодно во всем мире рождается свыше 150 тысяч детей с синдромом Дауна: в США — около 5 тысяч, в Украине около 500; в России — более 2500, в бывшем СССР — около 8 тысяч больных с СД. Благодаря упорству, совместным усилиям родителей, психологов, педагогов, медиков, социальных работников удается достичь определенных успехов в социальной реабилитации больных с СД.
Факторы риска
Материнский возраст
Первым обратил внимание на взаимосвязь возраста матери и частотой рождения детей с СД Шатлворт (Shuttleworth) в 1909 году. В 1938 году Блеер (Bleyer), сравнив возраст матерей 2822 детей с СД и 2 000 000 здоровых новорожденных, определил, что средний возраст первых составил 41 год, а вторых — 24 года соответственно. Многочисленные дальнейшие исследования подтвердили это. Установлено, что с увеличением возраста матери с 20 до 45 лет резко возрастает частота рождения ребенка с СД (с 0,5 до 4,3 на 1000) (табл. 1) и некоторыми другими хромосомными анеуплоидиями. В это же время еще в 1954 году Пенроуз (Penrose) доказал, что возраст отца не влияет на частоту СД.
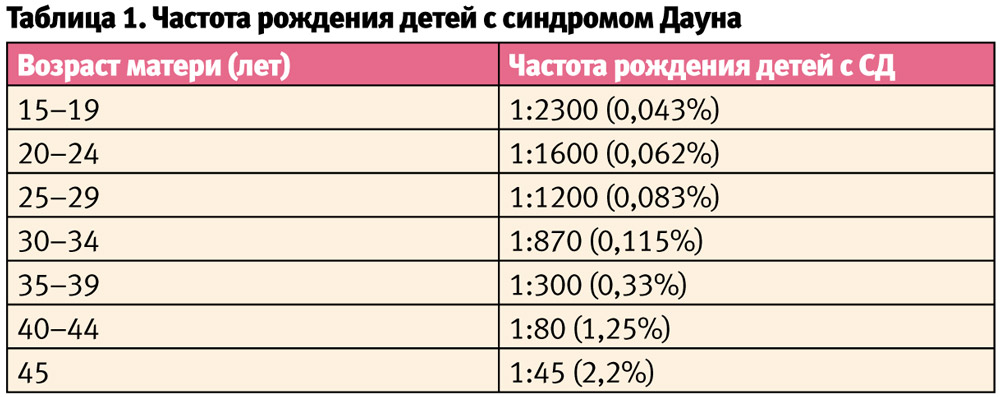
Факторами, повышающими риск нерасхождения хромосом, является наличие мозаицизма или сбалансированных транслокаций у родителей, рождение детей с трисомией. В последние годы отмечено увеличение частоты рождения детей с СД у молодых матерей. Причины, способствующие возникновению трисомии 21, разнообразны. Кроме возраста матери и в значительно меньшей степени возраста отца (перезревание сперматозоидов при нерегулярной, редкой половой жизни в пожилом возрасте) нерасхождению хромосом в мейозе способствует эндокринная незрелость молодых беременных, гормональные контрацептивы, транзиторные периоды периовуляторного перезревания яйцеклетки, гипериндукция овуляции, длительность интергенетического интервала, частота половых сношений, сезонная динамика зачатий в инфекционный и постинфекционный период, а также вредные профессиональные и экологические факторы. Отмечена взаимосвязь увеличения частоты СД от числа предшествующих спонтанных абортов и даже от возраста бабушки по материнской линии.
Фенотипический портрет синдрома Дауна
Синдром Дауна является одной из форм олигофрений, при которой умственная отсталость и задержка развития сочетается со своеобразным соматическим синдромом и специфическим обликом больного. Благодаря самой высокой распространенности среди всех форм умственной отсталости и легкости распознавания, обусловленной характерным фенотипом, дети и взрослые с СД хорошо знакомы не только специалистам. Фенотипически эти больные настолько похожи, что их часто называют «дети одной матери». Однажды увидев такого ребенка или взрослого, его можно с уверенностью выделить из окружающих. Поэтому говорят не о диагностике, а об «узнавании» СД. Действительно, вид больного имеет характерные проявления, которые запоминаются без труда. При этом большая часть симптомов обнаруживается у ребенка сразу же при рождении (табл. 2). И довольно часто присутствует внутриутробно у плода, что дает возможность визуализации некоторых из них при пренатальном ультразвуковом исследовании.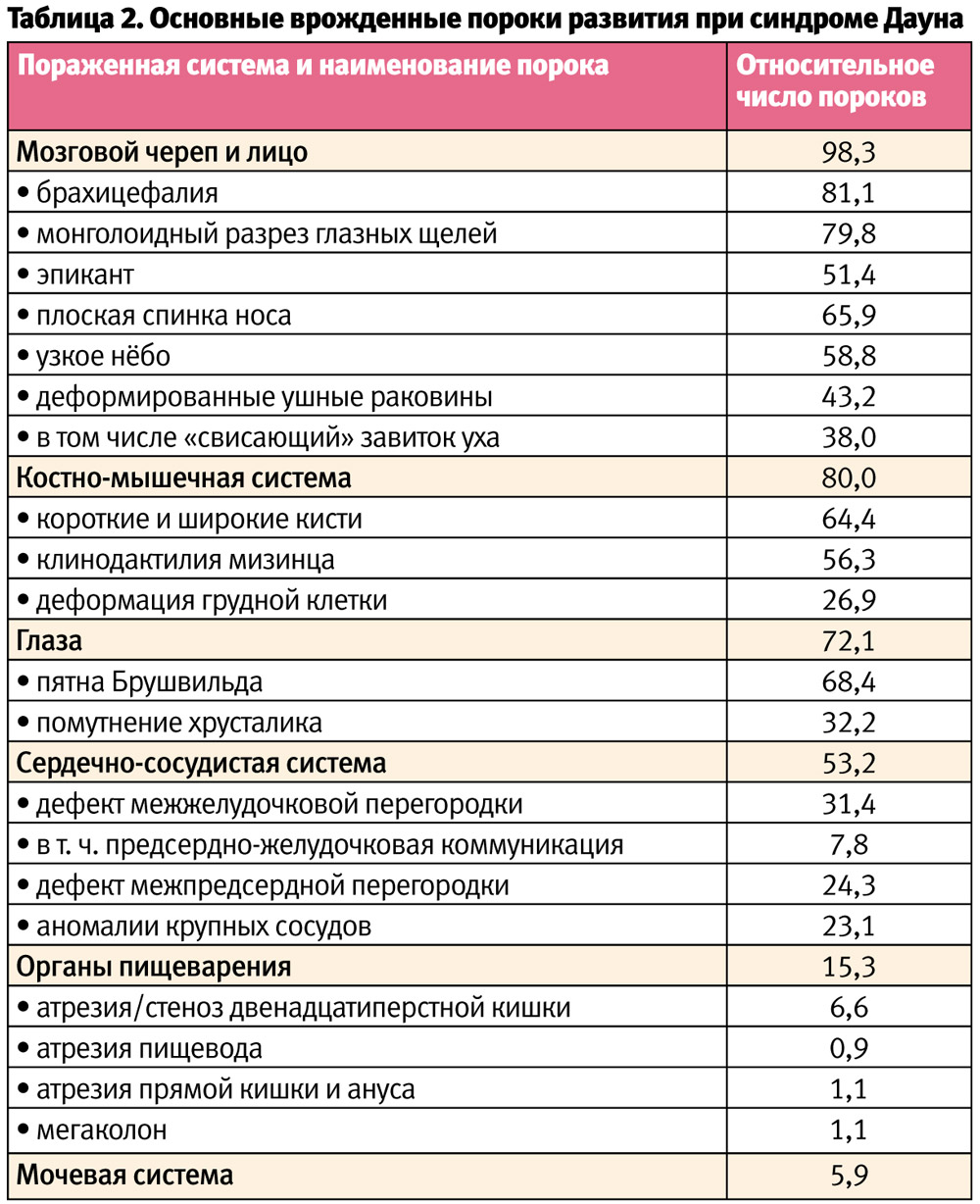
Пренатальная диагностика
До настоящего времени СД — самый сложный и загадочный объект для пренатальной диагностики (ПД), если не сопровождается грубыми ВПР или обнаружением характерных эхографических и биохимических маркеров.
Согласно современной концепции пренатальной профилактики пороков развития и распространенных хромосомных анеуплоидий, важнейшим является формирование групп высокого риска с учетом возраста, анамнеза и результатов ультразвукового и биохимического скрининга, на основе чего беременным избирательно проводятся инвазивные методы пренатальной диагностики (биопсия ворсин хориона [11–14 недель], плацентоцентез [с 15 недель], амниоцентез [17–22 недели], кордоцентез [20–26 недель]) с последующим цитогенетическим исследованием соответственно полученному образцу трофобласта, культуры клеток амниотической жидкости и лимфоцитов крови плода.
Эффективность пренатальной диагностики СД является маркером качества проведения пренатального скрининга в целом.
Скрининг является лишь начальным, предварительным этапом обследования популяции, а лица с положительными результатами скрининга нуждаются в последующем диагностическом обследовании для установления или исключения факта наличия патологического процесса. Говорить об эффективном скрининге можно, если он является массовым, то есть охватывает больше 80% обследуемой части населения. В противном случае скрининг является выборочным (селективным) и не выполняет все возложенные на него задачи.
В 1970-х годах основной метод скрининга хромосомных анеуплоидий (ХА) основывался на возрасте матери, так как из числа всех беременных около 5% женщин были в возрасте 35 лет или старше, и в этой группе рождалось около 30% плодов от общего количества с трисомией 21. Таким образом, скрининг на основе возраста матери, с границей по возрасту 35 лет для определения группы высокого риска, был связан с 5% уровнем скрининг-позитивных значений (также называемые ложноположительными, так как большинство плодов в этой группе нормальные) и 30% вероятностью обнаружения трисомии 21 хромосомы.
В последующие годы в развитых странах появилась тенденция среди женщин беременеть в более позднем возрасте, так что сейчас в общей популяции беременных около 20% женщин в возрасте 35 лет или старше, и эта группа содержит около 50% от общего числа плодов с трисомией 21. В 1980-х годах скрининг основывался на биохимии крови матери и детальном ультразвуковом исследовании во II триместре. В 1990-х годах акцент переместился на I триместр, когда стало ясно, что большинство плодов с основными ХА можно идентифицировать путем комбинированного сочетания возраста матери, толщины воротникового пространства (ТВП) у плода, БХ-маркеров крови беременной в I триместре.
В последние 10 лет было описано несколько дополнительных ультразвуковых маркеров I триместра, оцениваемых при безвыборочном пренатальном скрининге, которые улучшают частоту выявления анеуплоидий до 95% и уменьшают уровень ложноположительных результатов до 3%.


коментарів